Propriétés/EffetsCode ATC
L04AA47
Mécanisme d'action
L'inébilizumab est un anticorps monoclonal qui se lie spécifiquement au CD19, l'antigène de surface cellulaire présent sur les lymphocytes pré-B et B matures, y compris les plasmablastes et certains plasmocytes. Après la liaison de la surface cellulaire aux lymphocytes B, l'inébilizumab favorise la cytotoxicité cellulaire dépendante des anticorps (ADCC) et la phagocytose dépendante des anticorps (ADCP). Les lymphocytes B joueraient un rôle central dans la pathogenèse des TSNMO. Le mécanisme précis par lequel l'inébilizumab exerce ses effets thérapeutiques dans les TSNMO est inconnu, mais on suppose qu'il implique une déplétion en lymphocytes B et peut inclure la suppression de la sécrétion d'anticorps, de la présentation de l'antigène, de l'interaction entre les lymphocytes B et T et de la production de médiateurs inflammatoires.
Pharmacodynamique
La pharmacodynamie de l'inébilizumab a été évaluée à l'aide d'un dosage des lymphocytes B CD20+, car l'inébilizumab peut interférer avec le dosage des lymphocytes B CD19+. Le traitement par inébilizumab diminue le nombre de lymphocytes B CD20+ dans le sang 8 jours après la perfusion. Dans une étude clinique portant sur 174 patients, le nombre de lymphocytes B CD20+ est passé en dessous de la limite inférieure de la normale après 4 semaines chez 100 % des patients traités par inébilizumab et est resté en dessous de la limite inférieure de la normale chez 94 % des patients pendant 28 semaines après le début du traitement. Le délai de réplétion en lymphocytes B après l'administration d'inébilizumab n'est pas connu.
Dans l'étude pivot de patients atteints de TSNMO, la prévalence des anticorps anti-médicaments (ADA) était de 14,7 % à la fin de la PEO; l'incidence globale des ADA apparus au cours du traitement était de 7,1 % (16 sur 225) et la fréquence et le titre des ADA positifs diminuaient au fil du temps avec le traitement par inébilizumab. Le statut ADA-positif n'a pas semblé avoir d'impact cliniquement pertinent sur les paramètres pharmacocinétiques et pharmacodynamiques (lymphocytes B) et n'a pas eu d'impact sur le profil de sécurité à long terme. Il n'y a pas eu d'effet apparent du statut ADA sur le résultat d'efficacité; cependant, l'impact ne peut être pleinement évalué étant donné la faible incidence d'ADA associée au traitement par inébilizumab.
Efficacité clinique
L'efficacité de l'inébilizumab pour le traitement des TSNMO a été étudiée dans un essai clinique randomisé (3:1), en double aveugle, contrôlé par placebo, chez des adultes atteints de TSNMO séropositifs ou séronégatifs pour l'AQP4-IgG. L'étude incluait des patients ayant subi au moins une poussée aiguë de TSNMO au cours de l'année précédente ou au moins 2 poussées au cours des 2 années précédentes ayant nécessité un traitement de secours (par exemple, stéroïdes, échange plasmatique, immunoglobuline intraveineuse), et ayant un score EDSS (Expanded Disability Severity Scale) ≤7,5 (les patients ayant un score de 8,0 étaient éligibles si le patient était raisonnablement capable de participer). Les patients étaient exclus s'ils avaient déjà été traités par des traitements immunosuppresseurs dans un intervalle spécifié pour chacune de ces thérapies. Les traitements immunosuppresseurs de fond pour la prévention des poussées de TSNMO n'étaient pas autorisés. Une cure de corticoïdes oraux de 2 semaines (plus 1 semaine de diminution progressive) a été administrée au début du traitement par inébilizumab dans l'étude pivot.
Les patients ont été traités par des perfusions intraveineuses d'inébilizumab 300 mg le jour 1 et le jour 15, ou par un placebo correspondant, puis ont fait l'objet d'un suivi pendant une période allant jusqu'à 197 jours ou jusqu'à la première poussée confirmée par un comité d'adjudication, appelée période randomisée et contrôlée (PRC). Toutes les poussées potentielles étaient évaluées par un comité d'adjudication (CA) indépendant et soumis à l'aveugle, qui a déterminé si la poussée répondait aux critères définis par le protocole. Les critères de poussée prenaient en compte les poussées dans tous les domaines affectés par les TSNMO (névrite optique, myélite, encéphale et tronc cérébral) et comprenaient des critères basés exclusivement sur des manifestations cliniques substantielles, ainsi que des critères qui majoraient des résultats cliniques plus modestes avec l'utilisation de l'IRM (voir Tableau 3).
Tableau 3. Présentation des critères définis par le protocole pour une poussée de TSNMO
|
Domaine
|
Symptômes représentatifs
|
Résultats cliniques uniquement
|
Résultats cliniques PLUS radiologiques
| |
Nerf optique
|
Vision trouble
Perte de la vue
Douleur oculaire
|
8 critères basés sur les modifications de l'acuité visuelle ou de la malformation pupillaire relative afférente (MPRA)
|
3 critères basés sur les modifications de l'acuité visuelle ou de la MPRA plus présence de résultats d'IRM du nerf optique correspondants
| |
Moelle épinière
|
Douleur profonde ou radiculaire
Paresthésie des extrémités
Faiblesse
Dysfonctionnement du sphincter
Signe de Lhermitte (non isolé)
|
2 critères basés sur les modifications des scores fonctionnels pyramidal, vésical/intestinal ou sensitif
|
2 critères basés sur les modifications des scores fonctionnels pyramidal, vésical/intestinal ou sensitif PLUS résultats d'IRM de la moelle épinière correspondants
| |
Tronc cérébral
|
Nausée
Vomissements réfractaires
Hoquet réfractaire
Autres signes neurologiques (p. ex., vision double, dysarthrie, dysphagie, vertige, paralysie oculomotrice, faiblesse, nystagmus, autre anomalie des nerfs crâniens)
|
Aucun
|
2 critères basés sur les symptômes ou les modifications des scores fonctionnels du tronc cérébral/cérébelleux PLUS résultats d'IRM du tronc cérébral correspondants
| |
Cerveau
|
Encéphalopathie
Dysfonctionnement hypothalamique
|
Aucun
|
1 critère basé sur les modifications des scores fonctionnels cérébral/sensitif/pyramidal PLUS résultats d'IRM cérébrale correspondants
|
Les patients qui ont subi une poussée confirmée par le CA pendant la PCR, ou qui ont terminé la visite du jour 197 sans poussée, ont quitté la PCR et ont eu la possibilité d'intégrer une PEO et d'initier ou de poursuivre le traitement par inébilizumab.
Au total, 230 patients ont été recrutés: 213 patients séropositifs pour l'AQP4-IgG et 17 séronégatifs ont été recrutés; 174 patients ont été traités par inébilizumab et 56 patients ont été traités par placebo durant la PCR de l'étude. Sur les 213 patients séropositifs pour l'AQP4-IgG, 161 ont été traités par l'inébilizumab et 52 ont été traités par placebo pendant la PCR de l'étude. Les caractéristiques à la baseline et les résultats d'efficacité sont présentés pour les patients séropositifs pour l'AQP4-IgG.
Les données démographiques et les caractéristiques de la maladie à l'inclusion étaient équilibrées entre les 2 groupes de traitement (voir Tableau 4).
Tableau 4. Données démographiques et caractéristiques à l'inclusion des patients atteints de TSNMO séropositifs pour l'AQP4-IgG
|
Caractéristique
|
Placebo
N = 52
|
Inébilizumab
N = 161
|
Globalement
N = 213
| |
Âge (années): moyenne (écart type [ET])
|
42,4 (14,3)
|
43,2 (11,6)
|
43,0 (12,3)
| |
Âge ≥65 ans, n (%)
|
4 (7,7)
|
6 (3,7)
|
10 (4,7)
| |
Sexe: Masculin, n (%)
|
3 (5,8)
|
10 (6,2)
|
13 (6,1)
| |
Sexe: Féminin, n (%)
|
49 (94,2)
|
151 (93,8)
|
200 (93,9)
| |
Échelle EDSS (Expanded Disability Status Scale): moyenne (ET)
|
4,35 (1,63)
|
3,81 (1,77)
|
3,94 (1,75)
| |
Durée de la maladie (années): moyenne (ET)
|
2,92 (3,54)
|
2,49 (3,39)
|
2,59 (3,42)
| |
Nombre de rechutes antérieures: ≥2, n (%)
|
39 (75,0)
|
137 (85,1)
|
176 (82,6)
| |
Taux de rechute annualisé: moyenne (ET)
|
1,456 (1,360)
|
1,682 (1,490)
|
1,627 (1,459)
|
Un traitement de secours était instauré si nécessaire en cas de poussées de TSNMO. Tous les patients ont reçu une prémédication avant l'administration du produit expérimental afin de réduire le risque de réactions liées à la perfusion.
Le critère principal d'efficacité était le délai (en jours) de la première poussée de TSNMO confirmée par le CA jusqu'au jour 197 ou avant. Les autres critères d'évaluation secondaires clés comprenaient l'aggravation de l'EDSS par rapport aux valeurs initiales lors de la dernière visite pendant la PCR, le changement par rapport aux valeurs initiales du score binoculaire d'acuité visuelle à faible contraste mesuré par l'échelle des anneaux brisés de Landolt à faible contraste lors de la dernière visite pendant la PCR, le nombre total cumulé de lésions actives à l'IRM (nouvelles lésions rehaussées par le gadolinium ou lésions T2 nouvelles/élargies) pendant la PCR, et le nombre d'hospitalisations liées aux TSNMO. Un patient était considéré comme ayant une aggravation du score EDSS si l'un des critères suivants était rempli: (1) aggravation de 2 points ou plus du score EDSS pour les patients dont le score initial était de 0; (2) aggravation de 1 point ou plus du score EDSS pour les patients dont le score initial était de 1 à 5; (3) aggravation de 0,5 point ou plus du score EDSS pour les patients dont le score initial était de 5,5 ou plus. Bien qu'aucun comparateur n'ait été disponible pendant la PEO, le taux de poussées annualisé a été évalué pendant la période randomisée et celle en ouvert.
Les résultats chez les patients séropositifs pour l'AQP4-IgG sont présentés dans le Tableau 5 et la Figure 1. Dans cette étude, le traitement par inébilizumab a diminué de manière statistiquement significative le risque de poussée de TSNMO confirmée par le CA comparé au placebo (hazard ratio: 0,227, p < 0,0001; réduction de 77,3 % du risque de poussée de TSNMO déterminé par le CA) chez les patients séropositifs pour l'AQP4-IgG. Aucun bénéfice thérapeutique n'a été observé chez les patients séronégatifs pour l'AQP4-IgG.
Dans le groupe inébilizumab, l'aggravation de l'EDSS a été significativement moindre par rapport au groupe placebo (14,9 % versus 34,6 % des patients). Il n'y a pas eu de différence dans le score binoculaire de l'acuité visuelle à faible contraste entre les deux groupes de l'étude. Le nombre cumulé moyen de lésions actives totales à l'IRM (1,7 contre 2,3) et le nombre cumulé moyen d'hospitalisations liées aux TSNMO (1,0 contre 1,4) ont été réduits dans le groupe d'étude inébilizumab.
Tableau 5. Résultats d'efficacité dans l'étude pivot sur les TSNMO séropositifs pour l'AQP4-IgG
|
|
Groupe de traitement
| |
|
Placebo
N = 52
|
Inébilizumab
N = 161
| |
Délai avant la poussée confirmée par le comité d'adjudication (critère d'efficacité principal)
| |
Nombre (%) de patients ayant subi des poussées
|
22 (42,3 %)
|
18 (11,2 %)
| |
Hazard ratio (IC à 95 %)a
|
0,227 (0,1214; 0,4232)
| |
Valeur pa
|
< 0,0001
|
a Méthode de régression de Cox, avec placebo comme groupe de référence.
Figure 1. Courbe de Kaplan-Meier du délai avant la première poussée de TSNMO confirmée par le CA au cours de la PCR chez les patients séropositifs pour l'AQP4-IgG
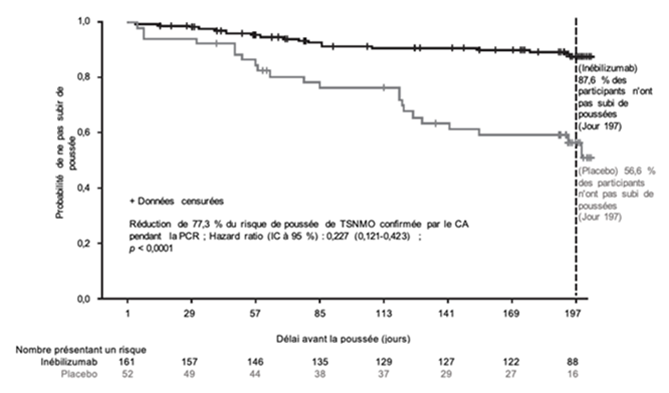
CA comité d'adjudication; AQP4-IgG immunoglobuline G anti-aquaporine-4; IC intervalle de confiance; TSNMO trouble du spectre de neuromyélite optique; PCR période contrôlée randomisée.
Sur les PCR et PEO, le taux annualisé de poussées de TSNMO déterminées par le CA a été analysé à titre de critère d'évaluation secondaire et chez les patients séropositifs pour l'AQP4-IgG traités par l'inébilizumab, le résultat était de 0,09.
|

