| ||||||||||||||||
|
| Suchresultat - FI zu Trikafta |
| Fachinformation zu Trikafta: | Vertex Pharmaceuticals (CH) GmbH |
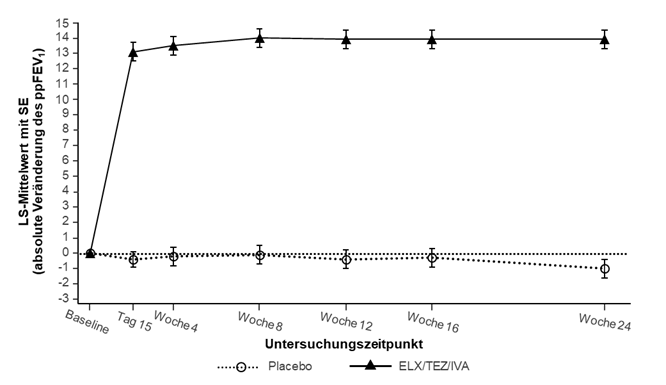
Eigenschaften/WirkungenATC-Code Tabelle 7: Liste der CFTR-Genmutation en, die auf Elexacaf tor/Tezacaftor/Ivaca ftor ansprechen Mutationen, die basierend auf klinischen Daten auf Trikafta ansprec hen 2789+5G→A D1152H L997F P5L R1066H 3272-26A→G F508del L1077P R117C S945L 3849+10kbC→T G85E M1101K R347H T338I A455E L206W N1303K R347P V232D Mutationen, die basierend auf In-vitro-Daten auf Trikafta ansprechen 3141del9 E588V G970D L165S R117G S589N 546insCTA E822K G1061R L320V R117H S737F A46D F191V G1069R L346P R117L S912L A120T F311del G1244E L453S R117P S977F A234D F311L G1249R L967S R170H S1159F A349V F508C G1349D L1324P R258G S1159P A554E F508C;S1251N † H139R L1335P R334L S1251N A1006E F575Y H199Y L1480P R334Q S1255P A1067T F1016S H939R M152V R347L T1036N D110E F1052V H1054D M265R R352Q T1053I D110H F1074L H1085P M952I R352W V201M D192G F1099L H1085R M952T R553Q V456A D443Y G27R H1375P P67L R668C V456F D443Y;G576A; R668C † G126D I148T P205S R751L V562I D579G G178E I175V P574H R792G V754M D614G G178R I336K Q98R R933G V1153E D836Y G194R I502T Q237E R1070Q V1240G D924N G194V I601F Q237H R1070W V1293G D979V G314E I618T Q359R R1162L W361R D1270N G463V I807M Q1291R R1283M W1098C E56K G480C I980K R31L R1283S W1282R E60K G551D I1027T R74Q S13F Y109N E92K G551S I1139V R74W S341P Y161D E116K G576A I1269N R74W; D1270N † S364P Y161S E193K G576A;R668C † I1366N R74W;V201M † S492F Y563N E403D G622D K1060T R74W;V201M; D1270N † S549N Y1014C E474K G628R L15P R75Q S549R Y1032C Mutationen, die basierend auf Extrapolation von Studie 445-124 auf Trikafta ansprechen 711+3A→G E831X † Komplexe/zusammeng esetzte Mutationen, bei denen ein einzelnes Allel des CFTR-Gens mehrere Mutationen aufweist. Sie existieren unabhängig von Mutationen auf dem anderen Allel. Tabelle 8: Geeignete auf Elexacaftor/Tez acaftor/Ivacaftor ansprechende CFTR-Mu tationen 2789+5G>A D1152H L997F R117C T338I 3272-26A>G G85E M1101K R347H V232D 3849+10kbC>T L1077P P5L R347P A455E L206W R1066H S945L Tabelle 9: Primäre und wichtigste sekundäre Wirksamkeitsanalysen, vollständiges Analyseset (Studie 445-102) Analyse Statistik Placebo N=203 Trikafta N=200 Primäre Wirksamkeitsanalyse Absolute Veränderung des ppFEV1 Behandlungsunterschi N.a. 14,3 (12,7; 15,8) von Baseline bis einschliesslich ed (95 % KI) Woche 24 (Prozentpunkte) p-Wert N.a. p<0,0001 Veränderung innerhalb der Gruppe -0,4 (0,5) 13,9 (0,6) (SE) Wichtigste sekundäre Wirksamkeitsa nalysen Absolute Veränderung des ppFEV1 Behandlungsunterschi N.a. 13,7 (12,0; 15,3) gegenüber Baseline in Woche 4 ed (95 % KI) (Prozentpunkte) p-Wert N.a. p<0,0001 Veränderung innerhalb der Gruppe -0,2 (0,6) 13,5 (0,6) (SE) Anzahl der pulmonalen Anzahl der Ereigniss 113 (0,98) 41 (0,37) Exazerbationen von Baseline bis e (Ereignisrate pro einschliesslich Woche 24‡ Jahr††) Rate Ratio (95 % KI) N.a. 0;37 (0,25; 0,55) p-Wert N.a. p<0,0001 Absolute Veränderung der Behandlungsunterschi N.a. -41,8 (-44,4; -39,3) Schweisschloridkonzentra-tion von ed (95 % KI) Baseline bis einschliesslich Woche 24 (mmol/l) p-Wert N.a. p<0,0001 Veränderung innerhalb der Gruppe -0,4 (0,9) -42,2 (0,9) (SE) Absolute Veränderung des Scores Behandlungsunterschi N.a. 20,2 (17,5; 23,0) der respiratorischen Domäne des ed (95 % KI) CFQ-R von Baseline bis einschliesslich Woche 24 (Punkte) p-Wert N.a. p<0,0001 Veränderung innerhalb der Gruppe -2,7 (1,0) 17,5 (1,0) (SE) Absolute Veränderung des BMI Behandlungsunterschi N.a. 1,04 (0,85; 1,23) gegenüber Baseline in Woche 24 ed (95 % KI) (kg/m²) p-Wert N.a. p<0,0001 Veränderung innerhalb der Gruppe 0,09 (0,07) 1,13 (0,07) (SE) Absolute Veränderung der Behandlungsunterschi N.a. -41,2 (-44,0; -38,5) Schweisschloridkonzentra-tion ed (95 % KI) gegenüber Baseline in Woche 4 (mmol/l) p-Wert N.a. p<0,0001 Veränderung innerhalb der Gruppe 0,1 (1,0) -41,2 (1,0) (SE) Absolute Veränderung des Scores Behandlungsunterschi N.a. 20,1 (16,9; 23,2) der respiratorischen Domäne des ed (95 % KI) CFQ-R gegenüber Baseline in Woche 4 (Punkte) p-Wert N.a. p<0,0001 Veränderung innerhalb der Gruppe -1,9 (1,1) 18,1 (1,1) (SE) ppFEV1: forciertes exspiratorische s Volumen in 1 Sekunde in Prozent des Sollwerts; KI: Konfidenzinterv all; SE: Standardfehler; N.a.: nicht anwendbar; CFQ-R: Cystic Fibrosis Questionnaire-Revised, überarbeiteter Fragebogen zu zystischer Fibrose; BMI: Body Mass Index (Körpermassenindex). ‡ Eine pulmonale Exazerbation war definiert als eine Veränderung der antibiotischen Therapie (i.v., inhalativ oder oral) aufgrund von mindestens 4 von 12 im Voraus festgelegten sinopulmonalen Zeichen/Symptomen. †† Geschätzte Ereignisrate pro Jahr, berechnet anhand von 48 Wochen pro Jahr.
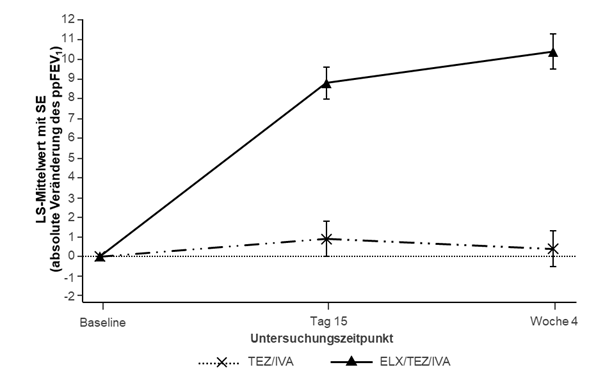
SE: Standardfehler; ELX/TEZ/IVA: Elexacaftor/Tezacaftor/Ivacaftor Tabelle 10: Primäre und
wichtigste sekundäre Wirksamkeitsa
nalysen, vollständiges Analyseset
(Studie 445-103)
Analyse* Statistik Tezacaftor/ Ivacafto Trikafta N=55
r# N=52
Primäre Wirksamkeitsanalyse
Absolute Veränderung des ppFEV1 Behandlungsunterschi N.a. 10,0 (7,4; 12,6)
gegenüber Baseline in Woche 4 ed (95 % KI)
(Prozentpunkte)
p-Wert N.a. p<0,0001
Veränderung innerhalb der Gruppe 0,4 (0,9) 10,4 (0,9)
(SE)
Wichtigste sekundäre Wirksamkeitsa
nalysen
Absolute Veränderung der Behandlungsunterschi N.a. -45,1 (-50,1; -40,1)
Schweisschloridkonzentration ed (95 % KI)
gegenüber Baseline in Woche 4
(mmol/l)
p-Wert N.a. p<0,0001
Veränderung innerhalb der Gruppe 1,7 (1,8) -43,4 (1,7)
(SE)
Absolute Veränderung des Scores Behandlungsunterschi N.a. 17,4 (11,8; 23,0)
der respiratorischen Domäne des ed (95 % KI)
CFQ-R gegenüber Baseline in Woche
4 (Punkte)
p-Wert N.a. p<0,0001
Veränderung innerhalb der Gruppe -1,4 (2,0) 16,0 (2,0)
(SE)
ppFEV1: forciertes exspiratorische
s Volumen in 1 Sekunde in Prozent
des Sollwerts; KI: Konfidenzinterv
all; SE: Standardfehler; N.a.:
nicht anwendbar; CFQ-R: Cystic
Fibrosis Questionnaire-Revised,
überarbeiteter Fragebogen zu
zystischer Fibrose. * Die
Baseline für den primären und die
wichtigsten sekundären Endpunkte
ist definiert als das Ende der
4-wöchigen Einlaufphase mit
Tezacaftor/Ivacaftor und
Ivacaftor. # Behandlungsschema
von Tezacaftor/Ivacaftor und
Ivacaftor.
SE: Standardfehler; TEZ/IVA: Tezacaftor/Ivacaftor; ELX/TEZ/IVA: Elexacaftor/Tezacaftor/Ivacaftor
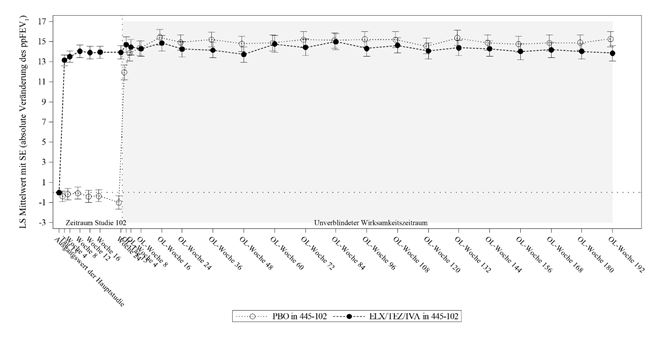
ppFEV1 = forciertes exspiratorisches Volumen in 1 Sekunde in Prozent des Sollwerts; LS-Mittelwert = Mittelwert nach der Methode der kleinsten Quadrate; SE = Standardfehler; OL = unverblindet
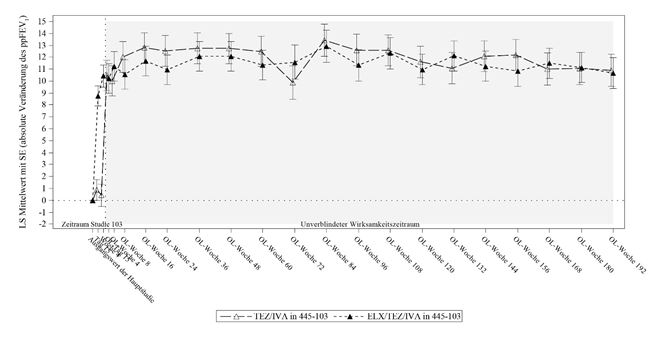
ppFEV1 = forciertes exspiratorisches Volumen in 1 Sekunde in Prozent des Sollwerts; LS-Mittelwert = Mittelwert nach der Methode der kleinsten Quadrate; SE = Standardfehler; OL = unverblindet Tabelle 11: Studie
445-105 sekundäre
unverblindete
Wirksamkeitsanalyse,
vollständiges
Analyseset (F/MF
und F/F Patienten)
Analyse Statistik Studie 445-105
Woche 192
PBO in 445-102 N = ELX/TEZ/IVA in TEZ/IVA in 445-103 ELX/TEZ/IVA in
203 445-102 N = 196 N = 52 445-103 N = 55
Absolute Veränderung n 136 133 32 36
des ppFEV1 gegenübe
r dem Ausgangswert*
(Prozentpunkte)
LS-Mittelwert 15,3 13,8 10,9 10,7
95 %-KI (13,7; 16,8) (12,3; 15,4) (8,2; 13,6) (8,1; 13,3)
Absolute Veränderung n 133 128 31 38
der Schweisschlorid
-konzentration
gegenüber dem
Ausgangswert*
(mmol/l)
LS-Mittelwert -47,0 -45,3 -48,2 -48,2
95 %-KI (-50,1; -43,9) (-48,5; -42,2) (-55,8; -40,7) (-55,1; -41,3)
Anzahl PEx während Anzahl der Ereigniss 385 71
des kumulativen e
TC-Wirksamkeits-zeit
raums†
Geschätzte Ereignisr 0,21 (0,17; 0,25) 0,18 (0,12; 0,25)
ate pro Jahr (95
%-KI)
ppFEV1 = forciertes
exspiratorisches
Volumen in 1 Sekunde
in Prozent des
Sollwerts; SwCl =
Schweisschloridkonze
ntration; PEx =
pulmonale Exazerbati
on; LS-Mittelwert =
Mittelwert nach der
Methode der kleinste
n Quadrate; KI =
Konfidenzintervall;
PBO = Placebo; TC =
Dreifachkombination
* Ausgangswert =
Ausgangswert der
Hauptstudie † Bei
Patienten, die auf
die ELX/TEZ/IVA-Grup
pe randomisiert
wurden, umfasst der
kumulative TC-Wirksa
mkeitszeitraum
Daten aus den
Hauptstudien bis
192 Behandlungswoche
n in Studie 445-105
(N=255, einschliessl
ich 4 Patienten,
die nicht in 445-105
übernommen wurden).
Bei Patienten, die
auf die Placebo-
oder TEZ/IVA-Gruppe
randomisiert wurden,
umfasst der kumulat
ive TC-Wirksamkeitsz
eitraum nur Daten
für einen Behandlung
szeitraum von 192
Wochen in Studie
445-105 (N=255).
Tabelle 12: Primäre und sekundäre
Wirksamkeitsanalysen,
vollständiges Analyseset (Studie
445-104)
Analyse* Statistik Kontrollgruppe# Trikafta N=132
N=126
Primäre Analyse
Absolute Veränderung des ppFEV1 Veränderung innerhal 0,2 (-0,7; 1,1) 3,7 (2,8; 4,6)
gegenüber dem Ausgangswert bis b der Gruppe (95 %
einschliesslich Woche 8 KI)
(Prozentpunkte)
p-Wert N.a. p<0,0001
Wichtigste und sonstige sekundäre
Analysen
Absolute Veränderung der Veränderung innerhal 0,7 (-1,4; 2,8) -22,3 (-24,5; -20,2)
Schweisschloridkonzentration b der Gruppe (95 %
gegenüber dem Ausgangswert bis KI)
einschliesslich Woche 8 (mmol/l)
p-Wert N.a. p<0,0001
Absolute Veränderung des ppFEV1 Behandlungsunterschi N.a. 3,5 (2,2; 4,7)
gegenüber dem Ausgangswert bis ed (95 % KI)
einschliesslich Woche 8 im
Vergleich zur Kontrollgruppe
(Prozentpunkte)
p-Wert N.a. p<0,0001
Absolute Veränderung der Behandlungsunterschi N.a. -23,1 (-26,1; -20,1)
Schweisschloridkonzentration ed (95 % KI)
gegenüber dem Ausgangswert bis
einschliesslich Woche 8 im
Vergleich zur Kontrollgruppe
(mmol/l)
p-Wert N.a. p<0,0001
Absolute Veränderung des Scores Veränderung innerhal 1,6 (-0,8; 4,1) 10,3 (8,0; 12,7)
der respiratorischen Domäne des b der Gruppe (95 %
CFQ-R gegenüber dem Ausgangswert KI)
bis einschliesslich Woche 8
(Punkte)±
Absolute Veränderung des Scores Behandlungsunterschi N.a. 8,7 (5,3; 12,1)
der respiratorischen Domäne des ed (95 % KI)
CFQ-R gegenüber dem Ausgangswert
bis einschliesslich Woche 8 im
Vergleich zur Kontrollgruppe
(Punkte)±
ppFEV1: forciertes exspiratorische
s Volumen in 1 Sekunde in Prozent
des Sollwerts; KI: Konfidenzinterv
all; N.a.: nicht anwendbar;
CFQ-R: Cystic Fibrosis
Questionnaire-Revised,
überarbeiteter Fragebogen zu
zystischer Fibrose. * Die
Baseline für die primären und
sekundären Endpunkte ist
definiert als das Ende der
4-wöchigen Einlaufphase mit
Ivacaftor oder Tezacaftor/Ivacafto
r. # Ivacaftor-Gruppe oder
Tezacaftor/Ivacaftor-Gruppe. ±
Die CFQ-R-Ergebnisse wurden nicht
nach dem hierarchischen Verfahren
für multiples Testen auf
Multiplizität kontrolliert.
Tabelle 13: Sekundäre Wirksamkeitsanalysen, vollständiges Analyseset über 24
Wochen (Studie 445-106, Teil B)
Analyse Veränderung innerhal
b der Gruppe (95 %
KI) für Trikafta
N=66
Absolute Veränderung des ppFEV1-Werts von Baseline bis einschliesslich Woche 10,2 (7,9; 12,6)
24 (Prozentpunkte)
Absolute Veränderung der Schweisschloridkonzentration von Baseline bis -60,9 (-63,7; -58,2)
einschliesslich Woche 24 (mmol/l)
Anzahl der pulmonalen Exazerbationen bis einschliesslich Woche 24‡ 4 (0,12) ††
KI: Konfidenzintervall; ppFEV1: forciertes exspiratorisches Volumen in 1
Sekunde in Prozent des Sollwerts. ‡ Eine pulmonale Exazerbation war definiert
als eine Veränderung der antibiotischen Therapie (i.v., inhalativ oder oral)
aufgrund von mindestens 4 von 12 im Voraus festgelegten sinopulmonalen
Zeichen/Symptomen. †† Anzahl von Ereignissen und geschätzte Ereignisrate pro
Jahr, berechnet anhand von 48 Wochen pro Jahr.
Tabelle 14: Sekundäre
Wirksamkeitsanalyse, vollständiges
Analyseset (N=64) (Studie
445-107)
Analyse Statistik Absolute Veränderung Absolute Veränderung
gegenüber Baseline* gegenüber Baseline*
in Woche 96 in Woche 192
ppFEV1 (Prozentpunkte) n 45 27
LS-Mittelwert 11,2 9,6
95 %-KI (8,3; 14,2) (5,4; 13,7)
Schweisschloridkonzentration n 56 35
(mmol/l)
LS-Mittelwert -62,3 -57,9
95 %-KI (-65,9; -58,8) (-63,3; -52,5)
PEx während des kumulativen Anzahl der Ereigniss 7 11
TC-Wirksamkeitszeitraums† e
Beobachtete Ereignisrate pro Jahr 0,04 0,045
ppFEV1 = forciertes exspiratorisch
es Volumen in 1 Sekunde in
Prozent des Sollwerts; PEx =
pulmonale Exazerbation;
LS-Mittelwert = Mittelwert nach
der Methode der kleinsten
Quadrate; KI = Konfidenzintervall;
TC = Dreifachkombination *
Ausgangswert = Ausgangswert der
Hauptstudie † Der kumulative
TC-Wirksamkeitszeitraum umfasst
die Daten der 66 Patienten, die
in die Hauptstudie (Studie
445-106 Teil B) aufgenommen
wurden und mindestens eine
Behandlungsdosis erhielten
und/oder während der Studie
445-107 mindestens eine Dosis
erhielten.
Tabelle 15: Sekundäre Wirksamkeitsanalysen,
vollständiges Analyseset (Studie 445-111)
Analyse Statistik Veränderung innerhal
b der Gruppe (95 %
KI) für Trikafta
Absolute Veränderung der Schweisschloridkonzentration N* LS-Mittelwert 75 -57,9 (-61,3;
von Baseline bis einschliesslich Woche 24 (mmol/l) (95 % KI) -54,6)
Absolute Veränderung des LCI2.5 von Baseline bis N LS-Mittelwert (95 63‡ -0,83 (-1,01;
einschliesslich Woche 24 % KI) -0,66)
Anzahl der pulmonalen Exazerbationen bis N Anzahl der Ereigni 75 12 (0,32) ††
einschliesslich Woche 24** sse (geschätzte
Ereignisrate pro
Jahr)
KI: Konfidenzintervall; LCI: Lung Clearance Index. * N
ist die Anzahl der Patienten im entsprechenden
vollständigen Analyseset ‡ Der LCI wurde nur bei
Patienten bewertet, die beim Screening 3 Jahre oder
älter waren ** Altersspezifische Definitionen von PEx
werden für Patienten von 2 bis einschliesslich 5 Jahren
und ab 6 Jahren verwendet. †† Anzahl der Ereignisse und
geschätzte Ereignisrate pro Jahr auf der Grundlage von
48 Wochen pro Jahr.
Tabelle 16: Primäre und sekundäre Wirksamkeitsanalysen, vollständiges Analyseset (Studie 445-124) Analyse Statistik Placebo N = 102 ELX/TEZ/IVA N = 205 Primäre Analyse Absolute Veränderung des ppFEV1 Behandlungsunterschi NA 9,2 (7,2; 11,3) gegenüber Baseline bis ed (95 %-KI) einschliesslich Woche 24 (Prozentpunkte) p-Wert NA p<0,0001 Veränderung innerhalb der Gruppe -0,4 (0,8) 8,9 (0,6) (SE) Sekundäre Analyse Absolute Veränderung der Behandlungsunterschi NA -28,3 (-32,1, -24,5) Schweisschloridkonzentration ed (95 %-KI) gegenüber Baseline bis einschliesslich Woche 24 (mmol/l) p-Wert NA p<0,0001 Veränderung innerhalb der Gruppe 0,5 (1,6) -27,8 (1,1) (SE) Absolute Veränderung des Scores Behandlungsunterschi NA 19,5 (15,5; 23,5) der respiratorischen Domäne des ed (95 %-KI) CFQ-R von Baseline bis einschliesslich Woche 24 (Punkte) p-Wert NA p<0,0001 Veränderung innerhalb der Gruppe -2,0 (1,6) 17,5 (1,2) (SE) Absolute Veränderung des BMI Behandlungsunterschi NA 0,47 (0,24; 0,69) gegenüber Baseline in Woche 24 ed (95 %-KI) (kg/m2) p-Wert NA p<0,0001 Veränderung innerhalb der Gruppe 0,35 (0,09) 0,81 (0,07) (SE) Absolute Veränderung des Behandlungsunterschi NA 1,3 (0,6; 1,9) Körpergewichts gegenüber Baseline ed (95 %-KI) in Woche 24 (kg) p-Wert NA p<0,0001 Veränderung innerhalb der Gruppe 1,2 (0,3) 2,4 (0,2) (SE) Anzahl der PEx bis einschliesslich Rate Ratio (95 %-KI) NA 0,28 (0,15; 0,51) Woche 24 p-Wert NA p<0,0001 Anzahl der Ereignisse 40 21 Geschätzte Rate pro Jahr 0,63 0,17 BMI: Body Mass Index (Körpermassen index); CFQ-R RD: Cystic Fibrosis Questionnaire-Revised Respiratory Domain (überarbeiteter Fragebogen zu zystischer Fibrose, respiratorische Domäne); ELX: Elexacaftor; IVA: Ivacaftor; N: Grösse der Gesamtstichprobe; p: Wahrscheinlichkeit; PEx: pulmonale Exazerbation; ppFEV1: forciertes exspiratorisches Volumen in 1 Sekunde in Prozent des Sollwerts; SE: Standardfehler; TEZ: Tezacaftor. | |
| ||||||||||||
|
|