ZusammensetzungWirkstoffe
Pitolisantum (ut Pitolisanti hydrochloridum)
Hilfsstoffe
Cellulosum microcristallinum, Crospovidonum, Talcum, Poly(alcohol vinylicus), Magnesii stearas, Macrogolum 3350, Silica colloidalis anhydrica, Color E 171
Indikationen/AnwendungsmöglichkeitenWakix wird angewendet bei Erwachsenen, Jugendlichen und Kindern ab einem Alter von 6 Jahren zur Behandlung der Narkolepsie mit oder ohne Kataplexie (siehe auch «Eigenschaften/ Wirkungen»).
Dosierung/AnwendungDie Behandlung sollte von einem Arzt bzw. einer Ärztin eingeleitet werden, der bzw. die Erfahrung in der Behandlung von Schlafstörungen hat.
Dosierung
Erwachsene
Wakix sollte in Abhängigkeit vom individuellen Ansprechen des Patienten und der individuellen Verträglichkeit in der niedrigsten wirksamen Dosis, gemäss nachstehendem Dosissteigerungsschema angewendet werden. Eine Dosis von 36 mg/Tag sollte nicht überschritten werden:
-Woche 1: Anfangsdosis von 9 mg (zwei 4,5 mg Tabletten) pro Tag.
-Woche 2: Die Dosis kann auf 18 mg (eine 18 mg Tablette) pro Tag erhöht oder auf 4,5 mg (eine 4,5 mg Tablette) pro Tag verringert werden
-Woche 3: Die Dosis kann auf 36 mg (zwei 18 mg Tabletten) pro Tag erhöht werden.
Die Dosis kann jederzeit nach Ermessen des Arztes bzw. der Ärztin und gemäss dem Ansprechen des Patienten verringert (bis auf 4,5 mg pro Tag) oder erhöht (auf bis zu 36 mg pro Tag) werden.
Die Tagesgesamtdosis sollte als Einzeldosis am Morgen während des Frühstücks eingenommen werden.
Aufrechterhaltung der Wirksamkeit
Da nur begrenzt Daten zur Langzeit-Wirksamkeit vorliegen (siehe «Eigenschaften/ Wirkungen»), sollte der Arzt bzw. die Ärztin regelmässig überprüfen, ob die Behandlung weiterhin wirksam ist.
Besondere Patientengruppen
Ältere Patienten
Zur Anwendung bei älteren Patienten liegen nur begrenzte Daten vor. Daher sollte die Dosis entsprechend der Nieren- und Leberfunktion des Patienten angepasst werden.
Nierenfunktionsstörung
Bei Patienten mit Nierenfunktionsstörung sollte die Tageshöchstdosis 18 mg betragen.
Leberfunktionsstörung
Bei Patienten mit mittelschwerer Leberfunktionsstörung (Child-Pugh-Klasse B) kann die Tagesdosis zwei Wochen nach Beginn der Therapie erhöht werden. Eine Höchstdosis von 18 mg darf nicht überschritten werden (siehe «Pharmakokinetik»).
Pitolisant darf bei Patienten mit schwerer Leberfunktionsstörung (Child-Pugh-Klasse C) nicht angewendet werden (siehe «Kontraindikationen»).
Bei Patienten mit leichter Leberfunktionsstörung ist keine Dosisanpassung erforderlich.
Kinder und Jugendliche
Wakix sollte je nach dem individuellen Ansprechen des Patienten und der Verträglichkeit gemäss einem Dosissteigerungsschema in der optimalen Dosis angewendet werden, ohne eine Dosis von 36 mg/Tag (18 mg/Tag bei Kindern mit einem Körpergewicht unter 40 kg) zu überschreiten.
-Woche 1: Anfangsdosis von 4,5 mg (eine 4,5-mg-Tablette) pro Tag.
-Woche 2: Die Dosis kann auf 9 mg (zwei 4,5-mg-Tabletten) pro Tag erhöht werden.
-Woche 3: Die Dosis kann auf 18 mg (eine 18-mg-Tablette) pro Tag erhöht werden.
-Woche 4: Bei Kindern ab einem Gewicht von 40 kg kann die Dosis auf 36 mg (zwei 18-mg-Tabletten) pro Tag erhöht werden.
Die Dosis kann jederzeit im Ermessen des Arztes und gemäss dem Ansprechen des Patienten verringert (bis auf 4,5 mg pro Tag) oder erhöht (bis zu 36 mg pro Tag bei Kindern ab einem Gewicht von 40 kg oder 18 mg pro Tag bei Kindern unter einem Gewicht von 40 kg) werden.
Die Tagesgesamtdosis sollte als Einzeldosis am Morgen während des Frühstücks verabreicht werden.
Schlechte Metabolisierer
Im Vergleich zu extensiven CYP2D6-Metabolisierern ist bei schlechten CYP2D6-Metabolisierern eine höhere systemische Exposition (um bis zu dem 3-Fachen) zu beobachten. Im Rahmen der Auftitration sollte diese höhere Exposition bei Dosiserhöhungen berücksichtigt werden.
Art der Anwendung
Die Filmtablette ist unzerkaut mit ausreichend Flüssigkeit ganz zu schlucken.
Kontraindikationen·Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung.
·Schwere Leberfunktionsstörung (Child-Pugh-Klasse C).
·Stillzeit (siehe «Schwangerschaft/Stillzeit»).
Warnhinweise und VorsichtsmassnahmenPsychiatrische Erkrankungen
Pitolisant sollte bei Patienten mit psychiatrischen Erkrankungen, wie z. B. schweren Angststörungen oder schweren Depressionen mit Suizidneigung, wegen möglicher Verschlechterung dieser Krankheitsbilder nur nach individueller Nutzen-Risiko Abwägung angewendet werden. Bei mit Pitolisant behandelten Patienten mit einer psychiatrischen Vorgeschichte wurden Suizidgedanken gemeldet.
Leber- oder Nierenfunktionsstörungen
Pitolisant sollte bei Patienten, die entweder an einer Nierenfunktionsstörung oder an einer mittelschweren Leberfunktionsstörung (Child-Pugh-Klasse B) leiden, mit Vorsicht angewendet werden. Das Dosisschema sollte gemäss «Dosierung/Anwendung» angepasst werden.
Erkrankungen des Gastrointestinaltrakts
Im Zusammenhang mit der Anwendung von Pitolisant wurde über Magenerkrankungen berichtet; daher sollte das Arzneimittel bei Patienten mit säurebedingten Magenerkrankungen (siehe «Unerwünschte Wirkungen») oder bei gleichzeitiger Anwendung von Magenschleimhaut-schädigenden Arzneimitteln wie Kortikosteroiden oder NSAR mit Vorsicht angewendet werden.
Ernährungsstörungen
Pitolisant sollte bei Patienten mit schwerer Adipositas oder schwerer Anorexie mit Vorsicht angewendet werden (siehe «Unerwünschte Wirkungen»). Im Falle einer signifikanten Veränderung des Körpergewichts sollte die Behandlung durch den Arzt bzw. die Ärztin erneut beurteilt werden.
Herzerkrankungen
In zwei eigens für die Untersuchung der QT-Zeit durchgeführten Studien führten Pitolisant-Dosen über der therapeutischen Dosierung (das 3- bis 6-Fache der therapeutischen Dosierung, d. h. 108 mg bis 216 mg) zu einer leichten bis mässigen Verlängerung des QTc-Intervalls (10-13 ms). In klinischen Studien konnte bei therapeutischen Dosierungen von Pitolisant kein spezifisches Signal zur kardialen Sicherheit ermittelt werden. Trotzdem sollten Patienten mit Erkrankungen des Herzens, Patienten, die gleichzeitig mit anderen Arzneimitteln behandelt werden, welche die QT-Zeit verlängern oder die bekanntermassen das Risiko für Repolarisationsstörungen erhöhen, oder Patienten, die gleichzeitig mit Arzneimitteln behandelt werden, welche die Cmax und die AUC von Pitolisant signifikant erhöhen (siehe «Interaktionen»), sowie Patienten mit schweren Nieren- bzw. mittelschweren Leberfunktionsstörungen (siehe «Warnhinweise und Vorsichtsmassnahmen») sorgfältig überwacht werden, insbesondere inklusive EKG- und Elektrolyt-Kontrollen. (siehe «Interaktionen»).
Epilepsie
Bei hohen Dosierungen wurde in Tiermodellen über Konvulsionen berichtet (siehe «Präklinische Daten»). In klinischen Studien wurde bei einem epileptischen Patienten eine Verschlimmerung der Epilepsie berichtet. Bei Patienten mit schwerer Epilepsie ist Vorsicht geboten.
Frauen im gebärfähigen Alter
Frauen im gebärfähigen Alter müssen während und mindestens bis zu 21 Tagen nach der Behandlung eine zuverlässige Verhütungsmethode anwenden (basierend auf der Halbwertzeit von Pitolisant und dessen Metaboliten). Pitolisant kann die Wirksamkeit von hormonellen Kontrazeptiva reduzieren. Daher muss eine alternative Verhütungsmethode angewendet werden, wenn die Patientin hormonelle Kontrazeptiva anwendet (siehe «Interaktionen» und «Schwangerschaft/Stillzeit»).
Arzneimittelwechselwirkungen
Die Kombination von Pitolisant und Substraten von CYP3A4 mit einer geringen therapeutischen Breite sollte vermieden werden (siehe «Interaktionen»).
Rebound-Effekt
In klinischen Studien wurde über keinen Rebound-Effekt berichtet. Trotzdem sollte beim Absetzen der Behandlung eine Überwachung erfolgen.
Drogenmissbrauch
Pitolisant zeigte laut klinischen Daten kein oder ein geringes Missbrauchspotential (spezifische Studie zum Missbrauchspotenzial beim Menschen in Dosen von 36 mg bis 216 mg bei Erwachsenen und beobachtete missbrauchsbedingte Nebenwirkungen in Phase-3-Studien).
InteraktionenAntidepressiva
Tri- oder tetrazyklische Antidepressiva (z. B. Imipramin, Clomipramin, Mirtazapin) können die Wirksamkeit von Pitolisant beeinträchtigen, da sie eine Histamin-H1-rezeptzorantagonistische Wirkung aufweisen und möglicherweise die Wirkung von endogenem Histamin, das aufgrund der Behandlung im Gehirn ausgeschüttet wird, aufheben.
Antihistaminika
Antihistaminika (H1-Rezeptor-Antagonisten), die die Blut-Hirn-Schranke überwinden (z. B. Pheniraminmaleat, Chlorpheniramin, Diphenhydramin, Promethazin, Mepyramin, Doxylamin), können die Wirksamkeit von Pitolisant beeinträchtigen.
Die QT-Zeit verlängernde Stoffe oder Stoffe, die bekanntermassen das Risiko für Repolarisationsstörungen erhöhen
Die Kombination mit Pitolisant sollte nur unter sorgfältiger Überwachung stattfinden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Pharmakokinetische Interaktionen
Arzneimittel, die den Metabolismus von Pitolisant beeinträchtigen
Enzyminduktoren
Die gleichzeitige Anwendung von Pitolisant und Rifampicin in mehrfachen Dosierungen führt zu einer signifikanten Verringerung der mittleren Cmax und der AUC von Pitolisant von ca. 39 % bzw. 50 %. Daher ist bei der gleichzeitigen Anwendung von Pitolisant mit starken CYP3A4-Induktoren (z. B. Rifampicin, Phenobarbital, Carbamazepin, Phenytoin) Vorsicht geboten. Bei der Anwendung von Johanniskraut (Hypericum perforatum) ist aufgrund dessen starker CYP3A4-induzierender Wirkung bei gleichzeitiger Anwendung mit Pitolisant Vorsicht geboten. Wenn beide Wirkstoffe kombiniert werden, sollte eine klinische Überwachung erfolgen und schliesslich während der kombinierten Anwendung und eine Woche nach der Behandlung mit dem Induktor eine Dosisanpassung vorgenommen werden.
In einer klinischen Studie mit Mehrfachdosierung wurde bei Anwendung einer Kombination aus Pitolisant und Probenecid die AUC von Pitolisant um ca. 34 % reduziert.
CYP2D6-Inhibitoren
Die gleichzeitige Anwendung von Pitolisant und Paroxetin führt zu einer signifikanten Erhöhung der mittleren Cmax und der AUC0—72h von Pitolisant von ca. 47 % bzw. 105 %. Angesichts der 2-fachen Erhöhung der Pitolisant-Exposition ist bei der gleichzeitigen Anwendung von Pitolisant und CYP2D6- Inhibitoren (z. B. Paroxetin, Fluoxetin, Venlafaxin, Duloxetin, Bupropion, Chinidin, Terbinafin, Cinacalcet) Vorsicht geboten. Während der kombinierten Anwendung ist unter Umständen eine Dosisanpassung in Erwägung zu ziehen.
Arzneimittel, deren Metabolismus möglicherweise durch Pitolisant beeinträchtigt wird
Substrate von CYP3A4 und CYP2B6
In-vitro-Daten legen nahe, dass Pitolisant und seine Hauptmetabolite in therapeutischen Konzentrationen möglicherweise CYP3A4 und CYP2B6 und, basierend auf extrapolierten Daten, CYP2C, UGTs und Pgp induziert. Zum Ausmass dieser Wechselwirkung sind keine klinischen Daten vorhanden. Daher sollte die Kombination von Pitolisant mit CYP3A4-Substraten mit einer geringen therapeutischen Breite (z. B. Immunsuppressiva, Docetaxel, Kinase-Inhibitoren, Cisaprid, Pimozid, Halofantrin) vermieden werden (siehe «Warnhinweise und Vorsichtsmassnahmen»). Bei anderen Substraten von CYP3A4, CYP2B6 (z. B. Efavirenz, Bupropion), CYP2C (z. B. Repaglinid, Phenytoin, Warfarin), Pgp (z. B. Dabigatran, Digoxin) und UGT (z. B. Morphin, Paracetamol, Irinotecan) ist Vorsicht und eine klinische Überwachung der jeweiligen Wirksamkeit geboten.
Bei oralen Kontrazeptiva sollte die Kombination mit Pitolisant vermieden und eine zusätzliche zuverlässige Empfängnisverhütungsmethode angewendet werden.
Substrate von OCT1
Pitolisant weist bei einer Konzentration von 1,33 µM eine Hemmung gegenüber OCT1 (organischen Kationentransportern 1) von mehr als 50 % auf; die extrapolierte IC50 von Pitolisant beträgt 0,795 µM.
Auch wenn die klinische Relevanz dieses Effekts noch nicht erwiesen ist, ist bei der gleichzeitigen Anwendung von Pitolisant und einem Substrat von OCT1 (z. B. Metformin [Biguanide]) Vorsicht geboten (siehe «Pharmakokinetik»).
Die Kombination von Pitolisant mit Modafinil oder Natriumoxybat, welche Standardbehandlungen gegen Narkolepsie sind, wurde bei gesunden Probanden in therapeutischen Dosen untersucht. Weder mit Modafinil noch mit Natriumoxybat wurden klinisch relevante pharmakokinetische Arzneimittelwechselwirkungen beobachtet.
Kinder und Jugendliche
Studien zur Erfassung von Wechselwirkungen wurden nur bei Erwachsenen durchgeführt.
Schwangerschaft, StillzeitFrauen im gebärfähigen Alter
Frauen im gebärfähigen Alter müssen während und mindestens bis zu 21 Tagen nach der Behandlung eine zuverlässige Verhütungsmethode anwenden (basierend auf der Halbwertzeit von Pitolisant und dessen Metaboliten). Pitolisant und seine Metabolite können die Wirksamkeit von hormonellen Kontrazeptiva reduzieren. Daher muss eine alternative Verhütungsmethode angewendet werden, wenn die Patientin hormonelle Kontrazeptiva anwendet (siehe «Interaktionen»).
Schwangerschaft
Bisher liegen keine oder nur sehr begrenzte Erfahrungen mit der Anwendung von Pitolisant bei Schwangeren vor. Tierexperimentelle Studien haben eine Reproduktionstoxizität, einschliesslich einer Teratogenität, gezeigt. Bei Ratten wurde gezeigt, dass Pitolisant bzw. seine Metabolite plazentagängig sind (siehe «Präklinische Daten»).
Pitolisant sollte während der Schwangerschaft nicht angewendet werden, es sei denn, dies ist unbedingt notwendig.
Stillzeit
In tierexperimentellen Studien wurde gezeigt, dass Pitolisant / seine Metabolite in die Muttermilch ausgeschieden werden. Daher darf während der Behandlung mit Pitolisant nicht gestillt werden (siehe «Kontraindikationen»).
Fertilität
In tierexperimentellen Studien wurden Auswirkungen auf die Samenparameter gezeigt, ohne signifikante Auswirkung auf die Reproduktionsleistung der männlichen Tiere. Bei behandelten weiblichen Tieren zeigten die Studien eine Reduzierung des prozentualen Anteils lebender Föten (siehe «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenPitolisant hat einen geringen Einfluss auf die Fahrtüchtigkeit oder die Fähigkeit, Maschinen zu bedienen.
Patienten mit einem abnormen Schläfrigkeitsgrad, die Pitolisant einnehmen, sollten darauf hingewiesen werden, dass sich ihr Wachheitsgrad möglicherweise nicht wieder normalisiert. Bei Patienten mit exzessiver Tagesschläfrigkeit, einschliesslich Patienten, die Pitolisant einnehmen, sollte der Schläfrigkeitsgrad häufig neu bewertet werden und gegebenenfalls sollte diesen Patienten geraten werden, das Führen von Fahrzeugen und andere potenziell gefährliche Aktivitäten zu vermeiden.
Unerwünschte WirkungenZusammenfassung des Sicherheitsprofils
Die häufigsten im Zusammenhang mit Pitolisant bei Erwachsenen gemeldeten unerwünschten Arzneimittelwirkungen (UAW) sind Schlaflosigkeit (8,4 %), Kopfschmerzen (7,7 %), Übelkeit (4,8 %), Angst (2,1 %), Reizbarkeit (1,8 %), Schwindelgefühl (1,4 %), Depressionen (1,3 %), Tremor (1,2 %), Schlafstörungen (1,1 %), Ermüdung (1,1 %), Erbrechen (1,0 %), Vertigo (1,0 %), Dyspepsie (1,0 %), Gewichtszunahme (0,9 %) und Schmerzen im Oberbauch (0,9 %). Die schwerwiegendsten UAW sind abnormaler Gewichtsverlust (0,09 %) und Spontanabort (0,09 %).
Die folgenden Nebenwirkungen wurden im Zusammenhang mit Pitolisant in klinischen Studien zu Narkolepsie und anderen Indikationen gemeldet, und sind nachstehend als bevorzugte MedDRA-Bezeichnung nach Systemorganklasse und Häufigkeit aufgelistet; die Häufigkeiten des Auftretens sind wie folgt definiert: sehr häufig (≥1/10), häufig (≥1/100, <1/10), gelegentlich (≥1/1’000, <1/100), selten (≥1/10’000, <1/1’000), sehr selten (<1/10’000); innerhalb der einzelnen Häufigkeitsgruppen werden die Nebenwirkungen nach abnehmendem Schweregrad angegeben:
Stoffwechsel- und Ernährungsstörungen
Gelegentlich: verminderter Appetit, gesteigerter Appetit, Flüssigkeitsretention, Gewichtszunahme, Gewichtsabnahme.
Selten: Anorexie, Hyperphagie, Appetitstörung.
Psychiatrische Erkrankungen
Häufig: Schlaflosigkeit, Angst, Reizbarkeit, Depression, Schlafstörung.
Gelegentlich: Agitiertheit, optische / akustische Halluzination, Affektlabilität, Abnorme Träume, Dyssomnie, Durchschlafstörung, Einschlafstörung, Vorzeitiges Erwachen, Nervosität, Anspannung, Apathie, Albträume, Ruhelosigkeit, Panikattacke, Suizidgedanken, verminderte Libido, gesteigerte Libido.
Selten: anormales Verhalten, Verwirrtheitszustand, depressive Verstimmung, Erregbarkeit, Zwangsgedanken, Dysphorie, hypnopompe Halluzination, Depressivsymptom, hypnagoge Halluzination, geistige Beeinträchtigung.
Erkrankungen des Nervensystems
Häufig: Kopfschmerzen, Schwindelgefühl, Tremor.
Gelegentlich: Dyskinesie, Gleichgewichtsstörung, Kataplexie, Aufmerksamkeitsstörungen, Dystonie, On-Off-Phänomen, Hypersomnie, Migräne, psychomotorische Hyperaktivität, Syndrom der ruhelosen Beine, Somnolenz, Epilepsie, Bradykinesie, Parästhesie.
Selten: Verlust des Bewusstseins, Spannungskopfschmerz, eingeschränktes Erinnerungsvermögen, schlechte Schlafqualität.
Augenerkrankungen
Gelegentlich: verminderte Sehschärfe, Blepharospasmus.
Erkrankungen des Ohrs und des Labyrinths
Häufig: Vertigo.
Gelegentlich: Tinnitus.
Herzerkrankungen
Gelegentlich: Extrasystolen, Bradykardie, EKG: verlängertes QT Intervall, erhöhte Herzfrequenz.
Selten: EKG: Unregelmässigkeiten bei der Repolarisation, EKG: Umkehrung der T-Welle.
Gefässerkrankungen
Gelegentlich: Hypertonie, Hypotonie, Hitzewallung.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Gelegentlich: Gähnen.
Erkrankungen des Gastrointestinaltrakts
Häufig: Übelkeit, Erbrechen, Dyspepsie
Gelegentlich: Mundtrockenheit, Abdominalschmerz, Diarrhö, Abdominale Beschwerden, Oberbauchschmerzen, Obstipation, Gastroösophageale Refluxerkrankung, Gastritis, Gastrointestinale Schmerzen, Hyperazidität, orale Parästhesie, Magenbeschwerden.
Selten: aufgeblähter Bauch, Dysphagie, Flatulenz, Schmerzhaftes Schlucken, Enterokolitis.
Leber- und Gallenerkrankungen
Gelegentlich: Leberenzyme erhöht, erhöhte Gamma-Glutamyltransferase Werte.
Erkrankungen der Haut und des Unterhautzellgewebes
Gelegentlich: Erythem, Pruritus, Ausschlag, Hyperhidrose, Schwitzen.
Selten: toxischer Hautausschlag, Photosensitivität.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Gelegentlich: Arthralgie, Rückenschmerzen, Muskelrigidität, Muskelschwäche, Schmerzen des Muskel- und Skelettsystems, Myalgie, Schmerz in einer Extremität.
Selten: Nackenschmerzen, Muskel- und Skelettsystem bedingter Brustschmerz, Kreatinphosphokinase erhöht.
Erkrankungen der Nieren und Harnwege
Gelegentlich: Pollakisurie.
Schwangerschaft, Wochenbett und perinatale Erkrankungen
Selten: Spontanabort.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Gelegentlich: Metrorrhagie.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Ermüdung.
Gelegentlich: Asthenie, Brustschmerz, sich anormal fühlen, Unwohlsein, Ödem, Peripheres Ödem.
Selten: Schmerzen, Nächtliche Schweissausbrüche, Beklemmungsgefühl, anormaler Allgemeinzustand
Beschreibung ausgewählter Nebenwirkungen
Kopfschmerzen und Schlaflosigkeit
In klinischen Studien wurden Episoden von Kopfschmerzen und Schlaflosigkeit berichtet (7,7 % bis 8,4 %). Die meisten dieser Nebenwirkungen waren leicht bis mässig. Wenn die Symptome anhalten, sollte die Gabe einer reduzierten täglichen Dosis oder das Absetzen des Arzneimittels in Erwägung gezogen werden.
Magenerkrankungen
Durch eine Übersäuerung verursachte Magenerkrankungen wurden in klinischen Studien bei 3,5 % der mit Pitolisant behandelten Patienten berichtet. Diese Nebenwirkungen waren meist leichter bis mässiger Natur. Wenn sie andauern, kann eine korrigierende Behandlung mit Protonenpumpenhemmern eingeleitet werden.
Pädiatrische Population (Alter 6 bis 17 Jahre)
Kinder und Jugendliche wurden in einer doppelblinden, multizentrischen, randomisierten, placebokontrollierten Studie untersucht; insgesamt wurden 73 Kinder und Jugendliche mit Narkolepsie mit oder ohne Kataplexie 8 Wochen lang mit Pitolisant behandelt.
Häufigkeit, Art und Schwere der Nebenwirkungen bei Kindern und Jugendlichen waren den bei Erwachsenen beobachteten ähnlich. Die in dieser Population am häufigsten berichteten UAW waren Kopfschmerzen (11 %), Schlaflosigkeit (5,5 %) und Hypertonie (2,7 %). Daten zu möglichen Risiken bei längerer Einnahme liegen bislang nicht vor.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungSymptome
Zu den Symptomen einer Überdosierung von Wakix gehören unter anderem Kopfschmerzen, Schlaflosigkeit, Reizbarkeit, Übelkeit und Abdominalschmerzen.
Behandlung
Im Falle einer Überdosierung wird die Einweisung ins Krankenhaus und die Überwachung der Vitalfunktionen empfohlen. Es existiert kein eindeutig identifiziertes Antidot.
Eigenschaften/WirkungenATC-Code
N07XX11
Wirkungsmechanismus
Pitolisant ist ein starker, oral wirksamer Histamin-H3-Rezeptor-Antagonist/inverser Agonist des Histamin-H3-Rezeptors, der mittels Blockierung der Histamin-Autorezeptoren die Aktivität von histaminergen Neuronen im Gehirn, einem wichtigen Erregungssystem mit weitläufigen Projektionen in das gesamte Gehirn, verstärkt. Darüber hinaus moduliert Pitolisant verschiedene Neurotransmittersysteme und erhöht dadurch die Ausschüttung von Acetylcholin, Noradrenalin und Dopamin im Gehirn. Eine erhöhte Ausschüttung von Dopamin im Striatum, einschliesslich des Nucleus accumbens, wurde im Zusammenhang mit Pitolisant hingegen nicht nachgewiesen.
Pharmakodynamik
Bei Patienten mit Narkolepsie mit oder ohne Kataplexie verbessert Pitolisant den Grad und die Dauer der Wachheit und die Aufmerksamkeit tagsüber, bewertet anhand objektiver Messgrössen hinsichtlich der Fähigkeit, Wachheit (z. B. Multipler Wachbleibetest, MWT) und Aufmerksamkeit (Sustained Attention to Response Task, SART) aufrecht zu erhalten.
Klinische Wirksamkeit
Erwachsene
Bei Narkolepsie (mit oder ohne Kataplexie) handelt es sich um eine chronische Erkrankung. Die Wirksamkeit von Pitolisant bei einer Dosierung von bis zu 36 mg einmal täglich zur Behandlung von Narkolepsie mit oder ohne Kataplexie wurde in zwei 8-wöchigen Hauptstudien, nämlich in den multizentrischen, randomisierten, doppelblinden, placebokontrollierten Parallelgruppenstudien Harmony I und Harmony CTP, nachgewiesen. In Harmony Ibis, einer Studie mit einem ähnlichen Design, war die Dosis auf 18 mg einmal täglich begrenzt. Die Langzeitsicherheitsdaten von Pitolisant bei dieser Indikation sind in der offenen Langzeitstudie HARMONY III verfügbar.
Die Zulassungsstudie (Harmony I) mit flexibler Dosisanpassung, in der das Prüfpräparat mit Placebo und Modafinil (400 mg/Tag) verglichen wurde, umfasste 94 Patienten (31 Patienten wurden mit Pitolisant behandelt, 30 mit Placebo und 33 mit Modafinil). Die Anfangsdosis betrug 9 mg einmal täglich und wurde entsprechend der Wirksamkeit, dem Ansprechen und der Verträglichkeit in Abständen von einer Woche auf 18 mg bzw. 36 mg einmal täglich erhöht. Die meisten Patienten (60 %) erreichten eine Dosierung von 36 mg einmal täglich. Um die Wirksamkeit von Pitolisant auf die exzessive Tagesschläfrigkeit zu beurteilen, wurde der Score (Punktwert) auf dem Epworth-Test zur Tagesschläfrigkeit (Epworth Sleepiness Scale; ESS) als primäres Wirksamkeitskriterium herangezogen. Die Ergebnisse bei Anwendung von Pitolisant waren jenen in der Placebogruppe signifikant überlegen (mittlerer Unterschied: -3,33; 95%-KI [-5,83 bis - 0,83]; p <0,05), unterschied sich jedoch nicht signifikant von den Ergebnissen in der Modafinil- Gruppe (mittlerer Unterschied: 0,12; 95%-KI [-2,5 bis 2,7]). Für die beiden wirkstoffhaltigen Substanzen wurde ein ähnlicher wachheitsfördernder Effekt ermittelt (Abbildung 1).
Abbildung 1: Veränderungen des Punktwertes im Epworth-Test zur Tagesschläfrigkeit (Epworth Sleepiness Scale; ESS) (Mittelwert ± Standardfehler des Mittelwerts [SEM]) von der Baseline bis Woche 8 in der Studie Harmony I
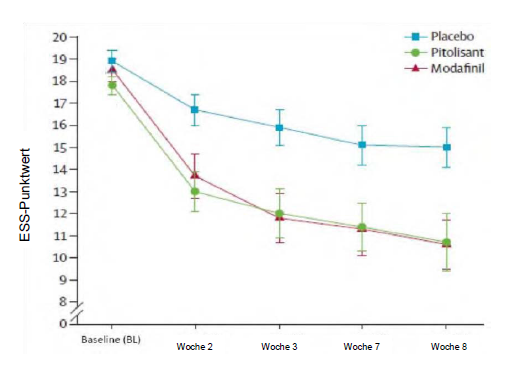
Die Auswirkungen auf die Ergebnisse im Epworth-Test wurden durch zwei Laboruntersuchungen zur Wachsamkeit und Aufmerksamkeit (Multipler Wachbleibetest, MWT) (p=0,044) und Sustained Attention to Response Task (SART) (p=0,053) gestützt.
Die Häufigkeit der Kataplexie-Attacken bei Patienten mit diesem Symptom wurde im Vergleich zu Placebo (-10 %) bei Anwendung von Pitolisant (-65 %) signifikant (p=0,034) reduziert. Die tägliche Inzidenz von Kataplexien (geometrische Mittel) betrug bei Pitolisant zur Baseline 0,52 und zur abschliessenden Studienvisite 0,18 bzw. bei Placebo zur Baseline 0,43 und zur abschliessenden Studienvisite 0,39; die relative Rate (rR) betrug 0,38 [0,16; 0,93] (p=0,034).
An der zweiten Zulassungsstudie (Harmony Ibis) nahmen 165 Patienten teil; 67 Patienten wurden mit Pitolisant, 33 mit Placebo und 65 mit Modafinil behandelt. Das Studiendesign ähnelte jenem der Studie Harmony I; der einzige Unterschied war, dass die Höchstdosis für Pitolisant, die von 75 % der Patienten erreicht wurde, 18 mg einmal täglich statt 36 mg einmal täglich (wie in der Studie Harmony I) betrug. Da ein erhebliches Ungleichgewicht zum Vergleich von Ergebnissen mit oder ohne Clustergruppierung von Prüfzentren führte, zeigte der konservativste Ansatz für Pitolisant im Vergleich zu Placebo eine nicht signifikante Reduzierung des ESS-Score (Pitolisant-Placebo = -1,94; p=0,065). Die Ergebnisse zur Inzidenz von Kataplexien bei einer Dosis von 18 mg einmal täglich standen nicht im Einklang mit jenen der ersten Zulassungsstudie (36 mg einmal täglich).
Bei den beiden objektiven Tests zur Wachsamkeit und Aufmerksamkeit, MWT und SART, wurde unter Pitolisant im Vergleich zu Placebo eine signifikante Verbesserung (p=0,009 bzw. p=0,002) und im Vergleich zu Modafinil eine nicht signifikante Verbesserung (p=0,713 bzw. p=0,294) festgestellt.
Das Design von Harmony CTP, der dritten doppelblinden, randomisierten Parallelgruppen-Zulassungsstudie zum Vergleich von Pitolisant mit Placebo, war darauf ausgelegt, die Wirksamkeit von Pitolisant bei Narkolepsie-Patienten mit häufig auftretender Kataplexie nachzuweisen. Der primäre Wirksamkeitsendpunkt war die Veränderung der durchschnittlichen Anzahl an Kataplexie-Attacken pro Woche zwischen der 2-wöchigen Baseline und dem 4-wöchigen Zeitraum mit stabiler Behandlung zum Ende der Studie. In die Studie wurden 105 Narkolepsie- Patienten mit häufigen wöchentlichen Kataplexie-Attacken zum Baselinezeitpunkt aufgenommen (54 Patienten wurden mit Pitolisant behandelt und 51 mit Placebo). Die Anfangsdosis betrug 4,5 mg einmal täglich und wurde entsprechend der Wirksamkeit, dem Ansprechen und der Verträglichkeit in Abständen von einer Woche auf 9 mg, 18 mg bzw. 36 mg einmal täglich erhöht. Die meisten Patienten (65 %) erreichten eine Dosierung von 36 mg einmal täglich.
Hinsichtlich des primären Wirksamkeitsendpunkts, der wöchentlichen Inzidenz von Kataplexie- Episoden (Weekly Rate of Cataplexy; WRC), waren die Ergebnisse von Pitolisant jenen aus der Placebogruppe signifikant überlegen (p <0,0001), mit einer progressiven Reduzierung von der Baseline bis zum Behandlungsende von 64 % (Abbildung 2). Zum Baselinezeitpunkt betrug das geometrische Mittel der WRC in der Placebo- bzw. in der Pitolisant-Gruppe 7,31 (Median = 6,5 [4,5;12) und 9,15 (Median = 8,5 [5,5; 15,5]). Während des Behandlungszeitraums mit stabiler Dosisgabe (bis zum Ende der Behandlung) verringerte sich bei Patienten, bei denen mindestens eine Kataplexie- Episode aufgetreten war, das geometrische Mittel der WRC in der Placebo- und in der Pitolisant- Gruppe auf 6,79 (Median = 6 [3; 15]) bzw. 3,28 [Median = 3 [1,3; 6]). Die beobachtete WRC in der Pitolisant-Gruppe betrug etwa die Hälfte der WRC in der Placebo-Gruppe; die Effektgrösse von Pitolisant im Vergleich zu Placebo wurde durch die relative Rate (rR (Pt/Pb), rR=0,512; 95%-KI [0,435 bis 0,603]; p <0,0001) zusammengefasst.
Abbildung 2: Veränderung der wöchentlichen Kataplexie-Episoden (geometrisches Mittel) von Baseline bis Woche 7 in der Studie Harmony CTP
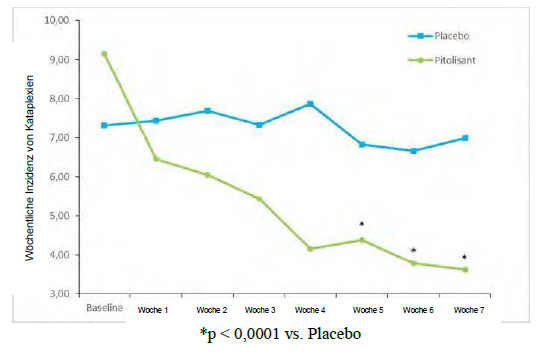
Die Wirkung von Pitolisant auf die exzessive Tagesschläfrigkeit wurde in diesem Kollektiv ausserdem anhand des ESS-Punktwerts beurteilt. In der Pitolisant-Gruppe verringerte sich der ESS-Punktwert im Vergleich zu Placebo signifikant zwischen Baseline und dem Behandlungsende, mit einer beobachteten mittleren Veränderung von -1,9 ± 4,3 und -5,4 ± 4,3 (Mittelwert ± Standardabweichung) bei Placebo bzw. Pitolisant (p <0,0001). Die Wirkung auf die exzessive Tagesschläfrigkeit wurde durch die Ergebnisse im Multiplen Wachbleibetest (MWT) bestätigt. Das geometrische Mittel der Verhältnisse (MWTStudienende/MWTBaseline) betrug 1,8 (95%-KI 1,19; 2,71, p=0,005). Der MWT-Wert in der Pitolisant-Gruppe war um 80 % höher als in der Placebo-Gruppe.
In der offenen Phase-III-Langzeitstudie (HARMONY III) wurde die Langzeitsicherheit von Pitolisant bei Patienten mit Narkolepsie (mit oder ohne Kataplexie) über 12 Monate und mit einer Verlängerung von bis zu 5 Jahren untersucht. 102 narkoleptische Patienten mit oder ohne Kataplexie wurden in die 12-monatige Nachbeobachtungszeit eingeschlossen. 68 Patienten führten die ersten 12 Monate zu Ende. 45, 38, 34 und 14 Patienten führten die Nachbeobachtungszeiträume von 2, 3, 4 bzw. 5 Jahren zu Ende.
Die Höchstdosis, die während der Studie verabreicht wurde, betrug bei 85 % der Patienten 36 mg/Tag. Nach 12-monatiger Behandlung sind die Verbesserungen bei der exzessiven Tagesschläfrigkeit, die anhand des ESS-Punktwerts der verbleibenden Patienten ermittelt wurden, gleich hoch wie in den anderen Studien, die bei narkoleptischen Patienten durchgeführt wurden. Die Abnahme des mittleren ESS-Punktwerts (Standardabweichung) belief sich nach 1 Jahr auf -3,62 (4,63).
Nach 12-monatiger Behandlung mit Pitolisant hat sich die Häufigkeit von Symptomen wie Schlafattacken, Schlaflähmung, Kataplexie und Halluzinationen verbessert.
Es wurden keine grösseren Sicherheitsbedenken festgestellt. Die beobachteten Sicherheitsergebnisse waren ähnlich wie in früheren Studien, in denen Pitolisant mit 36 mg einmal täglich nur bis zu 3 Monate lang verabreicht wurde.
Pädiatrische Population
Die Wirksamkeit von Pitolisant bis zu einer Dosis von 36 mg einmal täglich wurde für die Behandlung von Narkolepsie mit oder ohne Kataplexie bei Kindern im Alter von 6 bis unter 18 Jahren im Rahmen einer 8-wöchigen, multizentrischen, randomisierten, doppelblinden, placebokontrollierten Parallelgruppenstudie untersucht. Die Studie umfasste 110 Patienten (72 Patienten in der Pitolisant-Gruppe, 38 Patienten in der Placebo-Gruppe). Die Anfangsdosis betrug 4,5 mg einmal täglich und wurde entsprechend der Wirksamkeit, dem Ansprechen und der Verträglichkeit in Abständen von 1 Woche auf 18 mg bzw. 36 mg einmal täglich erhöht. Bei Patienten mit einem Körpergewicht von weniger als 40 kg wurde eine Höchstdosis von 18 mg beibehalten. Die meisten Patienten (60 %) erreichten eine Dosierung von 36 mg einmal täglich. 35 Patienten (31,8 %) waren 6 bis 11 Jahre alt und 75 Patienten (68,2 %) waren 12 bis unter 18 Jahre alt. Um die Wirksamkeit von Pitolisant bei übermässiger Schläfrigkeit während des Tages (Excessive Daytime Sleepiness, EDS) und Kataplexie (Cateplexy, CTP) zu beurteilen, wurde der Gesamt-Punktwert auf der Ullanlinna Narcolepsy Scale (UNS) als primäres Wirksamkeitskriterium herangezogen, das als Veränderung vom Studienbeginn bis zum Ende des doppelblinden Zeitraums bewertet wurde. Der geschätzte Unterschied des Kleinste-Quadrate-Mittelwerts (SE, Standardfehler) [95-%-KI] auf der UNS zwischen den Behandlungsgruppen (Pitolisant minus Placebo) betrug -3,69 (1,37) [-6,38; -0,99], p = 0,0073. Sekundäre Endpunkte waren die Paediatric Daytime Sleepiness Scale (Skala zur Tagesschläfrigkeit bei Kindern und Jugendlichen, PDSS), der UNScataplexy (CTP) subscore und die wöchentliche Kataplexierate (Weekly Rate of Cataplexy, WRC). Der geschätzte Unterschied des Kleinste-Quadrate-Mittelwerts (SE, Standardfehler) [95-%-KI] beim PDSS-Gesamt-Punktwert zwischen den Behandlungsgruppen (Pitolisant minus Placebo) betrug -3,41 (1,07) [-5,52; -1,31], p = 0,0015. In der Untergruppe der Patienten mit Narkolepsie Typ 1, für die bei Aufnahme in die Studie kein Mindestmass an Kataplexie erforderlich war (n = 61 in der Pitolisant-Gruppe; n = 29 in der Placebo-Gruppe), betrug der geschätzte Unterschied des Kleinste-Quadrate-Mittelwerts (SE, Standardfehler) [95% KI] des UNS-CTP-Subscores zwischen den Behandlungsgruppen (Pitolisant minus Placebo) -1,77 (0,78) [-3,29; -0,24], p=0,0229, und das Ratenverhältnis zwischen der WRC in der Pitolisant-Gruppe und der WRC in der Placebo-Gruppe fiel, bereinigt um den Ausgangswert, zugunsten von Pitolisant aus (0,42 [95-%-KI: 0,18; 1,01], p = 0,0540).
Tabelle 1: Übersicht über die Ergebnisse der Wirksamkeit nach 8 Wochen in der pädiatrischen Phase-3-Studie
|
|
Placebo (n = 38)
|
Pitolisant (n = 72)
| |
Ullanlinna Narcolepsy Scale (UNS)
| |
Gesamtergebnis
| |
Mittelwert bei Studienbeginn (SD)
Mittelwert am Ende der Behandlung (SD)
Kleinste-Quadrate-Mittelwert (SE) – Veränderung gegenüber dem Ausgangswert
Schätzung, 95% KI
p-Wert
|
23.68 (9.08)
21.77 (9.25)
-2.60 (1.35)
|
24.63 (7.80)
18.23 (8.14)
-6.29 (1.14)
-3.69 (-6.38; -0.99)
0.0073
| |
Paediatric Daytime Sleepiness Score (PDSS)
| |
Mittelwert bei Studienbeginn (SD)
Mittelwert am Ende der Behandlung (SD)
Kleinste-Quadrate-Mittelwert (SE) – Veränderung gegenüber dem Ausgangswert
Schätzung, 95% KI
p-Wert
|
20.00 (3.49)
17.96 (5.60)
-2.11 (0.89)
|
20.16 (3.64)
14.57 (5.37)
-5.53 (0.66)
-3.41 (-5.52; -1.31)
0.0015
| |
|
Placebo (n = 29)
|
Pitolisant (n = 61)
| |
UNS-Cataplexy Subscore*
| |
Mittelwert bei Studienbeginn (SD)
Mittelwert am Ende der Behandlung (SD)
Kleinste-Quadrate-Mittelwert (SE) – Veränderung gegenüber dem Ausgangswert
Schätzung, 95% KI
p-Wert
|
9.03 (4.33)
8.07 (4.62)
-1.12 (0.64)
|
8.93 (3.96)
6.02 (4.00)
-2.88 (0.44)
-1.77 (-3.29; -0.24)
0.0229
| |
Weekly Rate of Cataplexy, WRC*
| |
Mittelwert bei Studienbeginn (SD)
Kleinste-Quadrate-Mittelwert (SE)
Schätzung, 95% KI
p-Wert
|
13.44 (26.92)
5.05 (0.37)
|
8.63 (17.73)
2.14 (0.27)
0.42 (0.18; 1.01)
0.0540
|
*nur bei Patienten mit Narkolepsie Typ I bestimmt
SD: Standardabweichung (standard deviation); SE: Standardfehler (standard error); KI: Konfidenzintervall
Abbildung 3: Veränderung des mittleren Gesamt-Punktwerts auf der Ullanlinna Narcolepsy Scale (Mittelwert ± SEM) vom Studienbeginn bis zum Ende der Behandlung (vollständiges Analyseset)
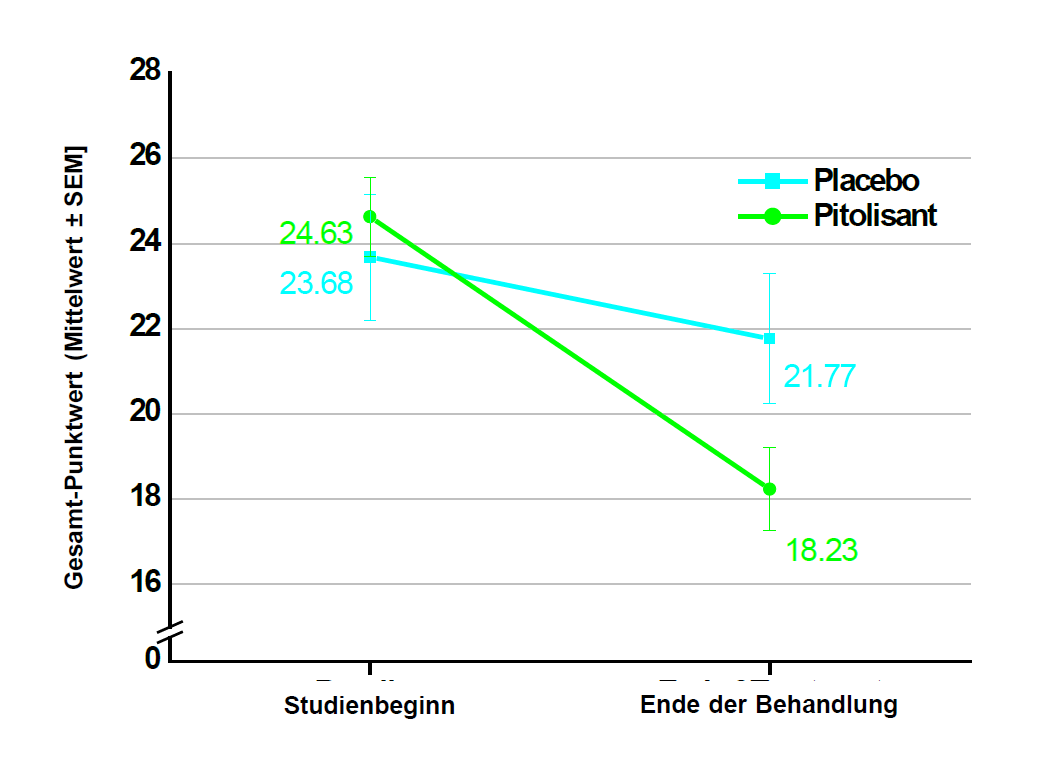
Studienbeginn = [V1-Punktwert (T -14) + V2-Punktwert (T 0)]/2
Ende der Behandlung = [V6-Punktwert (T 49) + V7-Punktwert (T 56)]/2
SEM = Standardfehler des Mittelwerts
PharmakokinetikDie Exposition von gesunden Probanden gegenüber Pitolisant wurde in Studien untersucht, die mehr als 200 Teilnehmer umfassten, die Dosen von Pitolisant als Einzelgabe von bis zu 216 mg und über eine Dauer von bis zu 28 Tagen erhielten.
Absorption
Pitolisant wird gut und schnell resorbiert. Die maximale Plasmakonzentration wird ca. drei Stunden nach der Gabe erreicht.
Distribution
Pitolisant weist eine hohe Bindung an Serumproteine (> 90 %) und eine nahezu identische Verteilung zwischen roten Blutkörperchen und Plasma auf.
Metabolismus
Die Metabolisierung von Pitolisant beim Menschen ist vollständig beschrieben. Die wichtigsten nicht konjugierten Metaboliten sind hydroxylierte Derivate an verschiedenen Positionen und aufgespaltene Formen von Pitolisant, aus denen der inaktive Hauptmetabolit Carbonsäure entsteht, der im Urin und im Serum zu finden ist. Sie werden unter der Wirkung von CYP3A4 und CYP2D6 gebildet. Es wurden mehrere konjugierte Metabolite identifiziert; die wichtigsten davon (inaktiv) sind zwei Glycinkonjugate des Säuremetaboliten von Pitolisant und ein Glukuronid eines Keton-Metaboliten von entsättigtem Monohydroxy-Pitolisant.
Auf Lebermikrosomen bewirkt Pitolisant und seine wichtigsten Metaboliten bis zu einer Konzentration von 13,3 µM, einer Konzentration, die deutlich höher ist als die Spiegel, die bei einer therapeutischen Dosis erreicht werden, keine signifikante Hemmung der Wirkung von CYP1A2, CYP2C9, CYP2C19, CYP2C8, CYP2B6, CYP2E1 oder CYP3A4 und der Isoformen der Uridindiphosphat-Glucuronosyl- Transferasen UGT1A1, UGT1A4, UGT1A6, UGT1A9 und UGT2B7. Pitolisant ist ein mittelstarker Inhibitor (IC50 = 2,6 µM) von CYP2D6.
Pitolisant induziert CYP3A4, CYP1A2 und CYP2B6 in vitro. Es sind klinisch relevante Wechselwirkungen mit Substraten von CYP3A4 und CYP2B6 sowie, basierend auf extrapolierten Daten, Substraten von UGTs, CYP2C und Pgp zu erwarten (siehe «Interaktionen»).
In-vitro-Studien lassen vermuten, dass Pitolisant weder ein Substrat noch ein Inhibitor von humanem P-Glykoprotein und Brustkrebsresistenzprotein (BCRP) ist. Pitolisant ist kein Substrat von OATP1B1 und OATP1B3. Pitolisant ist in der geprüften Konzentration kein signifikanter Inhibitor von OAT1, OAT3, OCT2, OATP1B1, OATP1B3, MATE1 oder MATE2K. Pitolisant weist bei einer Konzentration von 1,33 µM eine Hemmung gegenüber OCT1 (organischen Kationentransportern 1) von mehr als 50 % auf; die extrapolierte IC50 von Pitolisant beträgt 0,795 µM (siehe «Interaktionen»).
Elimination
Pitolisant hat eine Plasmahalbwertszeit von 10-12 Stunden. Bei wiederholter Gabe wird das Fliessgleichgewicht 5-6 Tage nach der Verabreichung erreicht, was zu einem um ca. 100 % erhöhten Serumspiegel führt. Die interindividuelle Variabilität ist verhältnismässig hoch; einige Probanden zeigten ein Profil mit hohen Ausreisserwerten (ohne Verträglichkeitsprobleme).
Die Elimination erfolgt hauptsächlich über den Urin (zu ca. 63 %) mittels eines inaktiven, nicht konjugierten Metaboliten (BP2.951) und eines mit Glycin konjugierten Metaboliten. 25 % der Dosis wird über die Ausatemluft ausgeschieden und ein kleiner Bruchteil (<3 %) wird in den Fäzes wiedergefunden, wo die Menge an Pitolisant bzw. BP2.951 vernachlässigbar war.
Linearität/Nicht-Linearität
Bei einer Verdopplung der Pitolisant-Dosis von 27 mg auf 54 mg ist die AUC0-∞ um das ca. 2,3-Fache erhöht.
Kinetik spezieller Patientengruppen
Ältere Patienten
Die Pharmakokinetik von Pitolisant unterscheidet sich bei Patienten im Alter von 68 bis 80 Jahren nicht von jener bei jüngeren Patienten (im Alter von 18 bis 45 Jahren). Über einem Alter von 80 Jahren zeigt die Kinetik eine leichte Abweichung, die jedoch keine klinische Relevanz hat. Zur Anwendung bei älteren Patienten liegen nur begrenzte Daten vor. Daher sollte die Dosis gemäss der Nieren- und Leberfunktion des Patienten angepasst werden (siehe «Dosierung/Anwendung» und «Warnhinweise und Vorsichtsmassnahmen»).
Nierenfunktionsstörung
Bei Patienten mit beeinträchtigter Nierenfunktion (Stadien 2 bis 4 gemäss der internationalen Klassifizierung der chronischen Nierenerkrankung, d. h. Kreatinin-Clearance zwischen 15 ml/min und 89 ml/min) waren Cmax und AUC tendenziell um den Faktor 2,5 erhöht, ohne Auswirkungen auf die Halbwertszeit (siehe «Dosierung/Anwendung»).
Leberfunktionsstörung
Bei Patienten mit leichter Leberfunktionsstörung (Child-Pugh-Klasse A) waren im Vergleich zu gesunden Probanden keine signifikanten Veränderungen der Pharmakokinetik festzustellen. Bei Patienten mit mittelschwerer Leberfunktionsstörung (Child-Pugh-Klasse B) erhöhte sich die AUC um den Faktor 2,4, und die Halbwertszeit verdoppelte sich (siehe «Dosierung/Anwendung»). Die Pharmakokinetik von Pitolisant nach wiederholter Gabe bei Patienten mit Leberfunktionsstörung wurde noch nicht untersucht.
Schlechte CYP2D6-Metabolisierer
Die Exposition gegenüber Pitolisant war bei den schlechten CYP2D6-Metabolisierern nach einer Einzeldosis und im Fliessgleichgewicht höher: Cmax und AUC(0-tau) waren an Tag 1 ca. 2,7- bzw. 3,2-fach und an Tag 7 ca. 2,1- bzw. 2,4-fach erhöht. Die Serumhalbwertszeit von Pitolisant war bei schlechten CYP2D6-Metabolisierern im Vergleich zu den extensiven Metabolisierern länger.
Ethnische Zugehörigkeit
Die Auswirkungen der ethnischen Zugehörigkeit auf die Verstoffwechselung von Pitolisant wurden nicht untersucht.
Pädiatrische Population
Die Pharmakokinetik von Pitolisant in einer Dosierung von 18 mg bei Kindern im Alter von 6 bis unter 18 Jahren mit Narkolepsie wurde in einer multizentrischen Studie mit Gabe einer Einzeldosis untersucht. In einer populationspharmakokinetischen (PK)-Analyse mit einem körpergewichtsabhängigen Modell ist die systemische Exposition gegenüber Pitolisant bei einer Dosis von 18 mg, geschätzt durch Cmax und AUC0-10h, bei Kindern mit einem Körpergewicht von weniger als 40 kg etwa 3-mal höher und bei Jugendlichen mit einem Körpergewicht über 40 kg im Vergleich zu erwachsenen Patienten 2-mal höher. Daher sollte die Dosistitration mit der niedrigsten Dosis von 4,5 mg beginnen und bei Kindern mit einem Körpergewicht von weniger als 40 kg auf 18 mg begrenzt werden (siehe «Dosierung/Anwendung»).
Präklinische DatenToxizität bei wiederholter Verabreichung
Nach 1 Monat bei Mäusen, 6 Monaten bei Ratten und 9 Monaten bei Affen betrug der NOAEL (no observed adverse effect level) 75 mg/kg/Tag, 30 mg/kg/Tag bzw. 12 mg/kg/Tag per os, womit sich im Vergleich zu der Arzneimittelexposition bei therapeutischen Dosen beim Menschen eine Sicherheitsspanne von 9, 1 bzw. 0,4 ergibt. Bei Ratten traten vorübergehende, reversible Episoden von Konvulsion bei Tmax auf, die möglicherweise auf einen Metaboliten zurückzuführen sind, der bei dieser Art in hohen Konzentrationen vorkommt, nicht jedoch beim Menschen. Beim Affen wurden bei den höchsten Dosierungen vorübergehende, mit dem ZNS in Zusammenhang stehende klinische Anzeichen gemeldet, einschliesslich Erbrechen, Tremor und Konvulsionen. Bei den höchsten Dosierungen wurden bei Affen keine histopathologischen Veränderungen beobachtet, und Ratten wiesen in einigen Organen (Leber, Duodenum, Thymus, Nebenniere und Lunge) im begrenzten Ausmass gewisse histopathologische Veränderungen auf.
Mutagenität und Karzinogenität
Pitolisant war weder genotoxisch noch kanzerogen.
Reproduktionstoxizität
Bei einer Exposition des Muttertiers gegenüber toxischen Dosen wurde eine teratogene Wirkung beobachtet (Sicherheitsspannen für die Teratogenität < 1 bei Ratten und Kaninchen). Bei hohen Dosierungen führte Pitolisant zu morphologischen Anomalien der Spermien und verringerte deren Motilität, jedoch ohne signifikante Auswirkungen auf die Fertilitätsindizes männlicher Ratten; ausserdem führte es zu einer Reduzierung des prozentualen Anteils an Empfängnissen lebender Embryonen und zu einer Erhöhung der Anzahl der Abgänge nach der Einnistung bei weiblichen Ratten (Sicherheitsspanne von 1). Pitolisant führte zu einer Verzögerung der postnatalen Entwicklung (Sicherheitsspanne von 1).
Es wurde gezeigt, dass Pitolisant / seine Metabolite bei Tieren plazentagängig sind.
Weitere Daten
Toxizitätsstudien an Jungtieren bei Ratten haben gezeigt, dass die Verabreichung von Pitolisant in hohen Dosierungen zu einer dosisabhängigen Mortalität und zu Episoden von Konvulsionen führte, die möglicherweise auf einen Metaboliten zurückzuführen sind, der bei Ratten in hohen Konzentrationen vorkommt, nicht jedoch beim Menschen.
Pitolisant blockierte den hERG-Kanal mit einer IC50 über den therapeutischen Konzentrationen und führte zu einer leichten Verlängerung der QTc-Zeit bei Hunden.
In präklinischen Studien wurden die Arzneimittelabhängigkeit und das Suchtpotenzial an Mäusen, Affen und Ratten untersucht. Hier war jedoch basierend auf den Studien zur Verträglichkeit, Abhängigkeit und Eigenverabreichung keine endgültige Schlussfolgerung möglich.
Sonstige HinweiseInkompatibilitäten
Nicht zutreffend.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Für Kinder unzugänglich aufbewahren.
Nicht über 30°C lagern.
Zulassungsnummer67007 (Swissmedic)
PackungenFlasche aus Polyethylen hoher Dichte (HDPE) mit einem manipulations- und kindergesicherten Schraubdeckel aus Polypropylen und mit einem Trockenmittel (Silicagel).
4,5 mg Filmtabletten: Flasche mit 30 Filmtabletten [B]
18 mg Filmtabletten: Flasche mit 30 Filmtabletten [B]
ZulassungsinhaberinFuture Health Pharma GmbH, 8620 Wetzikon
Stand der InformationMai 2024
|



