ZusammensetzungWirkstoffe
Apomorphinhydrochlorid-Hemihydrat.
Hilfsstoffe
Natriummetabisulfit (E 223) 0.5 mg / ml, Salzsäure (zur pH-Einstellung). Wasser für Injektionszwecke.
Enthält 0.121 mg / ml Natrium.
1 Patrone zu 20 ml enthält 2.4 mg (0.1 mmol) Natrium.
Indikationen/AnwendungsmöglichkeitenZur Behandlung von Parkinson-Patienten mit motorischen Fluktuationen (ON-OFF-Phänomen), die trotz individuell eingestellter Behandlung mit Levodopa (und einem peripheren Decarboxylase-Hemmer) und/oder Dopamin-Agonisten weiterbestehen.
Dosierung/AnwendungVoraussetzungen für eine Infusion von APO-go 100 mg / 20 ml
Patienten, die während der Einleitungsphase der Apomorphin-Therapie ein gutes Ansprechen auf die «On»-Phase gezeigt haben, deren Gesamtkontrolle jedoch mit intermittierenden Injektionen unbefriedigend bleibt oder die viele und häufige Injektionen benötigen, können auf eine kontinuierliche subkutane Infusion mittels Minipumpe umgestellt werden. Patienten, die häufige «Off»-Perioden haben, die durch orale/transdermale Medikamente nicht kontrolliert werden können, können auch auf kontinuierliche subkutane Infusion mittels Minipumpe umgestellt werden, ohne dass zuvor intermittierende Injektionen verwendet wurden.
Patienten, die für die Behandlung mit APO-go 100 mg / 20 ml Infusionslösung in einer Patrone ausgewählt werden, sollten in der Lage sein, selbst ein Infusionssystem einzurichten oder eine verantwortliche Pflegeperson haben, die bei Bedarf ein Infusionssystem für sie einrichten kann.
Die mit Apomorphin behandelten Patienten müssen normalerweise mindestens zwei Tage vor Einleitung der Therapie mit der Anwendung von Domperidon beginnen. Die Dosis für Domperidon soll auf die niedrigste Wirkdosis titriert und sobald wie möglich abgesetzt werden.
Bevor eine Entscheidung zur Einleitung einer Therapie mit Domperidon und Apomorphin getroffen wird, müssen bei dem einzelnen Patienten die Risikofaktoren für eine Verlängerung des QT-Intervalls sorgfältig bewertet werden, um sicherzustellen, dass der Nutzen das Risiko übersteigt, siehe «Warnhinweise und Vorsichtsmassnahmen».
Die Behandlung mit Apomorphin sollte in einer spezialisierten Klinik begonnen und von einem in der Behandlung der Parkinson'schen Krankheit erfahrenen Arzt (z.B. einem Neurologen) überwacht werden. Die Behandlung des Patienten mit Levodopa mit oder ohne Dopamin-Agonisten sollte vor Beginn der Behandlung mit APO-go 100 mg / 20 ml optimiert worden sein.
Dosierung Erwachsene
Bestimmung der Schwellendosis
Die Schwellendosis für die Dauerinfusion sollte wie folgt bestimmt werden: Die Dauerinfusion wird mit einer Rate von 1 mg Apomorphin (0.2 ml) pro Stunde begonnen und dann entsprechend dem individuellen Ansprechen jeden Tag erhöht. Erhöhungen der Infusionsrate sollten 0.5 mg – 1.0 mg/Std. pro Tag nicht überschreiten. Sobald eine ausreichende Kontrolle der motorischen Symptome erreicht ist, kann die Infusionsrate stabil bleiben und liegt in der Regel zwischen 4 mg/Stunde und 6 mg/Stunde (0.8 ml und 1.2 ml). Einige Patienten können eine ausreichende Symptomkontrolle mit nur 2 mg/h erreichen, andere benötigen bis zu 8 mg/h. Die Infusionen sollten nur während der Wachzeiten laufen (typischerweise 16 Stunden pro Tag). Sofern der Patient nicht unter schweren nächtlichen Problemen leidet, werden 24-Stunden-Infusionen nicht empfohlen. Eine Toleranz gegenüber der Therapie scheint nicht aufzutreten, solange eine behandlungsfreie Nacht von mindestens 4 Stunden eingehalten wird. In jedem Fall sollte die Infusionsstelle alle 24 Stunden gewechselt werden, die Tagesgesamtdosis sollte 100 mg nicht überschreiten.
Die Patientinnen und Patienten können eine Patrone für bis zu 48 Stunden anwenden, solange sie alle 24 Stunden eine neue Infusionsleitung und eine andere Infusionsstelle verwenden.
Die Patienten müssen ihre kontinuierliche Infusion bei Bedarf und auf Anweisung ihres Arztes bzw. ihrer Ärztin mit intermittierenden Bolusschüben ergänzen.
Etablierung der Behandlung
Änderungen der Dosierung können je nach Ansprechen des Patienten vorgenommen werden.
Die optimale Dosierung von Apomorphin variiert von Person zu Person, bleibt aber, wenn sie einmal festgelegt ist, bei jedem Patienten relativ konstant.
Vorsichtsmassnahmen bei der Fortsetzung der Behandlung
In klinischen Studien ist es in der Regel möglich gewesen, die Dosis von Levodopa etwas zu reduzieren; die mögliche Reduktion variiert von Patient zu Patient erheblich und muss von einem in dieser Therapie erfahrenen Arzt sorgfältig überwacht werden. Sobald die Behandlung mit der individuell optimalen Dosis etabliert ist, kann Domperidon bei einigen Patienten schrittweise reduziert werden. Aber nur bei wenigen Patienten kann völlig darauf verzichtet werden, ohne dass Erbrechen oder Hypotonie auftreten.
Kinder und Jugendliche
APO-go 100 mg / 20 ml ist kontraindiziert für Kinder und Jugendliche unter 18 Jahren (siehe «Kontraindikationen»).
Ältere Patienten
Ältere Menschen sind in der Gruppe der Patienten mit Parkinson'scher Krankheit häufig vertreten und stellen einen hohen Anteil in klinischen Studien mit Apomorphin dar. Die Behandlung älterer Menschen unterscheidet sich nicht von derjenigen jüngerer Patienten. Dennoch ist bei Beginn der Therapie bei älteren Menschen aufgrund des Risikos einer orthostatischen Hypotonie besondere Vorsicht geboten.
Patienten mit Nierenfunktionsstörungen
Bei Patienten mit eingeschränkter Nierenfunktion kann mit Vorsicht ein Dosierungsschema angewendet werden, das dem empfohlenen Dosierungsschema bei Erwachsenen ähnlich ist (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Art der Anwendung
APO-go 100 mg / 20 ml Infusionslösung in einer Patrone ist zur subkutanen Anwendung bestimmt.
APO-go 100 mg / 20 ml ist eine vorverdünnte Lösung, die zur unverdünnten Anwendung als kontinuierliche subkutane Infusion mittels Minipumpe vorgesehen ist. APO-go 100 mg / 20 ml Patronen sind für die Verwendung mit der Crono APO-go III Infusionspumpe oder mit der Crono PAR4 20 Infusionspumpe und der CronoBell Sleeve vorgesehen.
Eine Zusammenfassung der Anweisungen zum Einrichten der Infusion finden Sie im Abschnitt «Sonstige Hinweise/Hinweise für die Handhabung».
Apomorphin darf nicht intravenös verabreicht werden.
Nicht verwenden, wenn die Lösung grün geworden ist. Die Lösung sollte vor der Anwendung einer Sichtprüfung unterzogen werden. Es sollte nur eine klare, farblose und partikelfreie Lösung verwendet werden.
KontraindikationenAPO-go 100 mg / 20 ml darf nicht angewendet werden bei:
·Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung.
·Patienten mit Atemdepression, Demenz, Psychosen oder Leberinsuffizienz. Die Apomorphin-Behandlung ist ungeeignet für Patienten, die auf Levodopa mit einer ON-Reaktion ansprechen, die durch schwere Dyskinesien oder Dystonie gekennzeichnet ist.
·gleichzeitiger Anwendung mit 5-HT3-Rezeptorantagonisten, wie Ondansetron, Granisetron, Dolasetron, Palonosetron und Alosetron.
APO-go 100 mg / 20 ml ist für Kinder und Jugendliche unter 18 Jahren kontraindiziert.
Warnhinweise und VorsichtsmassnahmenApomorphin sollte nur mit Vorsicht bei Patienten mit Nieren-, Lungen- oder Herz-/Kreislauferkrankungen sowie bei Patienten, die zu Übelkeit und Erbrechen neigen, angewendet werden. Besondere Vorsicht ist bei älteren und/oder geschwächten Patienten zu Beginn der Therapie geboten.
Da Apomorphin zu Hypotonie führen kann, sogar bei einer Vorbehandlung mit Domperidon, sollte das Arzneimittel bei Patienten mit bestehenden Herzkrankheiten oder bei Patienten, die vasoaktive Arzneimittel (z.B. Antihypertensiva) einnehmen, mit besonderer Vorsicht angewendet werden, besonders bei Patienten mit bereits vorhandener orthostatischer Hypotonie.
Über hämolytische Anämie wurde bei Patienten, die mit Levodopa und Apomorphin behandelt wurden, berichtet. Hämatologische Untersuchungen sollten bei Patienten während einer Levodopa-Therapie regelmässig durchgeführt werden, wenn sie Apomorphin gleichzeitig verwenden.
Vorsicht ist geboten, wenn APO-go 100 mg / 20 ml mit anderen Arzneimitteln kombiniert wird, besonders wenn diese eine geringe therapeutische Breite haben (siehe «Interaktionen»).
Eine fortgeschrittene Parkinson'sche Erkrankung geht bei vielen Patienten mit neuropsychiatrischen Problemen einher. Es gibt Hinweise, dass sich bei einigen Patienten neuropsychiatrische Störungen durch Apomorphin verstärken können, daher ist besondere Vorsicht geboten, wenn Apomorphin bei solchen Patienten angewendet wird.
Im Zusammenhang mit Apomorphin wurde Schläfrigkeit beobachtet, andere Dopamin-Agonisten können plötzliche Schlafattacken auslösen, insbesondere bei Patienten mit Parkinson'scher Krankheit. Patienten müssen daher darüber informiert werden, dass sie während der Behandlung mit Apomorphin nur unter besonderer Vorsicht am Verkehr teilnehmen oder Maschinen bedienen können. Patienten, die von Schläfrigkeit betroffen sind, müssen das Führen von Fahrzeugen oder das Bedienen von Maschinen ganz unterlassen. Eine Verminderung der Dosierung oder die Beendigung der Therapie kann in diesem Fall in Erwägung gezogen werden.
Die Patienten sollten regelmässig hinsichtlich der Entwicklung von Impulskontrollstörungen überwacht werden. Patienten und Betreuer sollten darauf aufmerksam gemacht werden, dass Verhaltensauffälligkeiten im Sinne von Impulskontrollstörungen einschliesslich Spielsucht/pathologisches Spielen, Libidosteigerung und Hypersexualität, zwanghaftes Geldausgeben oder Einkaufen, Essattacken und Esszwang auftreten können. Wenn sich solche Symptome entwickeln, sollten eine Dosisreduktion oder ein Ausschleichen der Behandlung in Erwägung gezogen werden.
Am Injektionsort kann es zu Verhärtungen und Knotenbildungen kommen, die normalerweise asymptomatisch sind. Diese können bei längerfristiger Anwendung bestehen bleiben und mit Rötung und Empfindlichkeit verbunden sein. Bei Biopsien der Haut solcher Patienten wurde eine Infiltration des subkutanen Fettgewebes festgestellt. Es sollte Sorge getragen werden, dass sich Bereiche mit Wundstellen nicht infizieren. Juckreiz kann an der Injektionsstelle entstehen. Diese lokalen subkutanen Auswirkungen können manchmal reduziert werden, indem abwechselnd verschiedene Injektionsstellen gewählt werden. Unter Umständen ist auch eine Reduktion durch den Einsatz von Ultraschall (falls vorhanden) in Knoten- und Verhärtungsbereichen möglich.
Da Apomorphin, besonders bei höheren Dosen, zu einer Verlängerung des QT-Intervalls führen kann, ist bei Patienten mit einem Risiko für Torsades de pointes und solchen, die gleichzeitig Arzneimittel einnehmen, die zu einer Verlängerung des QT-Intervalls führen können, Vorsicht geboten.
Bei Anwendung in Kombination mit Domperidon müssen die Risikofaktoren beim einzelnen Patienten vor Therapiebeginn sorgfältig beurteilt werden. Dies muss vor Therapiebeginn und während der Therapie geschehen. Wichtige Risikofaktoren sind schwerwiegende zugrunde liegende Herzerkrankungen wie kongestives Herzversagen, schwere Leberfunktionsstörung oder erhebliche Elektrolytstörung. Ausserdem sollte eine Beurteilung solcher Arzneimittel erfolgen, die einen Einfluss auf den Elektrolythaushalt, den CYP3A4-Metabolismus oder das QT-Intervall haben können. Die Überwachung des Patienten in Bezug auf Auswirkungen auf das QTc-Intervall ist anzuraten. Ein EKG sollte zu folgenden Zeitpunkten durchgeführt werden:
·vor der Behandlung mit Domperidon;
·in der Therapieeinleitungsphase;
·danach wie klinisch angezeigt.
Der Patient sollte angewiesen werden, mögliche kardiale Symptome wie Palpitationen, Synkopen oder Präsynkopen zu melden. Ausserdem sollten klinische Veränderungen gemeldet werden, die eine Hypokaliämie zur Folge haben können, wie Gastroenteritis oder die Einleitung einer Diuretikatherapie.
Bei jeder Kontrolluntersuchung sollten die Risikofaktoren erneut geprüft werden.
Bei einigen Patienten wurde unter der Behandlung mit APO-go 100 mg / 20 ml ein Dopamin-Dysregulationssyndrom (DDS) beobachtet. Hierbei handelt es sich um eine Suchterkrankung, die zu einer übermässigen Anwendung dieses oder anderer dopaminerger Arzneimittel führt. Vor Behandlungsbeginn müssen Patienten und Betreuer vor dem potenziellen Risiko der Entwicklung eines DDS gewarnt werden (siehe auch «Unerwünschte Wirkungen»).
APO-go 100 mg / 20 ml, Infusionslösung in einer Patrone enthält Natriummetabisulfit (E 223), welches in seltenen Fällen schwere allergische Reaktionen und Bronchospasmen auslösen kann.
APO-go 100 mg / 20 ml, Infusionslösung in einer Patrone enthält weniger als 1 mmol Natrium (23 mg) pro 1 Patrone à 20 ml Infusionslösung, d.h. es ist nahezu «natriumfrei».
InteraktionenPatienten, die für die Behandlung mit Apomorphin ausgewählt werden, nehmen fast mit Sicherheit weitere begleitende Arzneimittel für ihre Parkinson'sche Krankheit ein. In den anfänglichen Stadien der Therapie mit Apomorphin sollte der Patient auf ungewöhnliche Nebenwirkungen oder Zeichen von Potenzierungseffekten überwacht werden.
Neuroleptika können antagonistisch wirken, wenn sie zusammen mit Apomorphin eingesetzt werden. Es gibt eine potenzielle Wechselwirkung zwischen Clozapin und Apomorphin, allerdings kann Clozapin auch angewendet werden, um neuropsychiatrische Komplikationen zu reduzieren. Falls bei Patienten mit Morbus Parkinson, die auch mit Dopamin-Agonisten behandelt werden, Neuroleptika angewendet werden müssen, kann eine allmähliche Reduzierung der Apomorphin-Dosis in Erwägung gezogen werden, wenn die Verabreichung mittels einer Minipumpe erfolgt (selten ist über Symptome eines malignen neuroleptischen Syndroms bei abruptem Abbruch einer dopaminergen Therapie berichtet worden).
Antihypertensiva und herzwirksame Arzneimittel: Selbst bei gemeinsamer Anwendung mit Domperidon kann Apomorphin die blutdrucksenkende Wirkung solcher Arzneimittel verstärken (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Die gleichzeitige Gabe von Arzneimitteln, die zu einer Verlängerung des QT-Intervalls führen können, sollte vermieden werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Da bei gleichzeitiger Gabe von Apomorphin und Ondansetron über ausgeprägte Hypotonie und Bewusstseinsverlust berichtet wurde, darf eine gleichzeitige Gabe mit 5-HT3-Rezeptorantagonisten, wie Ondansetron, Granisetron, Dolasetron, Palonosetron und Alosetron nicht erfolgen (siehe «Kontraindikationen»).
Antiemetika mit antidopaminerger Wirkung (z.B. Haloperidol, Chlorpromazin, Promethazin, Prochlorperazin, Metoclopramid, Levopromazin und Droperidol) haben das Potenzial, die Symptome bei Patienten mit Morbus Parkinson zu verschlimmern und sollten vermieden werden. Darüber hinaus könnte die Verwendung dieser Antiemetika das Risiko für QT-Verlängerung, Hypotonie und Torsade-de-Pointes-Arrhythmien erhöhen.
Schwangerschaft, StillzeitSchwangerschaft
Aufgrund des Alters der behandelten Patientenpopulation ist das Auftreten einer Schwangerschaft unwahrscheinlich. Es liegen keine Erfahrungen mit der Anwendung von Apomorphin bei Schwangeren vor. Tierexperimentelle Reproduktionsstudien ergaben keine Hinweise auf teratogene Wirkungen. Bei Ratten führten jedoch Dosierungen, die für die Muttertiere toxisch sind, zu Verschlechterung des mütterlichen Pflegeverhaltens und zu Atemstillstand der Neugeborenen. Das potentielle Risiko für den Menschen ist nicht bekannt (siehe «Präklinische Daten»). APO-go 100 mg / 20 ml darf während der Schwangerschaft nicht verabreicht werden, es sei denn, dies ist eindeutig erforderlich.
Stillzeit
Ob Apomorphin in die Muttermilch übergeht, ist nicht bekannt. Dennoch sollte das Stillen während der Apomorphin-Therapie vermieden werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenPatienten, die mit Apomorphin behandelt werden und bei denen Schläfrigkeit und/oder plötzliche Schlafattacken auftreten, müssen darüber informiert werden, dass sie das Führen eines Fahrzeuges oder Tätigkeiten (z.B. das Bedienen von Maschinen), bei denen verminderte Aufmerksamkeit sie selbst oder andere dem Risiko von schweren Verletzungen oder Tod aussetzen könnte, solange zu unterlassen haben, bis solche wiederholt auftretenden Attacken und Schläfrigkeit nicht mehr auftreten (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Unerwünschte WirkungenDie unerwünschten Wirkungen werden nachfolgend nach Organklasse und Häufigkeit geordnet aufgeführt. Die Häufigkeiten werden wie folgt definiert: sehr häufig (≥1/10), häufig (≥1/100, <1/10), gelegentlich (≥1/1000, <1/100), selten (≥1/10'000, <1/1000), sehr selten (<1/10'000).
Erkrankungen des Blutes und des Lymphsystems
Gelegentlich: hämolytische Anämie und Thromobozytopenie.
Selten: Eosinophilie.
Erkrankungen des Immunsystems
Selten: Überempfindlichkeitsreaktionen (inklusive Anaphylaxie und Bronchospasmus) aufgrund des Gehaltes an Natriummetabisulfit.
Psychiatrische Erkrankungen
Sehr häufig: Halluzinationen.
Gelegentlich: Neuropsychiatrische Störungen (inklusive vorübergehende leichte Verwirrtheitszustände und optische Halluzinationen).
Nicht bekannt: Dopamin-Dysregulationssyndrom. Das Dopamin-Dysregulationssyndrom (DDS) ist eine Suchterkrankung, die bei einigen mit APO-go 100 mg / 20 ml behandelten Patienten beobachtet wurde. Betroffene Patienten zeigen einen zwanghaften Missbrauch dopaminerger Arzneimittel bei Verwendung höherer Dosen als zur adäquaten Kontrolle von motorischen Symptomen der Parkinson-Krankheit erforderlich. Dies kann in einigen Fällen zu schweren Dyskinesien führen (siehe auch «Warnhinweise und Vorsichtsmassnahmen»).
Erkrankungen des Nervensystems
Häufig: Schläfrigkeit, vorübergehende Sedierung (vor allem zu Beginn der Therapie), Schwindel/ Benommenheit.
Gelegentlich: Während ON-Perioden Dyskinesien, die in seltenen Fällen zum Therapieabbruch führen. Plötzliche Einschlaf-Episoden.
Häufigkeit nicht bekannt: Es wurde berichtet, dass Patienten, die zur Behandlung des Morbus Parkinson Dopamin-Agonisten, einschliesslich Apomorphin, insbesondere in hohen Dosierungen, angewendet haben, Zeichen von Spielsucht/pathologischem Spielen, Libidosteigerung und Hypersexualität, zwanghaftes Geldausgeben oder Einkaufen, Essattacken und Esszwang zeigten, die allgemein bei Dosisreduktion oder mit Beendigung der Behandlung zurückgingen. Synkope, Kopfschmerzen.
Gefässerkrankungen
Gelegentlich: Orthostatische Hypotonie (normalerweise vorübergehend).
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig: Gähnen.
Gelegentlich: Atemschwierigkeiten.
Erkrankungen des Gastrointestinaltrakts
Häufig: Übelkeit und Erbrechen (vor allem zu Beginn der Behandlung); vorübergehende Sedierung (dosisunabhängig, vor allem zu Beginn der Therapie).
Erkrankungen der Haut und des Unterhautgewebes
Gelegentlich: Lokale und generalisierte Hautausschläge.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Subkutane Verhärtungen und Knotenbildungen am Injektionsort (normalerweise asymptomatisch, bei hohen Dosen mit Rötungen und Empfindlichkeit einhergehend).
Häufigkeit nicht bekannt: Periphere Ödeme.
Untersuchungen
Gelegentlich: Positiver Coombs'-Test.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungEs gibt nur wenig klinische Erfahrungen mit der Überdosierung von Apomorphin bei dieser Art der Anwendung. Symptome einer Überdosierung können empirisch wie folgt vorgeschlagen behandelt werden:
Übermässiges Erbrechen mit Domperidon,
Atemdepression mit Naloxon,
Bradykardie mit Atropin.
Hypotonie: geeignete Massnahmen, z.B. Höherstellung des Bettes am Fussende, sollten ergriffen werden.
Eigenschaften/WirkungenATC-Code
N04BC07
Wirkungsmechanismus
Apomorphin ist ein direkter Agonist an dopaminergen D1- und D2-Rezeptoren, wobei keine Überschneidungen mit Transport oder Metabolisierung von Levodopa bestehen. Die Anwendung von Apomorphin unterdrückt bei gesunden Versuchstieren die Aktivitätsrate von nigrostriatalen Zellen und verursacht in niedrigen Dosen eine Reduzierung der lokomotorischen Aktivität. Dabei wird angenommen, dass dies auf eine präsynaptische Hemmung der endogenen Dopamin-Ausschüttung zurückzuführen ist. Dennoch wird die Wirkung bei der motorischen Beeinträchtigung von Patienten mit Parkinson'scher Krankheit wahrscheinlich durch postsynaptische Rezeptoren vermittelt. Diese biphasische Wirkungsweise ist auch beim Menschen zu beobachten.
Pharmakodynamik
Siehe unter Wirkungsmechanismus.
Klinische Wirksamkeit
Die Wirksamkeit und Sicherheit der subkutanen Dauerinfusion von Apomorphin wurde in einer randomisierten, placebokontrollierten, 12-wöchigen Doppelblindstudie bei Patienten mit Morbus Parkinson mit motorischen Symptomen, die mit oraler/transdermaler Medikation nicht ausreichend kontrolliert werden konnten, untersucht. Patienten, die an der Doppelblindphase (DBP) der Studie teilnahmen, wurden eingeladen, erneut an einer Open-Label-Phase (OLP) für bis zu weiteren 52 Wochen teilzunehmen. Insgesamt 107 Patienten wurden zu Beginn der DBP randomisiert und 84 Patienten nahmen an der OLP teil.
In beiden Phasen begannen die Patienten mit Infusionen von 1 mg/Stunde mit Ratensteigerungen von 0.5-1.0 mg / Stunde pro Tag, bis entweder ein Maximum von 8 mg/Stunde oder die Kontrolle der motorischen Symptome erreicht war, je nachdem, was zuerst eintrat. Andere Antiparkinsonmittel konnten in den ersten 4 Wochen der Behandlung schrittweise abgesetzt werden. In der DBP erhielt jeder Patient am ersten Tag der Titration (Besuch 3, Tag 1) eine Anfangsdosis von Apomorphin oder Placebo als subkutane Infusion von 1 mg/Stunde. Die stündliche Flussrate wurde durch eine tägliche Steigerung um 0.5-1.0 mg / Stunde während Besuch 3 (5-10 Tage stationär oder ambulant) und bis Besuch 6 (Woche 4) der Doppelblindbehandlung auf eine erwartete Steady-State-Infusionsrate von 3-8 mg/Stunde für 14-18 Stunden pro Tag angepasst, abhängig von der individuellen Verträglichkeit und Wirksamkeit.
Der primäre Wirksamkeitsendpunkt war die kleinste quadratische mittlere Veränderung der «Off»-Stunden pro Tag, die in den Patiententagebüchern aufgezeichnet wurden, im Vergleich zwischen Tag 0 und Woche 12 in der modifizierten Intent-to-Treat (mITT)-Population (n=105, 53 Apomorphin und 52 Placebo) unter Verwendung eines Mixed-Effects-Modells für wiederholte Messungen (MMRM). Die Analyse der «Off»-Zeit zeigte eine statistisch signifikante Reduktion der «Off»-Zeit bei den mit Apomorphin behandelten Patienten im Vergleich zu Placebo (p=0.0047), (Tabelle 1).
Diese Daten wurden durch sekundäre Endpunkte in der DBP und in der mITT-Population hinsichtlich der Veränderung der täglichen «On»-Zeit ohne störende Dyskinesien und des Patient's Global Impression of Change (PGI-C), die hierarchisch getestet wurden, unterstützt. Die PGI-C-Skala reicht von 1 (sehr stark verbessert) bis 7 (sehr stark verschlechtert). Die kleinste quadrierte mittlere Veränderung der täglichen «On»-Zeit ohne störende Dyskinesien zeigte einen statistisch signifikanten Anstieg für Patienten, die Apomorphin im Vergleich zu Placebo einnahmen (p=0.0022) (Tabelle 1) und der PGI-C-Score war in Woche 12 für Apomorphin statistisch signifikant höher als für Placebo (p<0.0001) (Tabelle 2).
Tabelle 1: Zusammenfassung der Resultate der DBP-Studie zum Vergleich der kontinuierlichen subkutanen Infusion von Apomorphin mit Placebo
|
Behandlungsgruppe
|
n
|
Baseline Mittelwert (SD)
Stunden
|
Endpunkt Mittelwert (SD)
Stunden
|
LS Mittelwert (SE) der Änderung
Stunden
|
LS Mittelwert (SE) der Differenz
Stunden
|
p-Wert
| |
Primärer Endpunkt: Veränderung der täglichen «Off»-Zeit über 24 Stunden
| |
Apomorphin
|
53
|
6.69 (2.224)
|
4.06 (0.414)
|
-2.61 (0.414)
|
-1.87 (0.654)
|
0.0047
| |
Placebo
|
52
|
6.79 (2.569)
|
5.92 (0.463)
|
-0.75 (0.463)
|
|
| |
Sekundärer Endpunkt: Veränderung der täglichen «On»-Zeit ohne störende Dyskinesien über 24 Stunden
| |
Apomorphin
|
53
|
8.56 (2.329)
|
11.49 (0.423)
|
2.90 (0.423)
|
2.05 (0.666)
|
0.0022
| |
Placebo
|
52
|
8.62 (2.477)
|
9.44 (0.476)
|
0.85 (0.476)
|
|
|
Tabelle 2: Anzahl der Patienten nach PGI-C-Score (DBP)
|
Status in Woche 12 im Vergleich zum Ausgangswert
|
Apomorphin (n=43)
|
Placebo (n=34)
| |
Sehr stark verbessert
|
3 (7.0%)
|
0
| |
Sehr verbessert
|
12 (27.9%)
|
2 (5.9%)
| |
Minimal verbessert
|
19 (44.2%)
|
6 (17.6%)
| |
Keine Veränderung
|
3 (7.0%)
|
12 (35.3%)
| |
Minimal schlechter
|
2 (4.7%)
|
10 (29.4%)
| |
Deutlich schlechter
|
4 (9.3%)
|
3 (9.7%)
| |
Sehr viel schlechter
|
0
|
0
| |
p-Wert (Wilcoxon Rank Sum Test)
|
<0.0001
|
|
84 Patienten nahmen an der OLP teil, 40 aus der Apomorphin-Gruppe und 44 aus der Placebo-Gruppe, und alle erhielten Apomorphin ab dem Tag nach dem Besuch in Woche 12 der DBP, erneut titriert von 1 mg/Stunde bis zu einem Maximum von 8 mg/Stunde oder wenn die motorischen Symptome kontrolliert waren, je nachdem, was zuerst eintrat. Die Ergebnisse sind in Tabelle 3 zusammengefasst und zeigen, dass Patienten, die in der DBP mit Apomorphin behandelt worden waren, in der OLP bis zu 52 Wochen lang ein Ansprechen zeigten. Patienten, die in der DBP Placebo erhalten hatten (Apomorphin-naiv), sprachen auf Apomorphin bis zu 52 Wochen lang an. Die Resultate der OLP-Studie waren für eine statistische Analyse nicht geeignet.
Tabelle 3: Zusammenfassung der Resultate in der Open-Label-Phase
|
Behandlungsgruppe
|
n
|
OLP Baseline
Mittelwert (SD)
Stunden
|
Woche 52 OLP
Mittelwert (SD)
Stunden
|
Mittelwert (SD) der
Veränderung
Stunden
| |
Veränderung der täglichen «Off»-Zeit über 24 Stunden OLP Woche 52 im Vergleich zu OLP Baseline
| |
Apomorphin
|
40
|
4.1 (3.6)
|
3.4 (3.1)
|
-0.6 (3.1)
| |
Apomorphin-naiv
|
44
|
6.2 (2.9)
|
2.8 (2.1)
|
-3.6 (2.3)
| |
Veränderung der täglichen «On»-Zeit ohne störende Dyskinesie OLP Woche 52 im Vergleich zu OLP Baseline
| |
Apomorphin
|
40
|
11.3 (3.8)
|
12.0 (3.3)
|
0.7 (3.2)
| |
Apomorphin-naiv
|
44
|
9.3 (3.7)
|
12.2 (3.1)
|
3.0 (3.1)
|
PharmakokinetikAbsorption
Nach subkutaner Injektion von Apomorphin kann seine Verteilung und der Abbau entsprechend einem Zwei-Kompartiment-Modell beschrieben werden. Dabei beträgt die Verteilungshalbwertszeit 5 (± 1.1) Minuten und die Eliminationshalbwertszeit 33 (± 3.9) Minuten. Die klinische Wirkung korreliert gut mit dem Apomorphin-Spiegel im Liquor. Apomorphin wird schnell und vollständig aus dem subkutanen Gewebe resorbiert, was mit dem schnellen Einsetzen der klinischen Wirkung (4–12 Minuten) korreliert.
Distribution
Siehe unter Absorption.
Metabolismus
Der Metabolismus des Apomorphins erfolgt durch Glukuronidierung und Sulfonierung von mindestens 10% der Gesamtmenge; andere Abbaumechanismen sind nicht beschrieben worden.
Elimination
Das kurze Andauern der klinischen Wirkung des Wirkstoffes (ca. 1 Stunde) ist mit seiner schnellen Ausscheidung zu erklären.
Präklinische DatenToxizitätsstudien mit wiederholter subkutaner Gabe zeigten keine speziellen Risiken für die klinische Anwendung beim Menschen.
In-vitro-Genotoxizitätsuntersuchungen zeigten mutagene und klastogene Wirkungen, die wahrscheinlich auf Oxidationsprodukte des Apomorphins zurückzuführen sind. Apomorphin war jedoch in In-vivo-Studien nicht genotoxisch.
Der Effekt von Apomorphin auf die Reproduktion wurde an Ratten und Kaninchen untersucht. Apomorphin erwies sich für beide Spezies als nicht teratogen. Bei Ratten wurde in einer prä- und postnatalen Entwicklungsstudie jedoch festgestellt, dass Dosierungen, die für die Muttertiere toxisch sind, eine Verschlechterung im mütterlichen Pflegeverhalten verursachen und bei den Neugeborenen zu Atemstillstand führen können. Es gab keine Hinweise auf eine Beeinflussung der Fertilität.
Karzinogenitätsstudien wurden an Mäusen (Kurzzeit) und Ratten (Langzeit) durchgeführt. Beide Studien zeigten entzündliche Hautveränderungen an den Stellen der wiederholten Injektion, wobei die Inzidenz von Hautadenomen bei der höchsten verabreichten Dosis erhöht war. Bei Ratten wurde eine höhere Inzidenz von Hoden-Leydig-Zelltumoren festgestellt, der Mechanismus, durch den dies geschieht, wird beim Menschen aber als nicht relevant angesehen.
Sonstige HinweiseInkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf das Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Nach dem Öffnen die Patrone sofort verwenden. Nicht verwendete Lösung sollte nach 48 Stunden entsorgt werden und es muss eine neue Patrone verwendet werden.
Die Zubereitung enthält kein Konservierungsmittel. Chemische und physikalische in-use Stabilität wurde für 48 Stunden bei 25°C gezeigt. Aus mikrobiologischen Gründen ist die gebrauchsfertige Zubereitung unmittelbar nach Anbruch zu verwenden. Wenn sich die Lösung grün verfärbt hat, die Lösung trüb ist oder in der Lösung Partikel sichtbar sind, darf die Patrone nicht verwendet werden.
Besondere Lagerungshinweise
Nicht über 30°C in der Originalverpackung und für Kinder unerreichbar aufbewahren.
Hinweise für die Handhabung
Siehe Beschreibung am Ende der Fachinformation.
Zulassungsnummer68604 (Swissmedic)
PackungenAPO-go 100 mg / 20 ml Infusionslösung in einer Patrone: 5 [B]
ZulassungsinhaberinSpirig HealthCare AG, 4622 Egerkingen
Stand der InformationOktober 2022
Hinweise für die Handhabung
So wird die Infusion mit APO-go 100 mg / 20 ml vorbereitet:
Waschen Sie sich die Hände und trocknen Sie sie ab, bevor Sie mit Infusionsgeräten arbeiten.
Stellen Sie sicher, dass Sie einen Behälter zur Entsorgung scharfer und spitzer Gegenstände sowie folgende Gegenstände zur Hand haben, bevor Sie beginnen:
1 x Infusionsleitung (für alle 24 Stunden)1 x CronoBell Sleeve1 x Patrone (enthält das Arzneimittel)1 x Pumpe (Crono APO-go III Infusionspumpe oder Crono PAR4 20 Infusionspumpe) mit Manschettenanschluss1 x Tablett
Bei Bedarf erhalten Sie ebenfalls:
1 x Box mit sterilen Luer-Verschlusskappen zur Einmalnutzung

Bitte beachten Sie, dass es drei verschiedene Szenarien zum Verwenden und Wechseln der Patrone gibt. Diese werden auf den nächsten Seiten dargestellt. Bitte befolgen Sie die nachstehenden Anweisungen gemäss den Vorgaben Ihres medizinischen Fachpersonals.
Anweisungen zur Verwendung der Patrone für 1 Tag
Bitte folgen Sie den nachstehenden Anweisungen, wenn Sie die Patrone für einen Tag anwenden, ohne sie tagsüber zu wechseln:
|
|

|
|

|
|

| |
1. Waschen und trocknen Sie Ihre Hände.
|
2. Entfernen Sie die Plastikverschlusskappe von der Patrone und entsorgen Sie diese.
|
3. Nehmen Sie die CronoBell Sleeve aus der sterilen Verpackung.
| |
|

|
|

|
|

| |
4. Schliessen Sie die Infusionsleitung an die Oberseite der CronoBell Sleeve an und drehen Sie sie im Uhrzeigersinn, bis sie festsitzt.
|
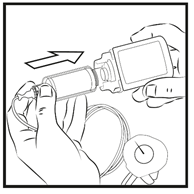
5. Stellen Sie die Patrone auf eine ebene Fläche und drücken Sie die CronoBell Sleeve fest auf die Patrone, bis der Gummistopfen oben in der Patrone durchstochen ist.
|
6. Die CronoBell Sleeve (inklusive Patrone und Infusionsleitung) kann jetzt an die Pumpe angeschlossen werden.
| |
|
|
|

|
|

| |
7. Schieben Sie die CronoBell Sleeve (mit eingesetzter Patrone) auf die Manschette der Pumpe und richten Sie die beiden Fortsätze der CronoBell Sleeve aus.
|
8. Drehen Sie die CronoBell Sleeve (mit eingesetzter Patrone) im Uhrzeigersinn, bis sie einrastet.
|
9. Auf Anweisung Ihres medizinischen Fachpersonals kann die Infusionsleitung vorbefüllt werden. Führen Sie die Nadel der Infusionsleitung gemäss den Anweisungen Ihres medizinischen Fachpersonals unter die Haut ein. Bitte beachten Sie das Handbuch «Die tägliche Routine mit APO-go®» sowie auch die spezifischen Anweisungen Ihres Infusions-Sets.
| |
|

|
|

|
|

| |
10. Ist die Nadel der Infusionsleitung unter die Haut eingeführt, kann die Pumpe eingeschaltet und die Infusion gestartet werden.
Am Ende der Infusion kann die Pumpe ausgeschaltet und die Infusionsleitung von der Haut entfernt werden.
Die Infusion wird üblicherweise vor dem Schlafen gestoppt.
|
11. Gehen Sie sicher, dass der Schieber der Pumpe komplett zurückgezogen ist. Erst dann können die CronoBell Sleeve (mit eingesetzter Patrone) und die Infusionsleitung zurückgedreht und abgelöst werden.
|
12. Entsorgen Sie die CronoBell Sleeve (mit eingesetzter Patrone) und die Infusionsleitung in einem Behälter zur Entsorgung scharfer und spitzer Gegenstände.
|
Anweisungen zur Verwendung derselben Patrone über 2 Tage
Bitte folgen Sie den nachstehenden Anweisungen, falls Sie die Patrone für maximal 48 Stunden anwenden:
|
|

|
|

|
|

| |
1. Waschen und trocknen Sie Ihre Hände.
|
2. Entfernen Sie die Plastikverschlusskappe von der Patrone und entsorgen Sie diese.
|
3. Nehmen Sie die CronoBell Sleeve aus der sterilen Verpackung.
| |
|

|
|

|
|

| |
4. Schliessen Sie die Infusionsleitung an die Oberseite der CronoBell Sleeve an und drehen Sie sie im Uhrzeigersinn, bis sie festsitzt.
|
5. Stellen Sie die Patrone auf eine ebene Fläche und drücken Sie die CronoBell Sleeve fest auf die Patrone, bis der Gummistopfen oben in der Patrone durchstochen ist.
|
6. Die CronoBell Sleeve (inklusive Patrone und Infusionsleitung) kann jetzt an die Pumpe angeschlossen werden.
| |
|

|
|

|
|

| |
7. Schieben Sie die CronoBell Sleeve (mit eingesetzter Patrone) auf die Manschette der Pumpe und richten Sie die beiden Fortsätze der CronoBell Sleeve aus.
|
8. Drehen Sie die CronoBell Sleeve (mit eingesetzter Patrone) im Uhrzeigersinn, bis sie einrastet.
|
9. Auf Anweisung Ihres medizinischen Fachpersonals kann die Infusionsleitung vorbefüllt werden. Führen Sie die Nadel der Infusionsleitung gemäss den Anweisungen Ihres medizinischen Fachpersonals ein. Bitte beachten Sie das Handbuch «Die tägliche Routine mit APO-go®» sowie auch die spezifischen Anweisungen Ihres Infusions-Sets.
| |
|

|
So legen Sie die Pumpe mit Patrone und CronoBell Sleeve für die Nacht zur Seite
(Schritte 11–13)
|
|

| |
10. Ist die Nadel der Infusionsleitung in die Haut eingeführt, kann die Pumpe eingeschaltet und die Infusion gestartet werden.
Am Ende der Infusion kann die Pumpe ausgeschaltet werden.
Die Infusion wird üblicherweise vor dem Schlafen gestoppt.
|
|
11. Waschen und trocknen Sie Ihre Hände wie in Schritt 1 und entfernen Sie die Infusionsleitung vom Körper/Patienten.
Stellen Sie die noch mit der Patrone/Sleeve verbundene Pumpe vertikal auf das Tablett. Entfernen Sie die Infusionsleitung von der Pumpe und entsorgen Sie sie in einem Behälter zur Entsorgung scharfer und spitzer Gegenstände.
Wischen Sie Verschüttetes mit dem Alkoholtupfer auf.
| |
|

|
|

|
So starten Sie die Infusion am nächsten Morgen
(Schritte 14–17)
| |
12. Schrauben Sie die sterile Luer-Verschlusskappe auf die CronoBell Sleeve (die Patrone bleibt drinnen).
|
13. Bewahren Sie das Tablett mit der Infusionspumpe an einem sicheren Platz auf. Unter 30°C lagern und nicht im Kühlschrank aufbewahren. Ausser Reichweite von Kindern aufbewahren.
|
| |
|

|
|

|
|

| |
14. Am folgenden Tag waschen und trocknen Sie Ihre Hände.
|
15. Schrauben Sie die Luer-Verschlusskappe ab und entsorgen Sie diese im Müll. Reinigen Sie die Oberfläche der CronoBell Sleeve mit einem Alkoholtupfer. Nehmen Sie sofort eine neue Infusionsleitung, schliessen Sie diese an die Oberseite der CronoBell Sleeve (mit eingesetzter Patrone) an und drehen Sie sie im Uhrzeigersinn, bis sie festsitzt.
|
16. Auf Anweisung Ihres medizinischen Fachpersonals kann die Infusionsleitung vorbefüllt werden. Führen Sie die Infusionsleitung gemäss den Anweisungen Ihres medizinischen Fachpersonals ein. Bitte beachten Sie das Handbuch «Die tägliche Routine mit APO-go®» sowie auch die spezifischen Anweisungen Ihres Infusions-Sets.
| |
|

|
|

|
|

| |
17. Ist die Nadel der Infusionsleitung in die Haut eingeführt, kann die Pumpe eingeschaltet und die Infusion erneut gestartet werden.
Am Ende der Infusion kann die Pumpe ausgeschaltet und die Infusionsleitung von der Haut entfernt werden.
|
18. Gehen Sie sicher, dass der Schieber der Pumpe komplett zurückgezogen ist. Erst dann können die CronoBell Sleeve (mit eingesetzter Patrone) und die Infusionsleitung zurückgedreht und abgelöst werden.
|
19. Entsorgen Sie die CronoBell Sleeve (mit eingesetzter Patrone) und die Infusionsleitung in einem Behälter zur Entsorgung scharfer und spitzer Gegenstände.
|
Anweisungen zum Wechseln der Patrone im Laufe des Tages
Wenn Sie die Pumpe länger als 1 Tag verwenden, kann es erforderlich sein, eine neue Patrone zu verwenden, wenn die alte verbraucht ist. Bitte folgen Sie den nachstehenden Anweisungen, wenn Sie die Patrone tagsüber wechseln:
|
|

|
|

|
|

| |
1. Waschen und trocknen Sie Ihre Hände.
|
2. Entfernen Sie die Plastikverschlusskappe von der Patrone und entsorgen Sie diese.
|
3. Nehmen Sie die CronoBell Sleeve aus der sterilen Verpackung.
| |
|

|
|

|
|

| |
4. Stellen Sie die Patrone auf eine ebene Fläche und drücken Sie die CronoBell Sleeve fest auf die Patrone, bis der Gummistopfen oben in der Patrone durchstochen ist.
|
5. Die CronoBell Sleeve (inklusive Patrone) kann jetzt an die Pumpe angeschlossen werden. Wischen Sie Verschüttetes mit einem Alkoholtupfer auf.
|
6. Stoppen Sie die Infusion.
| |
|

|
|

|
|

| |
7. Lösen Sie die Infusionsleitung von der benutzten CronoBell Sleeve (mit eingesetzter Patrone), wobei die Infusionsleitung in der Haut bleibt.
|
8. Wischen Sie das Ende der Infusionsleitung mit einem frischen Alkoholtupfer ab.
Um Kontaminationen zu vermeiden, dürfen Sie das Ende der Infusionsleitung, ausser zum Abwischen, nicht berühren.
|
9. Schliessen Sie die Infusionsleitung an die frisch vorbereitete CronoBell Sleeve (mit eingesetzter Patrone) an.
| |
|

|
|

|
|

| |
10. Gehen Sie sicher, dass der Schieber der Pumpe komplett zurückgezogen ist. Erst dann können die CronoBell Sleeve (mit eingesetzter Patrone) und die Infusionsleitung zurückgedreht und abgelöst werden.
|
11. Entsorgen Sie die gebrauchte CronoBell Sleeve (mit eingesetzter Patrone) in einem Behälter zur Entsorgung scharfer und spitzer Gegenstände.
|
12. Schieben Sie die neue CronoBell Sleeve (mit eingesetzter Patrone) auf die Manschette der Pumpe und richten Sie die beiden Fortsätze der CronoBell Sleeve aus.
| |
|

|
|

|
| |
13. Drehen Sie die CronoBell Sleeve (mit eingesetzter Patrone) nach dem Einsetzen im Uhrzeigersinn, bis sie einrastet.
|
14. Die Pumpe kann eingeschaltet und die Infusion gestartet werden.
|
|
Hinweis: Verschiedene Infusionsleitungen können unterschiedliche Handhabungen erfordern. Die Wahl der Nadel wird durch den Arzt bzw. die Ärztin bestimmt.
Für das medizinische Fachpersonal stehen Gebrauchsanweisungen für die Pumpe und die CronoBell Sleeve zur Verfügung. Darin finden Sie Einzelheiten zur Einrichtung der APO-go-Pumpe für die Dauerinfusion und eine zusätzliche Bolusdosierung.
Die Pumpe, die zur Verabreichung dieses Präparates verwendet wird, unterscheidet sich von Pumpen, die für andere Apomorphin-Präparate verwendet werden. Wenn der Patient oder die Patientin von einem anderen Präparat oder auf ein anderes Präparat umsteigt, ist daher eine erneute Schulung unter Aufsicht einer medizinischen Fachkraft erforderlich.
Nach dem Gebrauch sollten die Infusionsleitung, die CronoBell Sleeve und die Patrone entsorgt und in einem Spritzen-Entsorgungs-Behälter entsorgt werden. Nicht verwendetes Arzneimittel oder Abfallmaterial sollte durch medizinisches Fachpersonal entsorgt werden.
|














































