CompositionPrincipes actifs
Virus de l'hépatite A inactivé (souche HM175)*, antigène de surface de l'hépatite B (AgHBs)**.
* produit sur des cellules diploïdes humaines (MRC-5)
** produit dans des cellules de levure (Saccharomyces cerevisiae) par la technologie de l'ADN recombinant
Excipients
Phosphate d'aluminium, hydroxyde d'aluminium hydraté pour adsorption, chlorure de sodium (contient 3,54 mg de sodium), eau pour préparations injectables.
Résidus
Acides aminés pour injection, y compris phénylalanine, formaldéhyde, sulfate de néomycine, polysorbate 20.
Indications/Possibilités d’emploiTwinrix 720/20 est indiqué pour l'immunisation active contre les virus de l'hépatite A et de l'hépatite B chez les enfants à partir du 1er anniversaire, les adolescents et les adultes.
L'hépatite D est toujours associée à une infection par l'hépatite B; Twinrix 720/20 protège donc également contre l'hépatite D.
L'emploi de Twinrix 720/20 est recommandé pour toutes les personnes présentant un risque élevé d'une infection par l'hépatite A et l'hépatite B, notamment:
·le personnel médical (médecins, dentistes, personnel soignant, personnel paramédical et de laboratoire, sages-femmes, obstétriciens, ambulanciers);
·les patients nécessitant une hémodialyse ou une transfusion répétée de sang ou de dérivés sanguins (par exemple en cas d'hémophilie, thalassémie, drépanocytose, cirrhose);
·les patients devant subir une transplantation d'organes;
·le personnel et les personnes vivant dans des établissements fermés, établissements pénitentiaires et foyers;
·les personnes présentant un risque élevé de maladies sexuellement transmissibles (MST) (changement fréquent de partenaires, homosexuels, patients porteurs de MST);
·les toxicomanes (qui se droguent par injection i.v.) et leur personnel soignant;
·les personnes voyageant dans des régions endémiques de l'hépatite A et l'hépatite B;
·les autres personnes présentant un risque élevé d'exposition au VHB et au VHA dans leur environnement professionnel ou privé (par exemple services de sauvetage, police, pompiers, agents de sécurité et personnel de défense et autres personnes en contact étroit avec les groupes à risque);
·les personnes vivant en ménage avec des membres des groupes mentionnés ci-dessus ou avec des patients ayant une hépatite B aiguë ou chronique.
Posologie/Mode d’emploiLa dose recommandée chez l'enfant et l'adolescent à partir du 1er anniversaire jusqu'au 16e anniversaire est de 1 dose de Twinrix 720/20 (1,0 mL) en utilisant le schéma à 2 doses et pour l'adolescent à partir du 16e anniversaire et l'adulte de 1 dose de Twinrix 720/20 (1,0 mL) en utilisant le schéma à 3 doses (voir primovaccination).
Twinrix 720/20 est injecté par voie intramusculaire, chez l'enfant et l'adulte de préférence dans la région du deltoïde, chez l'enfant en bas âge au niveau antérolatéral de la cuisse.
Les injections intradermiques ou injections dans le muscle fessier doivent être évitées. Ces voies d'administration peuvent entraîner une réponse immunitaire sous-optimale.
Primovaccination
Enfants et adolescents à partir du 1er et jusqu'au 16e anniversaire
Schéma en 2 doses:
1re dose: au début de la série d'injections
2e dose: 6 à 12 mois après la 1re injection
Adolescents à partir du 16e anniversaire et adultes
Schéma en 3 doses:
1re dose: au début de la série d'injections
2e dose: 1 mois plus tard
3e dose: 6 mois après la 1re injection
Si une protection plus rapide est souhaitée, le schéma 0/7/21 jours peut être exceptionnellement utilisé chez l'adulte, par exemple chez les personnes qui ne peuvent commencer la primovaccination qu'un mois avant le départ dans des régions hautement endémiques. La vaccination de rappel doit être effectuée 12 mois après la 1re dose.
Le schéma de vaccination recommandé doit être respecté. Une fois débutée, la primovaccination doit être poursuivie avec le même vaccin.
Pour compléter la protection vaccinale contre l'hépatite A et B et pour obtenir une efficacité à long terme, toutes les doses recommandées doivent être absolument administrées.
Rappel (booster)
L'utilisation de Twinrix 720/20 est recommandée pour la vaccination de rappel. Le vaccin monovalent contre l'hépatite A ou B peut être toutefois également utilisé.
La persistance des anticorps anti-VHA et anti-HBs observée jusqu'à 15 ans après administration de la 1re dose de la primovaccination avec Twinrix 720/20 chez l'adulte correspond à celle également atteinte après administration des vaccins monovalents.
a) Composant de l'hépatite B
La nécessité de doses de rappel chez les personnes immunocompétentes qui ont répondu au vaccin de l'hépatite B après une primovaccination complète pour assurer une protection à long terme n'est jusqu'à présent pas complètement élucidé. Certains programmes officiels de vaccination incluent une recommandation pour une dose de rappel contre l'hépatite B. Cela doit être respecté.
Par mesure de prudence, un titre d'anticorps inférieur à 10 UI/l ne doit pas être atteint chez certains groupes de personnes et de patients à risque d'exposition au VHB (par exemple en cas d'hémodialyse, de troubles du système immunitaire, d'exposition importante dans une région endémique au VHB).
b) Composant de l'hépatite A
Il n'est jusqu'à présent pas complètement établi si les personnes immunocompétentes qui ont répondu au vaccin contre l'hépatite A ont besoin de vaccinations de rappel pour assurer une protection à long terme ou si la protection à long terme est assurée par la mémoire immunologique. La persistance prévue des anticorps anti-VHA est d'au moins 10 ans.
Les consignes de rappel se basent sur la supposition selon laquelle les anticorps sont nécessaires pour la protection.
Twinrix 720/20 peut être administré dans les situations dans lesquelles une dose de rappel avec le vaccin contre l'hépatite A et l'hépatite B est souhaitée. Alternativement, chez les personnes qui ont été primo-vaccinées par Twinrix 720/20, une dose de rappel avec des vaccins monovalents peut également être administrée.
Instructions posologiques particulières
Thrombocytopénie ou troubles de la coagulation sanguine: comme les injections intramusculaires peuvent être associées à des saignements ultérieurs, Twinrix 720/20 doit être administré dans ces cas par voie sous-cutanée. Ce mode d'administration peut cependant entraîner une réponse immunitaire sous-optimale.
Hémodialyse ou troubles du système immunitaire: Dans certains cas, avec la primovaccination, on n'obtient pas de titre anti-VHA et anti-VHB adéquats. L'administration d'autres doses de vaccins peut être nécessaire dans ce cas.
Chez les groupes à risque, les anticorps peuvent être mesurés régulièrement et des doses de rappel peuvent être administrées dès que le titre chute en dessous de la valeur seuil.
Contre-indicationsTwinrix 720/20 ne doit pas être administré en cas d'hypersensibilité connue à l'un des composants du vaccin, y compris la néomycine, ainsi que chez les personnes qui ont présenté des réactions d'hypersensibilité après une administration précédente de Twinrix 720/20 ou du vaccin monovalent contre l'hépatite A ou B.
L'administration de Twinrix 720/20 doit être repoussée chez les personnes qui souffrent d'une affection fébrile aiguë.
Mises en garde et précautionsTwinrix 720/20 ne doit en aucun cas être injecté par voie intravasculaire.
Une syncope (évanouissement) peut survenir après toute vaccination, voire même avant, en particulier chez les adolescents, comme réaction psychogène à l'injection. Ceci peut s'accompagner de plusieurs signes neurologiques comme un trouble transitoire de la vision, des paresthésies et des mouvements tonico-cloniques des membres durant la phase de récupération. Il est important que des mesures soient mises en place afin d'éviter des blessures en cas d'évanouissement.
Comme avec tous les vaccins injectables, un traitement médical approprié doit être tenu à disposition (par exemple, solution d'adrénaline au 1/1000) en cas de réaction anaphylactique suite à la vaccination.
Étant donné qu'une injection intradermique ou une administration intramusculaire dans le muscle fessier peuvent conduire à une réponse sous-optimale au vaccin, ces voies d'administration doivent être évitées.
Il a été observé que l'obésité (définie par un IMC ≥ 30 kg/m2) peut diminuer la réponse immunitaire aux vaccins contre l'hépatite A.
Il a été observé que certains facteurs diminuent la réponse immunitaire aux vaccins contre l'hépatite B. Ces facteurs comprennent l'âge avancé, le sexe masculin, l'obésité, le tabagisme, la nature et le mode d'administration du vaccin et certaines maladies chroniques préexistantes. Un contrôle sérologique doit être envisagé chez les patients risquant de ne pas atteindre une séroprotection après un schéma complet de vaccination avec Twinrix 720/20. L'administration de doses supplémentaires de vaccin doit être envisagée chez les personnes qui ne présentent pas de réponse immunitaire ou une réponse immunitaire insuffisante après un schéma complet de vaccination.
Comme avec tous les vaccins, une immunité protectrice peut ne pas être obtenue chez toutes les personnes vaccinées.
Le vaccin n'a pas été évalué chez les patients immunodéficients. Chez les patients hémodialysés et les personnes immunodéficientes, les titres en anticorps anti-VHA et anti-HBs obtenus après la primovaccination peuvent ne pas être adéquats. Chez ces patients, des doses de vaccin supplémentaires peuvent être nécessaires.
Twinrix 720/20 n'est pas recommandé pour une prophylaxie post-expositionnelle (par exemple après une piqûre d'aiguille).
Au moment de la vaccination, les personnes à vacciner peuvent déjà se trouver en phase d'incubation d'une infection à hépatite A ou B. Il n'est pas connu si Twinrix 720/20 peut empêcher l'hépatite A ou B dans de tels cas.
Le vaccin n'est actif que contre les agents pathogènes de l'hépatite A et B (y compris D) mais pas contre d'autres virus (par exemple de l'hépatite C et E) ou d'autres agents pathogènes d'infections hépatiques.
Twinrix 720/20 contient des traces de phénylalanine. La phénylalanine peut être dangereuse pour les personnes atteintes de phénylcétonurie, une maladie génétique rare caractérisée par l'accumulation de phénylalanine ne pouvant être éliminée correctement.
Ce médicament contient moins de 1 mmol de sodium (23 mg) par dose, c'est-à-dire qu'il est essentiellement «sans sodium».
InteractionsIl n'existe pas de données sur l'administration simultanée de Twinrix 720/20 avec l'immunoglobuline spécifique de l'hépatite A ou de l'hépatite B. Toutefois, lors de l'administration simultanée du vaccin monovalent contre l'hépatite A ou l'hépatite B et des immunoglobulines spécifiques, aucune influence sur la séroconversion n'a été observée; des titres d'anticorps plus bas sont possibles.
Les données cliniques ont montré que Twinrix 720/20 peut être administré dans la 2e année de vie en même temps que le vaccin combiné diphtérie-tétanos-coqueluche acellulaire-poliomyélite inactivé et Haemophilus influenzae de type b (DTPa-IPV+Hib) à différents sites d'injection.
Twinrix 720/20 peut être administré en même temps que le vaccin combiné rougeole-oreillons-rubéole.
Les études sur l'administration simultanée des composants monovalents contre l'hépatite A et l'hépatite B de Twinrix 720/20 avec d'autres vaccins n'ont pas montré d'interactions. Des interactions avec d'autres vaccins ne sont cependant pas attendues dans la mesure où des seringues et des sites d'injection différents sont utilisés.
Comme avec les autres vaccins, il faut s'attendre à ce que la réponse immunitaire chez les patients immunodéficients ou présentant une immunosuppression soit éventuellement insuffisante.
Grossesse, allaitementTwinrix 720/20 ne doit être utilisé pendant la grossesse qu'en cas de nécessité absolue.
L'effet de Twinrix 720/20 sur la survie embryo-fœtale, périnatale et postnatale et sur le développement n'a pas été évalué de façon prospective dans des études cliniques.
L'effet de Twinrix 720/20 sur la survie embryo-fœtale, périnatale et postnatale et sur le développement a été évalué chez le rat dans une étude de segment III. Cette étude n'a pas montré d'effets délétères directs ou indirects sur la fertilité, la gestation, le développement embryo-fœtal, la mise bas ou le développement postnatal.
Aucune étude de reproduction chez l'animal et aucune étude clinique chez la femme enceinte ou allaitante n'a été effectuée.
Par conséquent, la prudence est de rigueur lors l'utilisation de Twinrix 720/20 chez les femmes qui allaitent.
Effet sur l’aptitude à la conduite et l’utilisation de machinesTwinrix 720/20 n'a aucun effet ou qu'un effet négligeable sur l'aptitude à conduire des véhicules et à utiliser des machines.
Effets indésirablesLa composition actuelle de Twinrix 720/20 ne contient ni thiomersal ni conservateur quel qu'il soit. Dans une étude clinique, l'incidence des douleurs, rougeurs, gonflements, fatigue, gastro-entérites, céphalées et fièvre était comparable à celle observée avec la composition précédente qui contenait du thiomersal et un conservateur.
Les effets indésirables suivants ont été signalés après administration de l'ancienne formule de Twinrix 720/20 contenant un conservateur et qui a été très fréquemment utilisée.
Dans une étude comparative entre Twinrix 720/20 et ses composants monovalents (vaccins contre l'hépatite A ou l'hépatite B), aucune différence dans la fréquence des événements indésirables rapportés n'a été constatée.
Au cours des études cliniques sont survenues le plus fréquemment des réactions au site d'injection (douleurs, rougeur et gonflement).
Dans une étude clinique chez l'adulte, des céphalées ont été rapportées très fréquemment après utilisation du schéma 0/7/21 jours. Les autres effets indésirables rapportés sont survenus à la même fréquence qu'avec les autres schémas de vaccination.
Après une 4e dose qui a été administrée après 12 mois, la fréquence des effets indésirables était comparable à celle des événements observés après le schéma de vaccination 0/7/21 jours.
Études cliniques
Le profil de sécurité décrit ci-dessous se base sur les données chez plus de 6'000 personnes ayant reçu une primovaccination soit selon le schéma standard de vaccination 0, 1 et 6 mois (N=5'683), soit selon le schéma de vaccination 0, 7 et 21 jours (N=320).
Les fréquences sont indiquées comme suit: «très fréquents» (≥1/10), «fréquents» (< 1/10, ≥1/100), «occasionnels» (< 1/100, ≥1/1'000), «rares» (< 1/1'000, ≥1/10'000), «très rares» (< 1/10'000).
Infections et infestations
Occasionnels: Infections des voies respiratoires supérieures.
Affections hématologiques et du système lymphatique
Rares: Lymphadénopathie.
Troubles du métabolisme et de la nutrition
Rares: Perte d'appétit.
Affections du système nerveux
Très fréquents: Céphalées (schéma de vaccination 0,1,6 mois: 10,1%; schéma de vaccination 0,7,21 jours + 12 mois: 10,9%).
Occasionnels: Vertiges.
Rares: Hypoesthésie, paresthésie.
Affections vasculaires
Rares: Hypotension.
Affections gastro-intestinales
Fréquents: Symptômes gastro-intestinaux tels que diarrhée, nausée et vomissement.
Occasionnels: Douleurs abdominales*.
Affections de la peau et du tissu sous-cutané
Rares: Éruption cutanée, prurit.
Très rares: Urticaire.
Affections musculo-squelettiques et du tissu conjonctif
Occasionnels: Myalgie.
Rares: Arthralgie.
Troubles généraux et anomalies au site d'administration
Très fréquents: Douleur (schéma de vaccination 0,1,6 mois: 37,6%; schéma de vaccination 0,7,21 jours + 12 mois: 36,5%) et rougeur au site d'injection (schéma de vaccination 0,1,6 mois: 17,0%; schéma de vaccination 0,7,21 jours + 12 mois: 11,8%), fatigue (schéma de vaccination 0,1,6 mois: 11,4%; schéma de vaccination 0,7,21 jours + 12 mois: 13,4%).
Fréquents: Gonflement au site d'injection, réactions localisées, malaise.
Occasionnels: Fièvre (≥37,5 °C).
Rares: Symptômes pseudo-grippaux, frissons.
* Effets indésirables observés dans les études cliniques chez le sujet pédiatrique.
Surveillance post-commercialisation
Les effets indésirables suivants ont été rapportés soit après administration de Twinrix 720/20, soit après administration des vaccins monovalents contre l'hépatite A ou l'hépatite B de GlaxoSmithKline:
Infections et infestations
Méningite.
Affections hématologiques et du système lymphatique
Thrombocytopénie, purpura thrombocytopénique.
Affection du système immunitaire
Anaphylaxie, réactions allergiques incluant réactions anaphylactoïdes et réactions de type maladie sérique.
Affections du système nerveux
Encéphalite, encéphalopathie, neuropathie, paralysies, convulsions, névrite, sclérose en plaques, myélite, parésie faciale, polynévrite telle que syndrome de Guillain-Barré (avec paralysie ascendante), névrite optique.
Affections vasculaires
Vascularite.
Affections de la peau et du tissu sous-cutané
Œdème angioneurotique, lichen plan, érythème polymorphe.
Affections musculo-squelettiques et du tissu conjonctif
Arthrite, faiblesse musculaire.
Investigations
Modifications des examens de la fonction hépatique.
Troubles généraux et anomalies au site d'administration
Douleurs immédiates au site d'injection (juste après la vaccination), sensation de piqûre et brûlure.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageDes cas de surdosage ont été rapportés pendant la surveillance post-commercialisation. Les effets indésirables observés étaient comparables à ceux signalés après une application correcte du vaccin.
Propriétés/EffetsCode ATC
J07BC20
Mécanisme d'action
Twinrix 720/20 est un vaccin combiné; il s'agit d'une suspension stérile de virus inactivés de l'hépatite A (VHA, souche HM 175) et d'antigènes de surface de l'hépatite B obtenus par génie génétique (AgHBs), adsorbés séparément sur des sels d'aluminium.
Twinrix 720/20 est conforme aux exigences de l'OMS en matière de fabrication de substances biologiques. Les virus de l'hépatite A sont produits dans des cultures de cellules diploïdes humaines MRC-5, puis extraits, purifiés et inactivés avec du formaldéhyde. L'antigène de surface recombinant de l'hépatite B est obtenu à partir de cultures de cellules de levure (Saccharomyces cerevisiae), qui expriment l'information génétique pour la synthèse de la protéine. La protéine est purifiée à haut degré par des procédés physico-chimiques en plusieurs étapes.
Twinrix 720/20 entraîne une immunisation contre les infections par les virus de l'hépatite A et de l'hépatite B, dans la mesure où il induit la formation d'anticorps spécifiques anti-VHA et anti-HBs. Le vaccin protège également contre une hépatite D, car celle-ci n'apparaît qu'en association avec une infection par le virus de l'hépatite B.
Après administration du vaccin, la protection contre l'hépatite A et l'hépatite B apparaît en 2 à 4 semaines. Pour compléter la protection vaccinale contre l'hépatite A et B et pour obtenir une efficacité à long terme, toutes les doses recommandées doivent être absolument administrées.
Pharmacodynamique
Voir «Mécanisme d'action».
Efficacité clinique
Les résultats suivants ont été obtenus lors des essais cliniques:
Hépatite A: % de sujets vaccinés présentant des titres d'anticorps protecteurs, à chaque fois un mois après la vaccination:
|
Groupe
|
Schéma
|
Résultats
| |
Adultes
|
|
1er mois
|
2e mois
|
7e mois
| |
0, 1, 6 mois
|
94,3%
|
99,5%
|
100%
| |
|
1er mois
|
2e mois
|
13e mois
| |
0, 7, 21 jours, 12 mois
|
100%
|
99,5%
|
100%
| |
Enfants, adolescents
|
|
1er mois
|
2e mois
|
7e mois
| |
0, 6 mois
|
99,1%
|
99,1%
|
100%
|
Hépatite B: % de sujets vaccinés présentant des titres d'anticorps spécifiques, à chaque fois un mois après la vaccination (entre parenthèses: % avec titres anti-HBs ≥10 U.I./l):
|
Groupe
|
Schéma
|
Résultats
| |
Adultes
|
|
1er mois
|
2e mois
|
7e mois
| |
0, 1, 6 mois
|
70,6%
(33,7%)
|
97,4%
(83,9%)
|
>99%
(>99%)
| |
|
1er mois
|
2e mois
|
13e mois
| |
0, 7, 21 jours, 12 mois
|
82%
|
85%
|
100%
| |
Enfants, adolescents
|
|
1er mois
|
2e mois
|
7e mois
| |
0, 6 mois
|
74,2%
(37,4%)
|
85,7%
(43,4%)
|
100%
(98,2%)
|
Dans deux études à long terme chez des adultes âgés de 17 à 43 ans, 56 sujets avaient des données analysables 15 ans après une primovaccination avec Twinrix 720/20. Les taux de séropositivité en anticorps anti-VHA étaient de 100% dans les deux études et les taux de séroprotection contre l'hépatite B étaient de 89,3% et 92,9%. Les cinétiques de décroissance des anticorps anti-VHA et anti-HBs étaient similaires à celles des vaccins monovalents.
Ces données ont été recueillies avec l'ancienne formulation contenant du thiomersal et un conservateur. Une étude clinique réalisée avec la formulation actuelle chez des adultes a montré que les taux de séroprotection et séroconversion obtenus avec la nouvelle formulation étaient comparables à ceux obtenus avec la composition précédente.
Dans une étude clinique menée chez des sujets âgés de plus de 40 ans, le taux de séroconversion pour les anticorps anti-VHA et le taux de séroprotection contre l'hépatite B de Twinrix 720/20 avec un schéma 0-1-6 mois ont été comparés aux taux de séroconversion et de séroprotection des vaccins monovalents hépatites A et B administrés de façon controlatérale dans la partie supérieure du bras.
Le taux de séroprotection contre l'hépatite B après l'administration de Twinrix 720/20 était de 91,7% et 57,1% respectivement à 7 et 48 mois après la première dose, versus 79,7% et 40,1% après l'administration du vaccin hépatite B monovalent de GlaxoSmithKline Biologicals à 20 µg, et 71,0% et 26,6% après l'administration d'un autre vaccin hépatite B monovalent autorisé à 10 µg. Dans tous les groupes, les concentrations en anticorps anti-HBs diminuaient lorsque l'âge et l'indice de masse corporelle augmentaient et étaient également plus basses chez les sujets de sexe masculin comparées au sexe féminin.
Le taux de séroconversion pour les anticorps anti-VHA après administration de Twinrix 720/20 était de 97,2% aussi bien à 7 qu'à 48 mois après la première dose versus 98,9% et 93,9% après l'administration du vaccin hépatite A monovalent de GlaxoSmithKline Biologicals, et 98,9% et 96,0% après l'administration d'un autre vaccin hépatite A monovalent autorisé.
Pour évaluer la mémoire immunitaire, des sujets ont reçu une dose supplémentaire de Twinrix 720/20 48 mois après la première dose de la primovaccination avec le même vaccin. Un mois après cette dose, 95,2% des sujets vaccinés avaient atteint un taux d'anticorps anti-VHB de ≥10 mUI/mL ainsi qu'une multiplication par 179 de la moyenne géométrique de leur concentration (MGC; MGC = 7233,7 mUI/mL), caractéristique d'une mémoire immunitaire.
PharmacocinétiqueUne évaluation des propriétés pharmacocinétiques n'est pas exigée pour les vaccins.
Données précliniquesLes données précliniques basées sur des études générales de sécurité ne suggèrent aucun risque particulier pour l'homme.
Remarques particulièresIncompatibilités
Twinrix 720/20 ne doit pas être mélangé avec d'autres vaccins dans la même seringue.
Stabilité
Le vaccin ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Conserver au réfrigérateur (2°C-8°C), à l'abri de la lumière dans l'emballage d'origine et hors de portée des enfants.
Ne pas congeler! Un vaccin qui a été congelé une fois doit être jeté.
Remarques concernant la manipulation
Le vaccin doit être remis en suspension avant emploi. Le vaccin remis en suspension a une apparence blanche-trouble homogène.
Au cours du stockage, un fin précipité blanc avec un surnageant limpide et incolore peut se former.
Remise en suspension du vaccin pour obtenir une suspension blanche-trouble homogène
Le vaccin est remis en suspension en suivant les instructions suivantes.
1.Tenir la seringue droite dans la main fermée.
2.Secouer la seringue; pour cela, renverser la seringue vers le bas et la tourner à nouveau dans l'autre sens.
3.Répéter ce mouvement pendant 15 secondes énergiquement.
4.Ré-inspecter l'aspect du vaccin:
a.Le vaccin est prêt à l'emploi s'il apparaît sous la forme d'une suspension blanche-trouble homogène. Son apparence ne doit pas être limpide.
b.Si le vaccin n'apparaît pas sous la forme d'une suspension blanche-trouble homogène, secouer à nouveau la seringue pendant 15 secondes en la tournant vers le bas puis vers le haut. Vérifier à nouveau l'aspect.
Avant administration, le vaccin doit être examiné pour déceler la présence de particules étrangères et/ou de modifications de l'aspect. Si une altération est observée, le vaccin ne doit pas être administré.
Mode d'emploi de la seringue préremplie
|
|
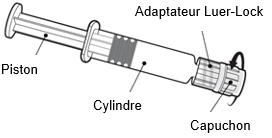
|
Tenez la seringue par le cylindre et non par le piston. Dévissez le capuchon en le tournant dans le sens inverse des aiguilles d’une montre.
| |
|
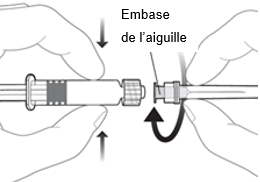
|
Pour fixer l’aiguille sur la seringue, connectez l’embase de l’aiguille sur l’adaptateur Luer-Lock et tournez l’aiguille d’un quart de tour dans le sens des aiguilles d’une montre jusqu’à sentir son enclenchement.
Ne retirez pas le piston de la seringue du cylindre. Si cela devait se produire, n’administrez pas le vaccin.
|
Élimination
Les résidus de vaccin non utilisé et les déchets doivent être éliminés conformément à la réglementation locale en vigueur.
Numéro d’autorisation00592 (Swissmedic).
PrésentationSeringues préremplies:
1 dose à 1 ml de suspension dans une seringue à usage unique prête à l'emploi: 1 et 10 (B).
Titulaire de l’autorisationGlaxoSmithKline AG, 6340 Baar
Mise à jour de l’informationDécembre 2023.
|


