CompositionPrincipes actifs
Toxoïde diphtérique; toxoïde tétanique; toxoïde de la coqueluche (PT); hémagglutinine filamenteuse (HAF) de Bordetella pertussis; pertactine (PRN) de Bordetella pertussis; poliovirus inactivé de type 1 (souche Mahoney); poliovirus inactivé de type 2 (souche MEF-1); poliovirus inactivé de type 3 (souche Saukett).
Excipients
Hydroxyde d'aluminium hydraté, phosphate d'aluminium, chlorure de sodium corresp. 1,8 mg de sodium, milieu 199, eau pour préparations injectables.
Résidus
Sulfate de néomycine, sulfate de polymyxine B, polysorbate 80, formaldéhyde.
Indications/Possibilités d’emploiBoostrix Polio est indiqué pour la vaccination de rappel contre la diphtérie, le tétanos, la coqueluche et la poliomyélite chez les personnes à partir du 4ème anniversaire (voir «Posologie/Mode d'emploi»).
Boostrix Polio doit être administré selon les recommandations officielles de vaccination.
Boostrix Polio ne doit pas être utilisé pour la primovaccination chez les enfants jusqu'à l'âge de 4 ans révolus.
Posologie/Mode d’emploiPosologie usuelle
Une dose unique de 0,5 mL du vaccin est recommandée.
La vaccination avec Boostrix Polio peut être effectuée à partir de l'âge de 4 ans.
Boostrix Polio doit être utilisé conformément aux recommandations officielles concernant les vaccins à teneur réduite en antigènes diphtérique, tétanique et coquelucheux en association avec des antigènes poliomyélitiques.
Boostrix Polio peut être administré aux femmes enceintes pendant le deuxième ou le troisième trimestre de la grossesse, conformément aux recommandations officielles (voir «Grossesse, Allaitement» et «Propriétés/Effets»).
Boostrix Polio peut en outre être administré aux adolescents et aux adultes présentant un statut vaccinal inconnu ou ayant reçu une vaccination incomplète contre la diphtérie, le tétanos et la coqueluche dans le cadre d'une série de vaccinations contre la diphtérie, le tétanos, la coqueluche et la poliomyélite (voir «Propriétés/Effets»).
Lorsque Boostrix Polio est utilisé pour une première vaccination contre la diphtérie, le tétanos, la coqueluche et la poliomyélite chez des adolescents et des adultes qui n'ont pas été vaccinés auparavant, deux doses supplémentaires d'un vaccin adapté à l'âge des sujets et contenant des antigènes diphtérique, tétanique et poliomyélitiques doivent être administrées au moins 1 et 6 mois après la première dose de Boostrix Polio, afin de compléter la série de vaccinations. En cas de statut vaccinal inconnu contre la diphtérie et le tétanos ou la poliomyélite, un dosage des anticorps peut éventuellement être envisagé avant la vaccination. Si le taux d'anticorps antidiphtériques et antitétaniques est > 0,1 UI/mL et si le taux d'anticorps antipoliomyélitiques est > 1:8 (test de neutralisation), une vaccination antérieure est probable. Dans ce cas, l'administration d'une dose unique est indiquée.
Boostrix Polio peut être utilisé dans la prévention du tétanos lors de blessures à risque tétanique chez les personnes ayant préalablement reçu une primovaccination contre le tétanos. Des immunoglobulines tétaniques doivent être administrées de façon concomitante selon les recommandations officielles.
Pour le maintien de la protection vaccinale, les vaccinations de rappel contre la diphtérie, le tétanos, la coqueluche et la poliomyélite doivent être réalisées conformément aux recommandations du plan de vaccination suisse officiel. Les intervalles de rappel, différents selon l'âge, doivent être respectés.
Bien que Boostrix Polio ait montré une bonne réponse immunologique dans une étude chez l'enfant et l'adolescent 5 ans après une vaccination de rappel antérieure ou une primovaccination, ainsi que dans une autre étude après une dose chez des adultes de plus de 40 ans qui n'avaient jamais été vaccinés ou dont la dernière vaccination remontait à plus de 20 ans (voir «Propriétés/Effets»), l'administration d'une vaccination anticoquelucheuse de rappel chez l'adolescent de plus de 16 ans et l'adulte n'est pas établie sur la base d'études cliniques d'efficacité.
Mode d'administration
Boostrix Polio doit être injecté par voie intramusculaire profonde, de préférence dans le muscle deltoïde (voir aussi «Mises en garde et précautions»).
Contre-indicationsComme pour d'autres vaccins, la vaccination par Boostrix Polio doit être différée chez les personnes atteintes d'une maladie fébrile sévère aigüe. Une légère infection ne constitue pas une contre-indication.
Boostrix Polio ne doit pas être administré aux sujets présentant une hypersensibilité avérée à l'un des composants du vaccin (voir «Composition») ou aux sujets ayant présenté des signes d'hypersensibilité après l'administration antérieure d'un vaccin contre la diphtérie, le tétanos, la coqueluche ou la poliomyélite.
Boostrix Polio est contre-indiqué chez les personnes ayant développé une encéphalopathie d'étiologie inconnue dans les 7 jours suivant l'administration antérieure d'un vaccin contenant des antigènes coquelucheux.
Boostrix Polio ne doit pas être administré aux personnes qui ont développé une thrombocytopénie transitoire ou des complications neurologiques à la suite d'une vaccination antérieure contre la diphtérie et/ou le tétanos (en ce qui concerne les convulsions ou les épisodes d'hypotonie-hyporéactivité, voir «Mises en garde et précautions»).
Mises en garde et précautionsBoostrix Polio ne doit en aucun cas être administré par voie intravasculaire.
La vaccination doit être précédée d'un contrôle de l'anamnèse (essentiellement en ce qui concerne les vaccinations antérieures et la survenue éventuelle d'effets indésirables).
Si la survenue de l'un des événements suivants est en rapport temporel avec l'administration d'un vaccin contenant un antigène de la coqueluche, la décision d'administrer un vaccin à valence coquelucheuse doit être soigneusement évaluée:
·température ≥40,0°C dans les 48 heures suivant la vaccination sans autre cause identifiable;
·collapsus ou pseudo-état de choc (épisodes d'hypotonie-hyporéactivité) dans les 48 heures suivant la vaccination;
·pleurs persistants, inconsolables pendant plus de 3 heures dans les 48 heures suivant la vaccination;
·convulsions avec ou sans fièvre survenant dans les 3 jours après la vaccination.
Dans certains cas, par exemple une incidence élevée de coqueluche, le bénéfice potentiel de la vaccination peut l'emporter sur les risques éventuels.
Comme pour toute vaccination, le rapport bénéfice/risque d'une vaccination par Boostrix Polio ou de son report chez un nourrisson ou un enfant souffrant d'une maladie neurologique sévère, qu'elle soit nouvelle ou évolutive, doit être évalué avec attention.
Comme pour tous les vaccins injectables, un traitement et une surveillance médicale appropriés doivent toujours être immédiatement disponibles pour le cas rare où surviendrait une réaction anaphylactique après l'administration du vaccin.
Boostrix Polio doit être administré avec précaution aux personnes présentant une thrombocytopénie ou un trouble de la coagulation sanguine, car une hémorragie peut survenir chez ces personnes à la suite d'une injection intramusculaire. Le vaccin peut être administré à ces personnes par voie sous-cutanée profonde, si ceci se fait en conformité avec les recommandations officielles. Pour les deux voies d'administration, une pression constante (sans frotter) doit être exercée au site d'injection pendant au moins 2 minutes.
Dans de très rares cas, on a rapporté un collapsus ou un pseudo-état de choc (épisode d'hypotonie-hyporéactivité) ainsi que des convulsions après l'immunisation d'enfants avec des produits contenant une ou plusieurs des composantes antigéniques de Boostrix Polio.
Des antécédents de convulsions fébriles, des antécédents personnels ou familiaux de crises convulsives, ainsi que des antécédents familiaux d'événements indésirables survenus après une vaccination DTP ne constituent pas une contre-indication.
Une infection par le virus de l'immunodéficience humaine (infection à VIH) n'est pas considérée comme une contre-indication. La réponse immunitaire attendue peut ne pas être obtenue après la vaccination de patients immunodéprimés.
Une syncope (évanouissement) peut survenir après toute vaccination, voire même avant, en particulier chez les adolescents, comme réaction psychogène à l'injection. Ceci peut s'accompagner de plusieurs signes neurologiques comme un trouble transitoire de la vision, des paresthésies et des mouvements tonico-cloniques des membres durant la phase de récupération. Il est important que des mesures soient mises en place afin d'éviter des blessures en cas d'évanouissement.
Comme pour tous les vaccins, il est possible que certaines personnes vaccinées ne développent pas une réponse immunitaire protectrice.
Ce médicament contient moins de 1 mmol de sodium (23 mg) par dose de vaccin, c.-à-d. qu'il est pratiquement «sans sodium».
InteractionsL'administration concomitante de Boostrix Polio avec d'autres vaccins ou immunoglobulines n'a pas fait l'objet d'études.
Si nécessaire et en accord avec la pratique de vaccination habituelle et les recommandations officielles, Boostrix Polio peut être administré en même temps que d'autres vaccins ou immunoglobulines injectés dans d'autres membres.
Comme pour d'autres vaccins, une réponse immunitaire adéquate peut faire défaut chez des patients recevant un traitement immunosuppresseur ou chez des patients présentant un déficit immunitaire.
Grossesse, allaitementGrossesse
Les données de sécurité issues d'une étude clinique contrôlée, randomisée (341 grossesses) et d'une étude d'observation prospective (793 grossesses) au cours desquelles Boostrix (la composante dTpa de Boostrix Polio) a été administré à des femmes enceintes durant le troisième trimestre de grossesse, n'ont pas montré d'effets néfastes sur la grossesse ou sur la santé du fœtus ou du nouveau-né en lien avec les vaccinations.
On ne dispose pas de données de sécurité issues d'études cliniques prospectives sur l'administration de Boostrix Polio ou de Boostrix pendant le premier et le deuxième trimestre de la grossesse.
Des données post-marketing recueillies auprès de femmes enceintes ayant été vaccinées avec Boostrix Polio ou Boostrix pendant le deuxième ou le troisième trimestre, n'ont permis d'identifier aucun effet indésirable sur la grossesse ou la santé du fœtus ou du nouveau-né en rapport avec la vaccination.
Comme pour d'autres vaccins inactivés, on ne s'attend pas à une atteinte du fœtus après une vaccination avec Boostrix Polio, quel que soit le trimestre de la grossesse au cours duquel se fait la vaccination.
Pour les données relatives à l'immunogénicité et à la prévention de la coqueluche chez les nourrissons nés de mères vaccinées avec Boostrix pendant la grossesse, voir la rubrique «Pharmacodynamique».
Des études chez l'animal n'ont pas mis en évidence d'effets délétères directs ou indirects sur la gestation, le développement embryo-fœtal, la parturition ou le développement post-natal (voir «Données précliniques»).
Allaitement
La sécurité de l'emploi de Boostrix Polio pendant l'allaitement n'a pas été étudiée.
On ignore si Boostrix Polio passe dans le lait maternel.
Le rapport bénéfice/risque doit être évalué attentivement avant l'administration de Boostrix Polio pendant l'allaitement.
Effet sur l’aptitude à la conduite et l’utilisation de machinesAucune étude n'a été effectuée sur les effets de Boostrix Polio sur l'aptitude à la conduite et l'utilisation de machines.
Certains des effets secondaires décrits dans la rubrique «Effets indésirables» pourraient cependant avoir une influence sur l'aptitude à la conduite ou l'utilisation de machines.
Effets indésirablesÉtudes cliniques
Le profil de sécurité présenté ci-dessous repose sur les données d'études cliniques dans lesquelles Boostrix Polio a été administré à 908 enfants âgés de 4 à 8 ans et à 955 personnes âgées de 10 à 93 ans.
Les effets indésirables le plus souvent observés dans les deux groupes après une vaccination par Boostrix Polio ont été des réactions locales au site d'injection (douleur, rougeur, gonflement) et ont été rapportés par 31,3 à 82,3% des sujets vaccinés. Ces événements sont généralement survenus dans les 48 heures suivant la vaccination et toutes les réactions localisées ont disparu sans séquelles.
Les indications des fréquences des réactions observées reposent sur les événements signalés spontanément dans les études. Les réactions localisées et les troubles généraux ont par contre été enregistrés de manière systématique.
Les fréquences sont indiquées comme suit: très fréquents: ≥1/10; fréquents: ≥1/100 à < 1/10; occasionnels: ≥1/1'000 à < 1/100; rares: ≥1/10'000 à < 1/1'000; très rares: < 1/10'000.
Effets indésirables rapportés au cours des études cliniques réalisées avec Boostrix Polio
|
Classe de systèmes d'organes
|
Enfants âgés de 4 à 8 ans
(n = 908)
|
Personnes âgées de 10 à 93 ans
(n = 955)
| |
Infections et infestations
| |
Occasionnels
|
|
Herpès labial
| |
Affections hématologiques et du système lymphatique
| |
Occasionnels
|
Lymphadénopathie
|
Lymphadénopathie
| |
Troubles du métabolisme et de la nutrition
| |
Fréquents
|
Perte d'appétit
|
| |
Occasionnels
|
|
Perte d'appétit
| |
Affections psychiatriques
| |
Fréquents
|
Irritabilité
|
| |
Occasionnels
|
Troubles du sommeil, apathie
|
| |
Affections du système nerveux
| |
Très fréquents
|
Somnolence (10,5%)
|
Céphalées (21,9%)
| |
Fréquents
|
Céphalées
|
| |
Occasionnels
|
|
Paresthésie, somnolence, vertiges
| |
Affections respiratoires, thoraciques et médiastinales
| |
Occasionnels
|
Gorge sèche
|
Asthme
| |
Affections gastro-intestinales
| |
Fréquents
|
|
Troubles gastro-intestinaux (tels que vomissements, douleurs abdominales, nausées)
| |
Occasionnels
|
Diarrhée, vomissements, douleurs abdominales, nausées
|
| |
Affections de la peau et du tissu sous-cutané
| |
Occasionnels
|
|
Prurit
| |
Affections musculosquelettiques et du tissu conjonctif
| |
Occasionnels
|
|
Myalgie, arthralgie
| |
Troubles généraux et anomalies au site d'administration
| |
Très fréquents
|
Réactions au site d'injection (telles que douleur (54,1%), rougeur (50,9%) et gonflement (43,3%))
|
Réactions au site d'injection (telles que douleur (82,3%), rougeur (31,3%) et gonflement (33,2%)), fatigue (27,6%)
| |
Fréquents
|
Fièvre ≥37,5°C (y compris fièvre > 39,0°C), gonflement étendu du membre vacciné (affectant parfois l'articulation adjacente), réactions au site d'injection (telles que saignement, prurit et induration)
|
Fièvre ≥37,5°C, réactions au site d'injection (telles qu'hématome, prurit, induration, chaleur, engourdissement)
| |
Occasionnels
|
Fatigue
|
Gonflement étendu du membre vacciné (affectant parfois l'articulation adjacente), fièvre > 39,0°C, frissons, douleurs
|
Réactogénicité après vaccination répétée avec Boostrix Polio ou Boostrix
351 personnes suivies dans l'étude dTpa-IPV-008, qui avaient reçu préalablement une vaccination de base complète par 4 doses de DTPa, puis une dose de Boostrix Polio à l'âge de 4 à 8 ans (étude dTpa-IPV-001, N = 823), n'ont présenté, à part une augmentation des douleurs locales de 54,4% à 73,2%, aucune augmentation de la réactogénicité après la deuxième dose de Boostrix Polio administrée 5 ans plus tard.
Des sujets de 15 ans et plus n'ayant pas été vaccinés récemment contre la diphtérie, le tétanos, la coqueluche et la poliomyélite et ayant reçu une dose de Boostrix Polio ou une dose d'un autre vaccin à contenu réduit en antigènes, suivie d'une nouvelle dose de Boostrix Polio 10 ans plus tard, n'ont pas présenté de réactogénicité accrue.
Les sujets vaccinés ayant reçu une vaccination de base complète par 4 doses de DTPw et une dose de Boostrix à l'âge de 10 ans ont présenté une augmentation de la réactogénicité locale après une dose de rappel supplémentaire de Boostrix administrée 10 ans plus tard.
Effets indésirables identifiés après la mise sur le marché
Ces données reposent sur des notifications spontanées recueillies après la mise sur le marché. La fréquence des événements ne peut donc pas être indiquée de façon fiable.
Dans le cadre de la surveillance post-marketing, les effets indésirables suivants ont été rapportés après la vaccination par Boostrix Polio:
Affections du système immunitaire
Réactions allergiques, y compris réactions anaphylactiques et anaphylactoïdes.
Affections du système nerveux
Convulsions (avec ou sans fièvre), épisodes d'hypotonie-hyporéactivité, syncopes, syndrome de Guillain-Barré.
Affections de la peau et du tissu sous-cutané
Urticaire, angio-œdème.
Troubles généraux et anomalies au site d'administration
Gonflement étendu du membre sur lequel la vaccination a été effectuée, asthénie.
De très rares cas de thrombocytopénie ont été rapportés après l'administration de vaccins contre la diphtérie et le tétanos.
Après administration de vaccins contre la diphtérie et le tétanos, de très rares cas d'effets indésirables au niveau du système nerveux central ou périphérique, incluant une paralysie ascendante pouvant aller jusqu'à une paralysie respiratoire (par exemple, syndrome de Guillain-Barré), ont été rapportés.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageDes cas de surdosage ont été rapportés dans le cadre de la surveillance post-marketing. Les effets indésirables rapportés à la suite de surdosages étaient similaires à ceux rapportés à la suite d'une utilisation normale.
Propriétés/EffetsCode ATC
J07CA02 (vaccin bactérien et viral combiné)
Mécanisme d'action
Non pertinent.
Pharmacodynamique
Réponse immunitaire
Les résultats de la réponse immunitaire à Boostrix Polio chez 1469 patients un mois après la vaccination sont présentés dans le tableau ci-dessous:
|
Antigène
|
Réponse
|
Adultes, adolescents et enfants à partir de 4 ans*
| |
Diphtérie
|
Sujets vaccinés avec ≥0,1 UI/mL
|
83,5 – 100%
| |
Tétanos
|
Sujets vaccinés avec ≥0,1 UI/mL
|
99,6 – 100%
| |
Coqueluche
| |
Toxoïde de la coqueluche
|
Réponse immunitaire
|
94,2 – 97,8%
| |
Hémagglutinine filamenteuse
|
Réponse immunitaire
|
90,1 – 97,2%
| |
Pertactine
|
Réponse immunitaire
|
96,5 – 99,3%
| |
Poliovirus inactivé
| |
Type 1
|
Séroprotection ≥8 ED50
|
99,6 – 100%
| |
Type 2
|
Séroprotection ≥8 ED50
|
99,6 – 100%
| |
Type 3
|
Séroprotection ≥8 ED50
|
99,1 – 100%
|
* La réponse immunitaire et le taux de séroprotection obtenus dans les études cliniques après une dose de rappel de Boostrix Polio étaient pour tous les antigènes du même ordre de grandeur que ceux obtenus avec les vaccins comparateurs.
Comme avec d'autres vaccins commerciaux dT, les titres en anticorps antidiphtériques et antitétaniques ainsi que les taux de séroprotection obtenus avec Boostrix Polio sont plus élevés chez l'enfant et l'adolescent que chez l'adulte.
Efficacité de la protection contre la coqueluche
Aucune corrélation n'est actuellement définie pour la protection anticoquelucheuse.
Les antigènes coquelucheux contenus dans Boostrix Polio sont des éléments intégraux du vaccin anticoquelucheux acellulaire combiné destiné aux enfants (Infanrix), dont l'efficacité après l'immunisation de base a été démontrée dans une étude de contact en milieu familial. Après la vaccination par Boostrix Polio, les titres en anticorps dirigés contre les trois composants coquelucheux sont supérieurs à ceux observés pendant l'étude de contact en milieu familial. Bien que ni le degré, ni la durée de la protection obtenue par le vaccin n'aient encore été établis, ces comparaisons permettent de supposer une protection contre la coqueluche après la vaccination par Boostrix Polio.
Immunogénicité contre la coqueluche chez des nourrissons (âgés de moins de 3 mois) dont les mères ont été vaccinées pendant la grossesse
Dans une étude contrôlée par placebo, randomisée, avec permutation, des concentrations plus élevées d'anticorps contre la coqueluche ont été mises en évidence, lors de l'accouchement, dans le sang du cordon ombilical de nourrissons nés de mères qui avaient été vaccinées avec Boostrix entre la 27ème et la 36ème semaine de grossesse (N = 291) par rapport aux nourrissons dont les mères avaient reçu un placebo (N = 292). Les moyennes géométriques des concentrations d'anticorps contre les antigènes de la coqueluche PT, HAF et PRN dans le sang du cordon ombilical s'élevaient à 46,9, 366,1 et 301,8 UI/mL dans le groupe dTpa et à 5,5, 22,7 et 14,6 UI/mL dans le groupe contrôle. Ceci correspond à des titres d'anticorps 8, 16 et 21 fois plus élevés dans le sang du cordon ombilical de nourrissons nés de mères vaccinées que chez les nourrissons du groupe contrôle. Ces titres d'anticorps peuvent offrir une protection passive contre la coqueluche, comme l'ont montré des études d'observation sur l'efficacité.
Immunogénicité chez des nourrissons et des enfants en bas âge dont les mères ont été vaccinées pendant la grossesse
Dans des études de suivi menées chez plus de 500 nourrissons et enfants en bas âge nés de mères vaccinées, les données cliniques n'ont révélé aucune interférence cliniquement significative entre la vaccination maternelle avec Boostrix et la réponse des nourrissons et des enfants en bas âge à l'immunisation de base contre les antigènes de la diphtérie, du tétanos, de l'hépatite B, du virus inactivé de la poliomyélite, de l'Haemophilus influenzae de type b ou de pneumocoques, administrée à la majorité des enfants (87,9%) selon un schéma d'immunisation de base en 3 doses.
Des concentrations plus basses d'anticorps (blunting) dirigés contre les antigènes de la coqueluche après l'immunisation de base (PT, HAF et PRN) et après la vaccination de rappel (PT, HAF) ont été observées chez des nourrissons et des enfants en bas âge dont les mères avaient été vaccinées avec le dTpa pendant la grossesse. L'augmentation des concentrations d'anticorps anti-coqueluche entre le moment précédant la vaccination de rappel et jusqu'à 1 mois après la vaccination de rappel se situait dans le même domaine, tant chez les nourrissons et les enfants en bas âge nés de mères vaccinées avec le dTpa que chez ceux nés de mères vaccinées avec le placebo. En l'absence de corrélats de protection contre la coqueluche, la signification clinique de ces observations n'est pas encore entièrement comprise. Des données épidémiologiques actuelles sur la coqueluche suggèrent néanmoins que cette interférence immunologique ne revêt pas de signification clinique.
Efficacité sur le terrain de Boostrix concernant la protection contre la coqueluche chez les nourrissons nés de mères vaccinées pendant la grossesse
L'efficacité sur le terrain du vaccin Boostrix a été évaluée dans deux études d'observation prospectives menées en Espagne et en Australie. Dans le cadre d'un programme de vaccination maternelle, le vaccin a été administré pendant le troisième trimestre de la grossesse afin de protéger des nourrissons âgés respectivement de moins de 3 mois et de moins de 6 mois contre la coqueluche.
Les détails relatifs à la méthodologie de chaque étude et à leurs résultats figurent dans le tableau ci-dessous.
Efficacité sur le terrain contre la coqueluche chez des nourrissons âgés respectivement de moins de 3 mois et de moins de 6 mois nés de mères vaccinées avec Boostrix pendant le troisième trimestre de la grossesse:
|
Lieu de l'étude
|
Vaccin
|
Méthodologie de l'étude
|
Critère d'évaluation principal
|
Effectivité de la vaccination
| |
Espagne
|
Boostrix
|
Étude cas-témoins appariés
|
Coqueluche chez les nourrissons de moins de 3 mois
|
90,9% (IC à 95%: 56,6%-98,1%)1
| |
Australie
|
Boostrix
|
Étude cas-témoins appariés
|
Coqueluche chez les nourrissons de moins de 6 mois
|
39% (IC à 95%:
-12%-66%)2
|
IC: intervalle de confiance
1Ajusté pour l'allaitement
2Ajusté pour l'allaitement (exclusivement allaités vs non exclusivement allaités), taille du ménage, semaine de grossesse (à terme vs naissance prématurée)
Pour deux critères d'évaluation secondaires, l'étude menée en Australie a montré une efficacité sur le terrain de la vaccination contre la coqueluche de 69% (IC à 95%: 13%-89%) chez les nourrissons de moins de 3 mois et une efficacité sur le terrain de la vaccination contre une hospitalisation pour cause de coqueluche de 94% (IC à 95%: 59%-99%) chez les nourrissons de moins de 6 mois. Il faut noter que ces chiffres ne reflètent que l'effet de l'immunisation maternelle (c.-à-d. en complément de la protection assurée par l'immunisation de base du nourrisson).
Si la mère est vaccinée au cours des deux semaines avant l'accouchement, l'efficacité du vaccin chez le nourrisson peut être plus faible que celle indiquée dans le tableau.
Persistance de la réponse immunitaire
Les taux de séroprotection/séropositivité suivants ont été observés cinq ans après la vaccination avec Boostrix Polio chez des enfants et 10 ans après la vaccination avec Boostrix Polio chez des adolescents et des adultes:
Persistance de la réponse immunitaire chez les enfants, les adolescents et les adultes
|
Antigène
|
Séroprotection/ Séropositivité
|
Enfants âgés de 4 à 8 ans1
(% des sujets vaccinés)
|
Adolescents et adultes âgés de 15 ans et plus2
(% des sujets vaccinés)
| |
5 ans après le 1er rappel
(N = 344)
|
Directement après le 2e rappel
(N = 336)
|
10 ans après la vaccination
(N = 201)
| |
Diphtérie
|
≥0,1 UI/mL
|
89,4%*
|
100%
|
81,0%**
| |
Tétanos
|
≥0,1 UI/mL
|
98,5%
|
100%
|
98,4%
| |
Coqueluche
| |
Toxoïde de la coqueluche
|
≥5 U.EL/mL
|
40,9%
|
99,7%
|
78,7%
| |
Hémagglutinine filamenteuse
|
|
99,7%
|
100%
|
100%
| |
Pertactine
|
|
97,1%
|
100%
|
88,7%
| |
Poliovirus inactivé
| |
Type 1
|
≥8 ED50
|
98,8%
|
100%
|
100%
| |
Type 2
|
|
99,7%
|
100%
|
100%
| |
Type 3
|
|
97,1%
|
100%
|
98,3%
|
* 98,2% des sujets présentant des concentrations en anticorps associées à une protection contre la maladie ≥0,016 UI/mL par un test de neutralisation in vitro sur cellules Vero.
** 92,1% des sujets présentant des concentrations en anticorps associées à une protection contre la maladie ≥0,01 UI/mL par un test de neutralisation in vitro sur cellules Vero.
1 Étude dTpa-IPV-008
2 Étude dTpa-IPV-012
Réponse immunitaire après administration répétée de Boostrix Polio
Chez les adultes, une dose de Boostrix Polio administrée 10 ans après la dernière dose a induit une réponse immunitaire protectrice chez > 96,8% des sujets (pour l'antigène diphtérique) et chez 100% des sujets (pour l'antigène tétanique et les antigènes poliomyélitiques). La réponse immunitaire à la dose de rappel contre les antigènes coquelucheux était comprise entre 74,2% (pour anti-PRN) et 98,4% (pour anti-PT).
Réponse immunitaire chez des personnes sans antécédent de vaccination ou avec un historique de vaccination inconnu
Après administration d'une dose de Boostrix (composante diphtérie-tétanos-coqueluche de Boostrix Polio) à 83 adolescents âgés de 11 à 18 ans, sans vaccination antérieure contre la coqueluche et sans vaccination contre la diphtérie et le tétanos au cours des 5 années précédentes, une réponse immunitaire contre la coqueluche a été induite et tous les sujets ont atteint des taux d'anticorps séroprotecteurs contre le tétanos et la diphtérie. Après l'administration d'une dose, les taux de séropositivité pour les différents antigènes de la coqueluche se situaient entre 87% et 100%.
Chez les personnes âgées de ≥40 ans n'ayant pas été vaccinées au cours des 20 dernières années contre la diphtérie ou le tétanos (y compris les personnes n'ayant jamais été vaccinées ou dont le statut vaccinal était inconnu), une dose de Boostrix Polio a induit une réponse immunitaire contre la coqueluche et la majorité dans ce groupe de personnes était protégée contre le tétanos et la diphtérie. Deux doses supplémentaires de vaccins contenant un toxoïde diphtérique et un toxoïde tétanique administrées 1 et 6 mois après la première dose ont maximisé la réponse vaccinale antidiphtérique et antitétanique (étude dTpa-034).
Le tableau suivant résume les données:
|
Antigène
|
Séroprotection/
Séropositivité
|
Personnes de ≥40 ans1 (N = 140)
1 dose de dTpa-IPV (mois 0) et
2 doses de Td (mois 1 et 6)
| |
Avant
|
Mois 1
|
Mois 2
|
Mois 7
| |
Diphtérie
|
≥0,1 UI/mL
|
50,7%
|
77,7%
|
86,2%
|
100%
| |
Tétanos
|
≥0,1 UI/mL
|
50,4%
|
95,7%
|
100%
|
100%
| |
Coqueluche
| |
Toxoïde de la coqueluche
|
≥5 U.EL/mL
|
69,2%
|
100%
|
NA
|
NA
| |
Hémagglutinine filamenteuse
|
|
99,3%
|
100%
|
NA
|
NA
| |
Pertactine
|
|
53,2%
|
96,4%
|
NA
|
NA
| |
Poliovirus inactivé
| |
Type 1
|
≥8 ED50
|
91,7%2
|
98,5%3
|
NA
|
NA
| |
Type 2
|
|
80,6%2
|
98,5%3
|
NA
|
NA
| |
Type 3
|
|
86,1%2
|
98,4%4
|
NA
|
NA
|
Avant = avant la vaccination
NA = non applicable
1 Étude dTpa-034
2 N = 36 personnes dont les résultats étaient disponibles
3 N = 134 personnes dont les résultats étaient disponibles
4 N = 129 personnes dont les résultats étaient disponibles
Réponse immunitaire et profil de sécurité chez des personnes adultes sous traitement actif contre les maladies obstructives des voies respiratoires (asthme/BPCO)
La sécurité d'emploi et l'immunogénicité de Boostrix ont été évaluées dans une méta-analyse rétrospective (utilisation de codes médicaux) portant sur 222 personnes âgées de 18 ans et plus, dont 211 sujets per protocole (95,0%), qui ont été vaccinées avec Boostrix dans 5 études différentes (dTpa-002, Tdap-007, Tdap-008, Tdap-011, ZOSTER-042) sans autres vaccins, alors qu'elles étaient sous traitement actif pour une maladie obstructive des voies respiratoires telle que l'asthme ou la bronchopneumopathie chronique obstructive (BPCO). Des corticostéroïdes étaient utilisés pour le traitement des maladies obstructives des voies respiratoires chez 19,4% des sujets, et 40,1% des patients recevaient des préparations combinées d'adrénergiques avec des corticostéroïdes ou d'autres substances actives à l'exception des anticholinergiques. L'âge moyen des sujets au moment de la vaccination était de 55,5 ± 17,6 ans. La proportion de femmes était de 63,5%.
Un mois après la vaccination par Boostrix, les réponses immunitaires contre les antigènes de la diphtérie et du tétanos, basées sur les taux de séroprotection (≥0,1 UI/mL), étaient respectivement de 89,0% et 97,2%, et contre la coqueluche, basées sur les réponses de rappel, de 78,3% contre la toxine de la coqueluche (PT), 96,1% contre l'hémagglutinine filamenteuse (HAF) et 92,2% contre la pertactine (PRN). Le profil de sécurité n'a pas été modifié.
Efficacité clinique
Voir sous «Pharmacodynamique».
PharmacocinétiqueL'évaluation des propriétés pharmacocinétiques n'est pas requise pour les vaccins.
Absorption
Non pertinent.
Distribution
Non pertinent.
Métabolisme
Non pertinent.
Élimination
Non pertinent.
Données précliniquesToxicité en cas d'administration répétée
Les résultats d'études précliniques portant sur la sécurité et la toxicité ne suggèrent pas de risque particulier pour l'homme.
Toxicité sur la reproduction
Les données précliniques obtenues avec Boostrix Polio lors des études conventionnelles sur la fertilité femelle chez les rats et les lapins n'ont pas révélé de risques particuliers pour l'homme.
Les données précliniques obtenues avec Boostrix Polio lors des études conventionnelles sur le développement de l'embryon/du fœtus chez les rats et les lapins ainsi que sur la parturition et la toxicité post-natale chez les rats (jusqu'à la fin de la période de lactation) n'ont pas révélé de risques particuliers pour l'homme.
Remarques particulièresIncompatibilités
Boostrix Polio ne doit pas être mélangé avec d'autres vaccins dans la même seringue.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Conserver au réfrigérateur (2-8°C), à l'abri de la lumière dans l'emballage d'origine et hors de portée des enfants.
Ne pas congeler! Un vaccin qui a été congelé doit être jeté.
Remarques concernant la manipulation
Le vaccin doit être bien agité avant son utilisation pour obtenir une suspension homogène blanchâtre et trouble. Le vaccin doit en outre être soumis à un contrôle visuel avant son usage afin de déceler la présence de particules étrangères et/ou de modifications d'aspect. En cas d'altérations, le vaccin ne doit pas être administré.
Mode d'emploi de la seringue préremplie:
|
|
|
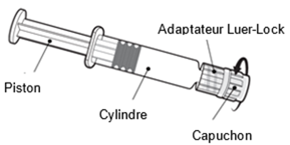
Tenez la seringue par le cylindre, pas par le piston.
Dévissez le capuchon de la seringue en le tournant dans le sens inverse des aiguilles d'une montre.
| |
|
|
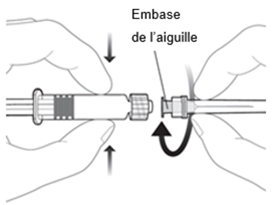
Pour fixer l'aiguille à la seringue, connectez l'embase de l'aiguille à l'adaptateur Luer-Lock et tournez l'aiguille d'un quart de tour dans le sens des aiguilles d'une montre jusqu'à ce que vous sentiez qu'elle s'enclenche.
Ne tirez pas le piston de la seringue hors du cylindre. Si cela se devait se produire, n'administrez pas le vaccin.
|
Les résidus de vaccin non utilisés et les déchets doivent être éliminés conformément aux exigences nationales.
Numéro d’autorisation00681 (Swissmedic)
Présentation1 dose de vaccin à 0,5 mL de suspension injectable dans une seringue préremplie avec une aiguille jointe séparément: emballages de 1 et 10 seringues préremplies. [B]
Titulaire de l’autorisationGlaxoSmithKline AG, 6340 Baar
Mise à jour de l’informationJuillet 2023
|


