CompositionPrincipes actifs
Triptoréline, sous forme de embonate de triptoréline.
Excipients
Polymère D, L-lactide-co-glycolide, Mannitol, Carmellose sodique*, Polysorbate 80.
Solvant: Eau pour préparations injectables.
* la quantité de sodium apportée par la carmellose sodique correspond à 2.3 mg par dose.
Indications/Possibilités d’emploiSalvacyl est indiqué pour une réduction réversible et prolongée (de plus de trois mois) des taux de testostérone au niveau de castration chez l'homme adulte souffrant de déviances sexuelles.
Un traitement par Salvacyl ne saurait être initié qu'après une expertise médico-légale préalable par un psychiatre spécialement formé et habilité à cette tâche.
Le traitement doit être administré en combinaison avec une psychothérapie dans le but de diminuer le comportement sexuel déviant.
Des données démontrant un effet favorable de Salvacyl sur le comportement sexuel déviant ne sont pas disponibles. Un succès de la thérapie ne peut être garanti ni en général, ni dans les cas particuliers.
Un traitement par Salvacyl ne dispense pas des mesures judiciaires telles que l'internement, qui tendent à la prévention de comportements déviants.
Posologie/Mode d’emploiLa préparation Salvacyl ne doit être utilisée que par les médecins ou le personnel médical.
Mode d'administration
Du fait que Salvacyl est une suspension de microgranules, toute injection intravasculaire doit absolument être évitée. Le site d'injection doit changer périodiquement.
Pour la préparation de la suspension injectable prête à l'emploi, se reporter à la rubrique «Remarques particulières», paragraphe «Mode de préparation».
Posologie usuelle
Salvacyl s'administre à raison d'une injection intramusculaire toutes les douze semaines.
Salvacyl doit être administré sous contrôle médical.
L'évaluation de l'efficacité du traitement est essentiellement clinique. Une évaluation clinique de l'efficacité sera faite régulièrement, par exemple avant chaque injection trimestrielle de triptoréline. En cas de doute, les taux sériques de testostérone peuvent être mesurés.
Instructions posologiques particulières
Patients âgés
Une adaptation de la dose en fonction de l'âge n'est pas nécessaire.
Patients présentant des troubles de la fonction rénale
Aucune adaptation de la posologie n'est requise pour les patients souffrant d'une fonction rénale limitée.
Patients présentant des troubles de la fonction hépatique
Aucune adaptation de la posologie n'est requise pour les patients souffrant d'une fonction hépatique limitée.
Contre-indicationsHypersensibilité à la triptoréline, à d'autres analogues de la GnRH, ou à l'un des excipients selon la composition.
Castration chirurgicale.
Mises en garde et précautionsTestostérone sérique:
Au début du traitement, la triptoréline peut causer une augmentation transitoire du taux de testostérone sérique. Ainsi, lors de la phase initiale du traitement, le patient sera suivi attentivement par le médecin traitant et l'administration additionnelle d'un anti-androgène adapté sera envisagée si nécessaire, ceci afin de neutraliser l'augmentation initiale du taux sérique de testostérone et ainsi la possible aggravation des pulsions sexuelles.
Une fois le taux de castration de la testostérone atteint à la fin du premier mois, ce taux est maintenu aussi longtemps que les patients reçoivent leur injection toutes les douze semaines.
A l'arrêt du traitement, il existe un risque d'augmentation de la sensibilité à la testostérone, ce qui peut conduire à une augmentation des pulsions sexuelles. Dès lors, l'administration additionnelle d'un anti-androgène adapté avant l'arrêt de Salvacyl devrait être envisagée.
Apoplexie hypophysaire:
Un traitement chez les patients hommes traités avec des agonistes de la GnRH peut être à l'origine de la manifestation d'un adénome hypophysaire latent, qui peut, dans certains cas, s'accompagner d'une apoplexie hypophysaire, Les symptômes possibles sont des maux de tête soudains, des troubles visuels, une ophtalmoplégie, des vomissements et, éventuellement, des modifications de l'état mental et un collapsus cardio-vasculaire. En cas de soupçon d'apoplexie hypophysaire, le médicament doit être immédiatement arrêté et un traitement adapté doit être institué.
Troubles de l'humeur/Dépression:
Des troubles de l'humeur allant jusqu'à des dépressions (dont certaines sévères) ont été rapportés sous traitement par triptoréline. De rares cas d'idées suicidaires ou de tentatives de suicide ont également été rapportés sous traitement par d'autres analogues de la GnRH. Les patients souffrant de dépression (même dans leur anamnèse) doivent donc être étroitement surveillés pendant la prise de Salvacyl. Les patients doivent être avertis du risque d'apparition de tels symptômes (et de la possibilité d'une aggravation d'une dépression préexistante).
Ostéoporose/densité osseuse:
L'utilisation d'analogues synthétiques de la GnRH peut être associée à une réduction de la minéralisation osseuse pouvant aller jusqu'à l'ostéoporose et augmentant ainsi le risque de fractures. Aucune expérience de l'utilisation de la triptoréline chez des patients déjà atteints d'ostéoporose n'étant disponible, les patients souffrant d'une grave ostéoporose ne devraient pas être traités par Salvacyl.
Les patients qui présentent, en plus, d'autres facteurs de risques d'ostéoporose, comme un abus chronique d'alcool, le tabagisme, la malnutrition, des anamnèses familiales positives d'ostéoporose ou un traitement de longue durée par des médicaments réduisant aussi la densité osseuse (tels que les corticoïdes ou les anticonvulsifs), doivent être étroitement surveillés.
La densité minérale osseuse doit être mesurée avant le début du traitement et contrôlée au besoin à intervalles réguliers pendant le traitement. Afin d'éviter une perte de la densité osseuse due au traitement, un apport suffisant en calcium et en vitamine D (par l'alimentation) est recommandé. Il faut conseiller au besoin au patient de modifier son mode de vie en faisant p.ex. des exercices physiques réguliers entraînant une charge sur le squelette, en arrêtant de fumer et en consommant modérément de l'alcool.
Convulsions:
Des cas de convulsions ont été rapportés sous traitement par des analogues de la GnRH, en particulier chez les femmes et les enfants. Certains de ces patients présentaient des facteurs de risque de convulsions (comme des antécédents d'épilepsie, des tumeurs intracrâniennes ou un traitement concomitant avec des médicaments connus pour présenter un risque de réactions sous forme de convulsions). Mais des cas de convulsions chez des patients ne présentant aucun facteur de risque de ce type ont également été déclarés.
Réactions d'hypersensibilité:
Des réactions allergiques ont été constatées sporadiquement peu après l'injection de Salvacyl. Des cas rares de choc anaphylactique et d'oedème angioneurotique ont été rapportés après administration de triptoréline. En cas de telles réactions, le traitement avec Salvacyl doit être immédiatement interrompu et des soins appropriés doivent être administrés.
Risque de diabètes/risque cardiovasculaire:
Des études épidémiologiques ont mis en évidence des changements métaboliques (par exemple une pertubation de la tolérance au glucose, une stéatose hépatique), ou un risque accru de diabète sucré et/ou des maladies cardiovasculaires a été rapporté chez les hommes traités avec des agonistes de la GnRH. Il est donc conseillé de surveiller les patients souffrant d'hypertension, d'hyperlipidémie ou de troubles cardio-vasculaires à l'égard de ce risque au cours du traitement par la triptoréline.
Effet sur l'intervalle QT/QTc:
La privation d'androgène à long terme peut prolonger l'intervalle QT. Il est donc conseillé de surveiller les patients ayant un syndrome d'allongement de l'intervalle QT, des troubles électrolytiques ou une insuffisance cardiaque. L'utilisation concomitante de triptoréline avec des médicaments connus pour allonger l'intervalle QT ou capables d'induire des torsades de pointes tels que les anti-arythmiques de classe IA (ex. quinidine, disopyramide) ou de classe III (ex. amiodarone, sotalol) doit être évaluée avec précaution.
Patients sous anticoagulants:
Une prudence particulière est de mise chez les sujets sous anticoagulants en raison d'un risque d'hématome au point d'injection.
Risque d'anémie:
En raison de la privation androgénique, le traitement par les analogues de la GnRH peut augmenter le risque d'anémie. Ce risque doit être évalué chez les patients traités et faire l'objet d'une surveillance appropriée.
Autres précautions:
Paresthésies et migraines sévères sont rares. Dans les cas graves ou récidivants, interrompre le traitement.
Une augmentation des lymphocytes a été rapportée chez des patients traités par des analogues de la GnRH.
Excipients pharmaceutiques revêtant un intérêt particulier
Ce médicament contient moins de 1 mmol (23 mg) de sodium par dose, c.-à-d. qu'il est essentiellement «sans sodium».
InteractionsInteractions pharmacodynamiques
Quand la triptoréline est co-administrée avec des médicaments affectant la sécrétion hypophysaire de gonadotrophines, une attention particulière doit être donnée et il est recommandé de superviser l'état hormonal du patient.
Interactions pharmacocinétiques
Les cytochromes P450 (CYP) sont peu probablement impliqués dans le métabolisme et l'élimination de la triptoréline. De plus, des données in vitro ont montré que la triptoréline n'est pas un inhibiteur ou un inducteur de CYP, ni un substrat ou inhibiteur de P-glycoprotéine (P-gp). Par conséquence, les interactions pharmacocinétiques avec la triptoréline sont peu probables.
Grossesse, allaitementGrossesse
Salvacyl n'est pas indiqué chez la femme.
Allaitement
Salvacyl n'est pas indiqué chez la femme.
Effet sur l’aptitude à la conduite et l’utilisation de machinesAucune étude n'a été effectuée à ce sujet.
Mais plusieurs effets indésirables tels qu'apathie, crises épileptiques et troubles visuels peuvent atténuer les réflexes et diminuer l'aptitude à la conduite, à l'utilisation d'outils ou de machines.
Effets indésirablesLes effets indésirables les plus communément observés lors de traitement avec la triptoréline étaient dus à ses effets physiologiques attendus: augmentation initiale des taux de testostérone, suivie d'une suppression presque complète de la testostérone. Les effets le plus fréquemment observés, étaient les bouffées de chaleur (46%) et la diminution des organes génitaux (12%).
Les effets indésirables suivants ont été signalés lors des essais cliniques ou de la pharmacovigilance.
La fréquence de ces effets indésirables peut être classée comme suit: très fréquents (≥1/10); fréquents (≥1/100, <1/10); occasionnels (≥1/1000, <1/100), rares (≥1/10000, <1/1000) très rares (<1/10'000), inconnu (reposant principalement sur des annonces spontanées provenant de la surveillance du marché, la fréquence précise ne pouvant être indiquée).
Infections
Occasionnel: nasopharyngite.
Circulation sanguine et lymphatique.
Occasionnel: thrombocytose.
Rare: lymphadénopathie.
Inconnu: anémie.
Système immunitaire
Occasionnel: réactions d'hypersensibilité, inclusivement réaction anaphylactique (voir aussi « Mises en garde et précautions »).
Troubles endocriniens
Pendant la phase post-marketing, de rares cas d'apoplexie hypophysaire ont été décrits (voir «Mises en garde et précautions»).
Troubles du métabolisme et de la nutrition
Occasionnel: anorexie, appétit augmenté, perte de poids, prise de poids, hyperuricémie, hyperglycémie, créatinine sérique augmentée, urée sérique augmentée, diabète mellite.
Troubles psychiatriques
Fréquent: sautes d'humeur, baisse de libido, dépression.
Occasionnel: diminution de l'activité, nervosité, humeur euphorique, irritabilité, labilité affective, amnésie, confusion.
Système nerveux
Fréquent: céphalée, sensation vertigineuse.
Occasionnels: somnolence, insomnie, paresthésies.
Rare: hypoesthésie, migraines.
Inconnu: convulsions.
Troubles oculaires
Fréquent: douleurs visuelles, conjonctivite.
Occasionnel: perturbation visuelle, sensation anormale dans l'oeil.
Rare: perturbation du champ visuel, papille de stase.
Oreille
Occasionnel: acouphènes.
Troubles cardiaques
Très rare: ischémie myocardique.
Inconnu : allongement de l'intervalle QT.
Troubles vasculaires
Très fréquent: bouffées de chaleur (46%).
Occasionnel: hypertension, hypotension, thrombose veineuse profonde, embolie pulmonaire.
Organes respiratoires
Occasionnels: épistaxis, dyspnée, orthopnée.
Troubles gastro-intestinaux
Fréquent: nausées.
Occasionnel: distension abdominale, douleur abdominale, constipation, diarrhée, bouche sèche, dysgueusie, flatulence, vomissement, ténesmes.
Troubles hépato-biliaires
Occasionnel: augmentation des transaminases et/ou de la phosphatase alcaline, hépatite cholestatique.
Troubles cutanés et des tissus sous-cutanés
Fréquent: exanthème.
Occasionnel: prurit, transpiration plus abondante, acné, alopécie, eczéma, purpura, vésicule cutanée, éruption bulleuse.
Rare: urticaire, réactions de photosensibilisation.
Troubles musculosquelettiques
Fréquent: dorsalgie, extrémités douloureuses, crampes musculaires.
Occasionnel: faiblesse musculaire, myalgies, cervicalgies, arthralgies, raideur articulaire, contractures musculaires.
Organes de reproduction et seins
Très fréquent: diminution de volume des organes génitaux (12%).
Fréquent: troubles de l'érection.
Occasionnel: hypersensibilité mammaire, douleur mammaire, douleur du mamelon, gynécomastie, inflammation de la glande mammaire, douleur testiculaire, anéjaculation.
Troubles généraux et accidents liés au site d'administration
Fréquent: douleurs au site d'injection, asthénie, oedèmes périphériques.
Occasionnel: rougissement, hématome, sensation de brûlure et inflammation au point d'injection, fatigue, douleur thoracique, fièvre, frissons, douleur, syndrome grippal, dystasie (difficulté de la station debout).
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageLes propriétés pharmacologiques de Salvacyl rendent le risque de surdosage accidentel ou intentionnel improbable. Des tests réalisés chez l'animal suggèrent qu'aucun autre effet que les effets thérapeutiques sur la concentration d'hormones sexuelles et sur l'appareil reproducteur n'est attendu avec des doses plus élevées de Salvacyl.
Traitement
En cas de surdosage, celui-ci sera traité de façon symptomatique.
Propriétés/EffetsCode ATC
L02AE04
Mécanisme d'action
En remplaçant l'acide aminé glycine par le Dtryptophane en position 6 de la gonadoréline, on obtient un agoniste de l'hormone naturelle Gonadotropine-Releasing-Hormone (GnRH) à l'action biologique plus forte que cette dernière. Cette augmentation de l'effet peut être attribuée à une affinité renforcée pour les récepteurs hypophysaires et à une inactivation plus lente.
Pharmacodynamique
Lors de l'administration unique et intermittente de GnRH, la libération de LH et FSH de l'hypophyse est stimulée. En cas de dosage continu en revanche, comme cela se produit suite à la libération prolongée après l'injection de Salvacyl, on observe un effet «paradoxal»: les niveaux de LH, FSH, testostérone et œstrogènes/progestérone dans le plasma descendent au niveau de la castration en l'espace de deux à quatre semaines, après une augmentation passagère enregistrée au début du traitement. Ceci entraîne une atrophie des organes sexuels accessoires. Ces effets sont en général réversibles à la fin de la thérapie médicamenteuse.
Efficacité clinique
L'efficacité de la triptoréline pour réduire les taux de testostérone a été étudiée lors d'une étude randomisée contrôlée chez 346 hommes atteint d'un cancer avancé de la prostate en Afrique du sud. La population de cet essai consistait en 48% de population caucasienne, 38% de population noire et 15% de population non précisée. L'âge de ces hommes était compris entre 45 et 96 ans (moyenne 71 ans).
Les patients ont reçu soit triptoréline 11,25 mg (n=174) tous les 84 jours pour un total de 3 doses (durée maximale du traitement de 252 jours) soit 3.75 mg triptoréline (n=172) tous les 28 jours pour un total de 9 doses. Les critères d'efficacité primaires étaient l'atteinte de la castration au jour 29 et le maintien de cette castration du jour 57 au jour 253.
Les taux de testostérone sériques correspondant au niveau de castration (≤1.735 nmol/l) ont été atteints au jour 29 chez 167 des 171 patients traités avec triptoréline 11,25mg (97.7%).
Le taux de testostérone sérique correspondant au niveau de castration a été maintenu du jour 57 au jour 253 chez 94.4% des patients traités avec triptoréline 11,25mg.
PharmacocinétiqueAbsorption
Après une injection unique par voie intramusculaire de Salvacyl chez le patient atteint de cancer de la prostate, le tmax est de 2 (2-6) heures et le Cmax de 37,1 (22,4-57,4) ng/ml. Aucune accumulation n'a été observée après administrations répétées toutes les 12 semaines.
Distribution
Après une administration intraveineuse en bolus, la distribution de la triptoréline correspond à un modèle à 3 compartiments avec des demi-vies de 6 minutes, 45 minutes et 3 heures. Le volume de distribution correspond approximativement à 30 litres à l'état d'équilibre. Dans des concentrations cliniquement relevantes la triptoréline ne se lie pas aux protéines plasmatiques.
Métabolisme
Aucun métabolite de la triptoréline n'a été découvert chez l'être humain. Mais les données pharmacocinétiques humaines montrent que les fragments C-terminaux produits par destruction tissulaire sont soit entièrement détruits dans les tissus, soit rapidement définitivement détruits dans le plasma soit éliminés par les reins. L'implication des enzymes CYP450 dans le métabolisme est peu probable.
Élimination
La triptoréline est éliminée par le foie et les reins. Après injection i.v. de 0,5 mg de triptoréline, 42% de cette dose ont été éliminés dans les urines sous forme de triptoréline non métabolisée.
La clearance totale de la triptoréline est d'environ 200 ml/min et sa demi-vie terminale de 2,8 heures.
Cinétique pour certains groupes de patients
Patients âgés
L'influence de l'âge sur la pharmacocinétique de la triptoréline n'a pas été systématiquement étudiée. Les données pharmacocinétiques recueillies sur de jeunes volontaires de sexe masculin âgés de 20 à 22 ans ayant une clairance de la créatinine supraphysiologique (env. 150 ml/min) indiquent cependant que la triptoréline est éliminée deux fois plus vite chez les jeunes, ce qui est imputable au fait que la clairance de la créatinine diminue avec l'âge.
Troubles de la fonction rénale
En cas d'insuffisance rénale, la clairance de la triptoréline diminue proportionnellement à celle de la créatinine. La demi-vie était de 6,7 heures chez les patients ayant une insuffisance rénale modérée (clearance de la créatinine moyenne de 40 ml/min) et de 7,8 heures chez les patients souffrant d'insuffisance rénale grave.
Troubles de la fonction hépatique
Chez les patients adultes ayant une fonction hépatique limitée, l'AUC de la triptoréline était environ 3,7 fois plus élevée que chez des sujets sains et la demi-vie de triptoréline était de 7,65 heures. La part de triptoréline non métabolisée éliminée par les urines s'est accrue à 62% chez ces patients.
Données précliniquesLa toxicité de la triptoréline est faible. Les effets observés sont principalement liés à une exacerbation des effets pharmacologiques de la triptoréline.
Après injection sous-cutanée de 10 µg/kg à des rates aux jours 6 à 15 de la gestation (la dose clinique de 3,75 mg toutes les 4 semaines chez l'homme) la triptoréline n'a pas démontré d'embryotoxicité, de tératogénicité, ou de foetotoxicité. A 100 μg/kg par contre une diminution de l'augmentation du poids maternel et une augmentation des résorptions ont été observés.
Toxicité en cas d'administration répétée)
Aucune étude sur la fertilité chez le rat mâle n'a été effectuée; lors d'études de toxicologie chronique, la triptoréline induit à doses cliniques des changements macro et microscopiques sur l'appareil reproductif chez les rats mâles et les chiens. Ceux-ci sont considérés comme reflétant la suppression de la fonction gonadique due à l'activité pharmacologique du principe actif. Ces changements sont partiellement réversibles pendant la période de récupération.
Mutagénicité
La triptoréline n'est pas mutagène, pas plus in vitro qu'in vivo.
Carcinogénicité
Une étude de carcinogénicité conduite chez le rat pendant 23 mois, a montré une incidence de près de 100% de tumeurs pituitaires bénignes observées à chaque dose, conduisant à une mort prématurée. L'augmentation de l'incidence des tumeurs pituitaires chez le rat est un effet communément associé au traitement par les agonistes de la GnRH. La pertinence clinique de cette observation n'est pas connue.
Aucun effet oncogénique n'a été observé chez la souris à des doses de triptoréline allant jusqu'à 6000 μg/kg, après 18 mois de traitement.
Toxicité sur la reproduction
A une dose 8 fois supérieure à celle recommandée chez l'être humain (par rapport à la surface corporelle), l'expérimentation animale a montré une toxicité chez le rat pour l'organogenèse (toxicité maternelle et embryotoxicité). Des cas isolés d'hydro-uretère ont été constatés chez des jeunes rats exposés in utero à des doses élevées de triptoréline.
Remarques particulièresIncompatibilités
Aucune étude de compatibilité n'ayant été effectuée, ce médicament ne doit pas être mélangé à d'autres médicaments
Influence sur les méthodes de diagnostic
L'administration de triptoréline aux doses thérapeutiques conduit à une suppression du système hypophyso-gonadique. La fonction normale est d'habitude rétablie après l'arrêt du traitement. Des tests diagnostiques de la fonction hypophyso-gonadique conduits durant le traitement et 4 à 12 semaines après l'interruption de la thérapie avec un agoniste de la GnRH peuvent donc être erronés.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
D'un point de vue microbiologique, le produit doit être utilisé immédiatement.
Remarques particulières concernant le stockage
Ne pas conserver au-dessus de 25°C.
Ne pas congeler.
Conserver dans l'emballage d'origine.
Conserver le récipient fermé.
Conserver hors de portée des enfants.
Remarques concernant la manipulation
La préparation de la suspension pour injection doit se faire immédiatement avant l'injection.
Voir le mode d'emploi illustré en fin de document
Numéro d’autorisation58543 (Swissmedic).
PrésentationSalvacyl est délivré en 2 présentations:
·1 flacon avec poudre pour 11,25 mg de triptoréline,
·1 seringue pré-remplie contenant 2 ml de solvant.
·1 adaptateur de flacon et 1 aiguille (B)
ou
·1 flacon avec poudre pour 11,25 mg de triptoréline,
·1 ampoule contenant 2 ml de solvant,
·1 seringue et 2 aiguilles. (B)
Titulaire de l’autorisationDebiopharm Research & Manufacturing SA, 1920 Martigny
Mise à jour de l’informationAvril 2025
02-010624/11
Instructions pour la préparation de la suspension
Instructions générales et recommandations
Le produit est une suspension de microparticules:
·Le produit est une suspension de microparticules qui peuvent sédimenter dans le diluant. Le produit devrait être d'apparence homogène, épaisse et laiteuse. Si le produit sédimente dans le flacon, agiter-le à nouveau:
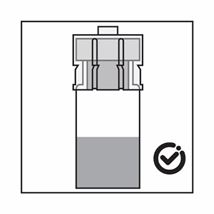
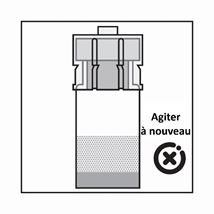
·Si les particules sédimentent dans la seringue, cela entraîne un blocage de l'aiguille lors de l'administration. Il est très important d'injecter le produit dans les 2 minutes suivant la reconstitution dans le flacon.
·Si le produit sédimente dans la seringue, reprendre un peu d'air dans la seringue, puis agiter à nouveau, et expulser l'air (sans amorcer l'aiguille) avant de l'administrer.
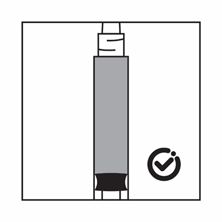
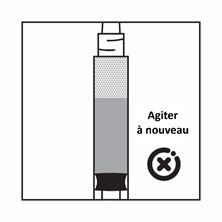
Instructions pour la préparation de la suspension de Salvacyl dans la présentation avec seringue pré-remplie de solvant
|
1
|
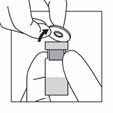
Prendre le flacon contenant la poudre.
Enlever le couvercle plastique du flacon
|
|
| |
2
|
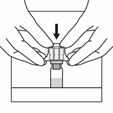
Retirer le film protecteur du système d'adaptation. Ne pas retirer l'adaptateur de flacon du blister. Déposer le flacon sur une surface plate et dure. Centrer l'adaptateur de flacon sur le bouchon du flacon et appuyer jusqu'à ce qu'un déclic se fasse entendre. Retirer et éliminer le blister.
|
|
|
| |
3
|
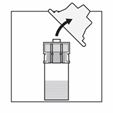
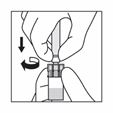
Prendre la seringue, la tenir par le connecteur (rotatif) plastique entre l'index et le pouce d'une main puis dévisser son capuchon de l'autre main.
En tenant toujours la seringue par le connecteur rotatif, l'attacher verticalement à l'adaptateur en opérant un demi-tour dans le sens des aiguilles d'une montre (seulement jusqu'à ce qu'une résistance soit resentie). Attention un serrage excessif peut entraîner une déconnexion et des fuites.
|
|
|
| |
4
|
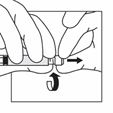
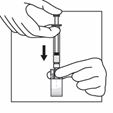
En tenant bien le flacon au niveau de l'adaptateur d'une main, pousser le piston de la seringue de l'autre main puis injecter lentement tout le contenu de la seringue dans le flacon.
A ce stade préparer le patient pour l'injection. Les étapes suivantes doivent être réalisées sans interruption.
|
|
| |
5
|
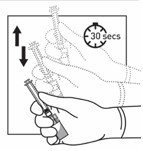
Tenir tout le dispositif (seringue + adaptateur + flacon) fermement dans la main puis agiter le vigoureusement de haut en bas pendant 30 secondes.
Vérifier l'apparence de la suspension en regardant par le fond du flacon. La suspension devrait être d'apparence homogène, épaisse et laiteuse.
Agiter le dispositif de nouveau en cas de sédimentation
Si une partie de la suspension remonte dans la seringue pendant l'agitation, pousser le piston pour remettre la suspension dans le flacon et agiter à nouveau avant de passer à l'étape suivante.
Le produit doit maintenant être injecté dans les 2 minutes.
|
|
| |
6
|
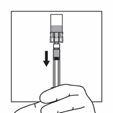
Tourner immédiatement le dispositif de sorte à ce que le flacon soit en haut et la seringue en bas et tirer doucement la tige du piston afin d'aspirer tout le contenu du flacon dans la seringue.
|
|
|
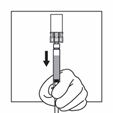
| |
7
|
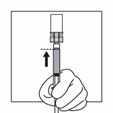
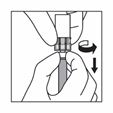
Une fois tout le contenu aspiré dans la seringue, chasser l'air de la seringue dans le flacon. S'arrêter quand la suspension arrive à la base de la tête de la seringue.
Déconnecter la seringue de l'adaptateur en tenant la seringue d'une main et de l'autre main tourner l'adaptateur dans le sens inverse des aiguilles d'une montre.
En tenant la seringue par le connecteur rotatif, attacher l'aiguille pour injection.
S'assurer que le produit est homogène, épais, laiteux et qu'il n'y a pas de sédimentation avant l'injection.
|
|
|
|
| |
8
|
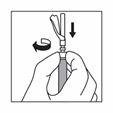
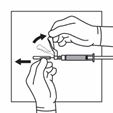
Déplacez la gaine de sécurité en arrière de l'aiguille et vers le corps de la seringue. La gaine de sécurité reste dans la position où elle a été mise.
Retirer la protection transparente de l'aiguille.
Ne pas amorcer l'aiguille avec la suspension.
La seringue contenant la suspension est maintenant prête à être administrée. La suspension doit être administrée immédiatement (moins de 2 minutes après reconstitution) pour éviter un épaississement excessif de la suspension.
|
|
|

| |
9
|
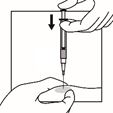
Injecter la suspension relativement rapidement et sans interruption par voie intramusculaire. Veiller à ce que toute la quantité de produit soit injectée dans les 10 secondes sans interruption.
Les sites d'injection doivent être alternés.
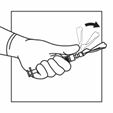
Activer le système de sécurité de l'aiguille d'injection en centrant votre pouce ou votre index sur la zone texturée de la gaine de sécurité et en le poussant vers l'avant sur l'aiguille jusqu'à ce que vous entendiez ou sentiez qu'il se verrouille. Effectuer l'operation avec une seule main et activer le mécanisme loin de vous et des autres. Jeter immédiatement la seringue dans un conteneur pour objets tranchants après une seule utilisation.
|
|
|
|
Jeter les aiguilles dans un conteneur prévu à cet effet.
A usage unique seulement. Toute suspension non utilisée doit être éliminée.
Instructions pour la préparation de la suspension de Salvacyl dans la présentation avec ampoule de solvant
|
1. Préparation de l'injection
2 aiguilles sont fournies dans le set:
·L'aiguille de reconstitution sans système de sécurité
·L'aiguille d'injection avec système de sécurité
·Tapoter la solution se trouvant éventuellement dans le sommet de l'ampoule pour la faire couler dans le réservoir principal de l'ampoule de solvant.
·Tourner l'aiguille sans système de sécurité sur la seringue (ne pas encore enlever la protection d'aiguille!).
·Casser l'ampoule de solvant (point contre soi).
| |
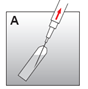
·Retirer la protection de l'aiguille de reconstitution et aspirer tout le solvant dans la seringue (fig. A).
·Mettre de côté la seringue contenant le solvant.
·Prendre le flacon contenant la poudre.
·Enlever le couvercle plastique du flacon.
|
|
| |
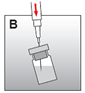
·Reprendre la seringue contenant le solvant et enfoncer l'aiguille dans le bouchon caoutchouc du flacon et injecter lentement le solvant de manière à ce qu'il coule largement sur la paroi du flacon (fig. B).
·A ce stade préparer le patient pour l'injection. Les étapes suivantes doivent être complétées sans interruption.
|
|
| |
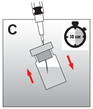
·Retirer l'aiguille en dessus du niveau du liquide et agiter vigoureusement le flacon pendant 30 secondes. La suspension doit avoir un aspect laiteux et homogène (fig. C). Vérifier qu'il ne reste pas de poudre dans le flacon, et si nécessaire continuer la mise en suspension jusqu'à disparition complète de la poudre.
Attention: le mélange ne doit pas se faire par aspirations et vidanges répétées avec la seringue!
·Le produit doit maintenant être injecté dans les 2 minutes.
|
|
| |
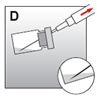
·Aspirer ensuite la totalité de la suspension pour injection dans la seringue (fig. D).
|
|
| |
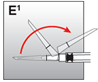
·Enlever l'aiguille de reconstitution. Tourner fermement l'aiguille à injection avec système de sécurité sur la seringue (à fond). Ne saisir que la gaine de couleur.
·Déplacez la gaine de sécurité en arrière de l'aiguille et vers le corps de la seringue (fig. E1). La gaine de sécurité reste dans la position où elle a été mise.
·Retirer la protection de l'aiguille d'injection.
·Puis administrer immédiatement l'entièreté de la seringue.
·Ne pas amorcer l'aiguille avec la suspension (fig. E2).
|
|
E2
|
| |
2. Injection
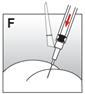
·Injecter la suspension pour injection relativement rapidement et sans interruption par voie intramusculaire (fig. F).
|
|
| |
3. Après usage
·Activer le système de sécurité de l'aiguille d'injection selon l'une des méthodes suivantes:
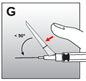
·presser d’une main sur la sécurité vers l’avant pour recouvrir l’aiguille et refermer la sécurité (fig. G). Toujours garder l’index ou le pouce derrière la pointe de l’aiguille.
Ou
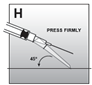
·Appuyer la sécurité dirigée vers le bas sur une surface plane, p.ex. la table, pour recouvrir l'aiguille et refermer la sécurité (fig. H).
·La sécurité de l'aiguille pour injection est refermée dès que la pointe de l'aiguille est complètement recouverte (fig. I). S'en assurer par des signes audibles, perceptibles et/ou optiques.
·Jeter les aiguilles dans un conteneur prévu à cet effet.
·A usage unique seulement. Toute suspension non utilisée doit être éliminée.
|
|
OU
|
|
|
|






























