CompositionPrincipes actifs
Souches* du virus de la grippe (inactivé, fragmenté) des types A/H1N1, A/H3N2, B/Yamagata et B/Victoria selon les recommandations annuelles de l'OMS (pour l'hémisphère nord).
*Cultivées sur œufs de poule fécondés provenant d'élevages de poulets en bonne santé.
Excipients
Chlorure de sodium, hydrogénophosphate disodique dodécahydraté, dihydrogénophosphate de potassium, chlorure de potassium, chlorure de magnésium hexahydraté, hydrogénosuccinate d'α-tocophéryle, polysorbate 80, octoxinol 10 et eau pour préparations injectables.
Résidus
Fluarix Tetra peut contenir des traces de composants d'œufs (p.ex. ovalbumine, protéines de poulet), de formaldéhyde, d'hydrocortisone, de sulfate de gentamicine et de désoxycholate de sodium, utilisés pendant le procédé de fabrication.
Une dose vaccinale contient 1,66 mg de sodium et 0,11 mg de potassium.
Indications/Possibilités d’emploiFluarix Tetra est indiqué dans l'immunisation active des adultes et des enfants à partir de 36 mois pour prévenir la grippe causée par les deux types de virus grippal A et les deux types de virus grippal B contenus dans le vaccin.
Fluarix Tetra doit être utilisé selon les recommandations officielles de vaccination.
Posologie/Mode d’emploiPosologie
·Adultes: une injection de 0,5 mL.
·Enfants à partir de 36 mois: une injection de 0,5 mL.
Les enfants de moins de 9 ans n'ayant jamais été vaccinés auparavant contre la grippe doivent recevoir une seconde dose de vaccin après un intervalle d'au moins 4 semaines.
·Enfants de moins de 36 mois: La sécurité et l'efficacité de Fluarix Tetra ne sont pas établies chez les enfants de moins de 3 ans.
Mode d'administration
Le vaccin est administré par injection intramusculaire, de préférence dans le muscle deltoïde ou dans la partie antérolatérale de la cuisse (selon la masse musculaire présente).
Contre-indicationsHypersensibilité aux principes actifs, à l'un des excipients ou à tout autre composant pouvant être présent sous forme de traces, p.ex. composants d'œufs (ovalbumine, protéines de poulet), formaldéhyde, sulfate de gentamicine ou désoxycholate de sodium.
Mises en garde et précautionsFluarix Tetra ne doit en aucun cas être administré par voie intravasculaire.
Conformément aux bonnes pratiques de vaccination, la vaccination doit être précédée d'une évaluation des antécédents médicaux (principalement en ce qui concerne les vaccinations antérieures et les éventuels effets indésirables) et d'un examen clinique.
Comme pour tous les vaccins injectables, le traitement médical et la surveillance appropriés de la personne vaccinée doivent toujours être disponibles en cas d'événement anaphylactique après l'administration du vaccin.
Comme pour d'autres vaccins, la vaccination par Fluarix Tetra doit être différée si la personne à vacciner souffre d'une maladie fébrile aiguë sévère. Une infection légère, p.ex. un refroidissement, ne doit pas conduire à un report de la vaccination.
Il est possible que la vaccination ne conduise pas à une réponse immunitaire adéquate chez les patients sous traitement immunosuppresseur et les patients immunodéprimés.
Fluarix Tetra n'est pas efficace contre toutes les souches de virus grippal éventuellement en circulation. Fluarix Tetra est destiné à protéger contre les souches de virus contenues dans le vaccin et les souches étroitement apparentées.
Comme pour tous les vaccins, il est possible qu'une réponse immunitaire protectrice ne soit pas obtenue chez toutes les personnes vaccinées.
Comme avec d'autres vaccins administrés par voie intramusculaire, Fluarix Tetra doit être administré avec prudence chez les personnes présentant une thrombocytopénie ou un trouble de la coagulation, car un saignement peut survenir chez ces sujets après une injection intramusculaire.
Une syncope (évanouissement) peut survenir après toute vaccination, voire même avant, en particulier chez les adolescents, comme réaction psychogène à l'injection. Ceci peut s'accompagner de plusieurs signes neurologiques comme un trouble transitoire de la vision, des paresthésies et des mouvements tonico-cloniques des membres durant la phase de récupération. Il est important que des mesures soient mises en place afin d'éviter des blessures en cas d'évanouissement.
Ce médicament contient moins de 1 mmol de sodium (23 mg) par dose de vaccin, c.-à-d. qu'il est essentiellement «sans sodium».
Ce médicament contient du potassium, cependant moins de 1 mmol (39 mg) par dose de vaccin, c.-à-d. qu'il est essentiellement «sans potassium».
InteractionsFluarix Tetra peut être administré en même temps que le vaccin adjuvanté contre le zona (Shingrix) (voir «Propriétés/Effets»).
La fréquence de l'épuisement, des céphalées, des myalgies, des arthralgies, des troubles gastro-intestinaux (y compris nausées, vomissements, diarrhée et/ou douleurs abdominales), des frissons chez les personnes vaccinées simultanément avec Fluarix Tetra et Shingrix est similaire à celle observée avec Shingrix seul et est plus élevée par rapport à la vaccination avec Fluarix Tetra seul.
L'administration simultanée de Fluarix Tetra et d'une dose de rappel d'un vaccin à acide ribonucléique messager (ARNm) contre la Coronavirus Disease 2019 (COVID-19) a été évaluée dans une étude menée chez des adultes (voir «Propriétés/effets»).
La fréquence des douleurs au site d'injection (de tout type) après la vaccination avec Fluarix Tetra était plus élevée dans le groupe Flu D-QIVCoAd de l'étude (48,1%) que dans le groupe Flu D-QIVSeq de l'étude (30,6%). Ces événements ont toutefois été de courte durée (1 jour) et majoritairement d'un degré de gravité léger à modéré.
La fréquence des effets indésirables annoncés chez des sujets qui avaient été vaccinés simultanément avec Fluarix Tetra et un vaccin à ARNm contre la COVID-19 est similaire à celle observée avec un vaccin à ARNm contre la COVID-19 administré seul et est plus élevée que celle relevée lors de la vaccination avec Fluarix Tetra seul.
Si Fluarix Tetra doit être administré en même temps qu'un autre vaccin injectable, les deux vaccins doivent être administrés en des sites d'injection différents.
Après une vaccination contre la grippe, des résultats faux-positifs ont été observés lors de tests sérologiques utilisant la méthode ELISA pour la détection d'anticorps dirigés contre le VIH1, le virus de l'hépatite C et surtout le HTLV1. Les réponses transitoires faussement positives pourraient être dues à la réponse IgM induite par le vaccin. Les résultats faux positifs des tests ELISA sont infirmés par la technique du Western Blot.
Grossesse, allaitementGrossesse
Après évaluation du rapport bénéfice-risque, le vaccin peut être administré aux femmes enceintes.
La sécurité d'emploi de Fluarix Tetra administré à des femmes enceintes n'a pas été évaluée dans le cadre d'essais cliniques.
Les vaccins grippaux inactivés peuvent être utilisés à tous les stades de la grossesse. De manière générale dans la littérature, les données disponibles sur la sécurité des vaccins grippaux sont plus nombreuses pour le deuxième et le troisième trimestre de la grossesse que pour le premier trimestre.
Une analyse systématique de la littérature (incluant principalement des publications épidémiologiques rétrospectives) consacrée aux vaccins inactivés contre la grippe saisonnière, ainsi que les données recueillies après la commercialisation de Fluarix Tetra et actuellement disponibles, n'indiquent dans l'ensemble pas de risque accru d'effets délétères sur l'évolution de la grossesse en cas d'administration pendant la grossesse.
En termes de toxicité, les expérimentations animales avec Fluarix Tetra ne font pas suspecter d'effets nocifs directs ou indirects sur la fertilité, la reproduction ou le développement (voir «Données précliniques»).
Allaitement
On ne dispose pas de données sur la sécurité de Fluarix Tetra chez les mères qui allaitent. On ignore si Fluarix Tetra passe dans le lait maternel.
Fluarix Tetra ne doit être utilisé pendant la période d'allaitement que si le bénéfice attendu l'emporte sur les risques éventuels.
Fertilité
On ne dispose d'aucune donnée concernant l'effet du vaccin sur la fertilité chez l'être humain.
Effet sur l’aptitude à la conduite et l’utilisation de machinesIl est improbable que le vaccin influence l'aptitude à conduire des véhicules et à utiliser des machines.
Effets indésirablesDonnées des études cliniques
Dans deux études cliniques, des adultes de 18 ans et plus et des enfants/adolescents de 3 à 17 ans ont été vaccinés soit par Fluarix Tetra (plus de 3'000 adultes et 900 enfants/adolescents), soit par Fluarix (plus de 1'000 adultes et 900 enfants/adolescents). Les effets indésirables sont survenus à une fréquence similaire sous Fluarix Tetra et Fluarix.
Dans tous les groupes d'âge, la réaction indésirable locale la plus fréquemment rapportée après la vaccination était une douleur au site d'injection (36,4% à 40,9%).
Chez les adultes de 18 ans et plus, les effets indésirables systémiques les plus fréquemment rapportés après la vaccination étaient une myalgie (11,8%), de la fatigue (11,1%) et des céphalées (9,2%).
Chez les sujets de 6 à 17 ans, les effets indésirables systémiques les plus fréquemment rapportés après la vaccination étaient de la fatigue (12,6%), une myalgie (10,9%) et des céphalées (8,0%).
Chez les sujets de 3 à 5 ans, les effets indésirables systémiques les plus fréquemment rapportés après la vaccination étaient une irritabilité (11,3%) et une somnolence (9,8%).
Les effets indésirables sont rangés par classe de système d'organes de la classification MedDRA et par fréquence selon la convention suivante: «très fréquents» (≥1/10), «fréquents» (≥1/100 à <1/10), «occasionnels» (≥1/1000 à <1/100), «rares» (≥1/10 000 à <1/1000), «très rares» (<1/10 000).
Les effets indésirables suivants ont été signalés par dose de vaccin:
Troubles du métabolisme et de la nutrition
Fréquents: perte d'appétit1.
Affections psychiatriques
Très fréquents: irritabilité1 (11,3%).
Affections du système nerveux
Fréquents: somnolence1, céphalées.
Occasionnels: vertige2.
Affections gastro-intestinales
Fréquents: symptômes gastro-intestinaux (par ex. nausées, vomissements, diarrhée et/ou douleurs abdominales).
Affections de la peau et du tissu sous-cutané
Occasionnels: éruption cutanée3.
Affections musculosquelettiques et du tissu conjonctif
Très fréquents: myalgie (jusqu'à 11,8%).
Fréquents: arthralgie.
Troubles généraux et anomalies au site d'administration
Très fréquents: douleurs au site d'injection (jusqu'à 40,9%), fatigue (jusqu'à 12,6%).
Fréquents: rougeur au site d'injection4, gonflement au site d'injection4, frissons, fièvre.
Occasionnels: hématome au site d'injection2, prurit au site d'injection.
1 rapporté comme effet indésirable chez les enfants de moins de 6 ans
2 rapporté chez des sujets adultes
3 rapporté chez des sujets de 3 à 17 ans
4 très fréquent chez les sujets de 3 à 17 ans
De plus, les effets indésirables suivants ont été rapportés dans les précédentes études avec Fluarix:
Affections de la peau et du tissu sous-cutané
Fréquents: transpiration.
Troubles généraux et anomalies au site d'administration
Fréquents: induration au site d'injection.
Effets indésirables identifiés après la mise sur le marché
Les effets indésirables suivants ont été observés pour Fluarix et/ou Fluarix Tetra après leur mise sur le marché.1
Affections hématologiques et du système lymphatique
Rares: lymphadénopathie transitoire.
Affections du système immunitaire
Rares: réactions d'hypersensibilité (y compris réactions anaphylactiques).
Affections du système nerveux
Rares: névrite, encéphalomyélite aiguë disséminée, syndrome de Guillain-Barré.
Affections de la peau et du tissu sous-cutané
Rares: urticaire, prurit, érythème, angioœdème.
Troubles généraux et anomalies au site d'administration
Rares: symptômes pseudo-grippaux, sensation de maladie.
1 Les trois souches du virus de la grippe contenues dans Fluarix sont contenues dans Fluarix Tetra.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageUn effet indésirable dû à un surdosage est improbable.
Propriétés/EffetsCode ATC
J07BB02
Mécanisme d'action
Fluarix Tetra offre une protection vaccinale active contre quatre souches de virus de la grippe (deux sous-types A et deux lignées B) contenues dans le vaccin.
Fluarix Tetra induit des anticorps humoraux contre les hémagglutinines. Ces anticorps neutralisent les virus de la grippe.
Aucune valeur seuil spécifique de titres d'anticorps inhibant l'hémagglutination (IH) n'a été établie comme étant corrélée à une protection contre la grippe après la vaccination avec des vaccins grippaux inactivés. Cependant, les titres en anticorps IH ont été utilisés comme mesure de l'activité vaccinale. Dans quelques études de provocation (études de challenge) chez l'être humain, des titres en anticorps IH ≥1:40 ont été associés à une protection contre la grippe chez jusqu'à 50% des sujets.
Pharmacodynamique
Des études cliniques menées chez des adultes (D-QIV-001 et D-QIV-008) et des enfants/adolescents de 3 à 17 ans (D-QIV-003) ont évalué la non-infériorité de Fluarix Tetra versus Fluarix en termes de moyennes géométriques des titres (MGT) en anticorps IH au jour 21 (pour les adultes) et au jour 28 (pour les enfants/adolescents) et de taux de séroconversion IH (multiplication par 4 du titre réciproque en anticorps ou passage d'un titre indétectable [< 10] à un titre réciproque ≥40).
Dans toutes les études, la réponse immunitaire induite par Fluarix Tetra contre les trois souches communes était non-inférieure à celle obtenue sous Fluarix. Contre la souche B supplémentaire contenue dans Fluarix Tetra par rapport à Fluarix, Fluarix Tetra a induit des titres en anticorps inhibant l'hémagglutination (IH) significativement plus élevés.
Adultes de 18 ans et plus
Dans l'étude clinique de phase III D-QIV-008, environ 1'800 sujets de 18 ans et plus ont reçu une dose unique de Fluarix Tetra et environ 600 sujets ont reçu une dose unique de Fluarix.
78,7% des sujets de l'étude de phase III D-QIV-008 avaient reçu un vaccin saisonnier trivalent contre la grippe au cours des trois saisons précédentes. 71,1% des sujets adultes avaient reçu un vaccin saisonnier trivalent contre la grippe au cours de la saison directement précédente (2009-2010). De plus, une immunisation précédente contre la souche pandémique A/H1N1/2009 a été établie d'après l'anamnèse chez 28,0% des sujets.
Les MGT, taux de séroconversion et taux de séroprotection suivants ont été constatés après vaccination:
|
Adultes de 18 ans et plus
|
Fluarix Tetra
N = 1'809
|
Fluarix1
N = 608
|
TIV-22
N = 534
| |
|
MGT (intervalle de confiance à 95%)
| |
A/H1N1
|
201,1 (188,1; 215,1)
|
218,4 (194,2; 245,6)
|
213,0 (187,6; 241,9)
| |
A/H3N2
|
314,7 (296,8; 333,6)
|
298,2 (268,4; 331,3)
|
340,4 (304,3; 380,9)
| |
B (Victoria)3
|
404,6 (386,6; 423,4)
|
393,8 (362,7; 427,6)
|
258,5 (234,6; 284,8)
| |
B (Yamagata)4
|
601,8 (573,3; 631,6)
|
386,6 (351,5; 425,3)
|
582,5 (534,6; 634,7)
| |
|
Taux de séroconversion (intervalle de confiance à 95%)
| |
A/H1N1
|
77,5% (75,5; 79,4)
|
77,2% (73,6; 80,5)
|
80,2% (76,5; 83,5)
| |
A/H3N2
|
71,5% (69,3; 73,5)
|
65,8% (61,9; 69,6)
|
70,0% (65,9; 73,9)
| |
B (Victoria)
|
58,1% (55,8; 60,4)
|
55,4% (51,3; 59,4)
|
47,5% (43,2; 51,9)
| |
B (Yamagata)
|
61,7% (59,5; 64,0)
|
45,6% (41,6; 49,7)
|
59,1% (54,7; 63,3)
| |
|
Taux de séroprotection5 (intervalle de confiance à 95%)
| |
A/H1N1
|
91,3% (89,9; 92,5)
|
91,8% (89,3; 93,8)
|
92,7% (90,2; 94,8)
| |
A/H3N2
|
96,8% (95,9; 97,6)
|
95,9% (94,0; 97,3)
|
96,8% (95,0; 98,1)
| |
B (Victoria)
|
98,8% (98,2; 99,3)
|
98,5% (97,2; 99,3)
|
96,1% (94,1; 97,5)
| |
B (Yamagata)
|
99,1% (98,5; 99,5)
|
97,9% (96,4; 98,9)
|
99,6% (98,7; 100)
|
1 Contient A/H1N1, A/H3N2 et B (lignée Victoria)
2 Vaccin trivalent alternatif contenant A/H1N1, A/H3N2 et B (lignée Yamagata)
3 Souche recommandée par l'OMS pour la saison grippale 2010-2011
4 Souche B supplémentaire contenue dans Fluarix Tetra recommandée pour la saison grippale 2008-2009
5 Les «taux de séroprotection» sont définis comme les pourcentages de sujets atteignant un titre en anticorps IH de 1/40 ou plus. Ces valeurs dépendent du statut sérologique des sujets avant la vaccination, des précédentes vaccinations et de variations intersaisonnières. Un titre en anticorps IH de 1/40 ou plus a été associé dans la littérature à une protection d'environ 50% contre une exposition avec des virus grippaux de type A et B.
La réponse immunitaire contre la souche B non contenue dans les différents vaccins trivalents est indiquée en italique.
Dans l'étude clinique D-QIV-001 (composition vaccinale de la saison 2007-2008), les taux de séroprotection après vaccination par Fluarix Tetra étaient de 92,3% contre A/H1N1, de 97,1% contre A/H3N2, de 97,1% contre B (Victoria) et de 98,1% contre B (Yamagata).
Enfants/Adolescents de 3 à 17 ans
Dans l'étude clinique de phase III D-QIV-003, environ 900 enfants et adolescents de 3 à 17 ans ont reçu respectivement une ou deux doses de Fluarix Tetra ou Fluarix.
Dans l'étude de phase III D-QIV-003, 36,5% des sujets âgés de 3 à 17 ans avaient reçu au moins un vaccin saisonnier trivalent contre la grippe au cours des trois saisons précédent le début de l'étude. Dans le groupe d'âge des 9-17 ans, 39,2% des sujets avaient déjà été vaccinés par le passé contre la grippe saisonnière tandis que dans le groupe d'âge des 3-8 ans environ 35% des sujets avaient reçu au moins une dose d'un vaccin saisonnier trivalent contre la grippe au cours des trois saisons précédentes.
Tous les sujets âgés de 9 à 17 ans de l'étude D-QIV-003 ont reçu une dose de Fluarix Tetra ou d'un vaccin trivalent de contrôle.
Les sujets âgés de 3 à 8 ans qui avaient été vaccinés avec au moins deux doses d'un vaccin grippal saisonnier au cours de la saison précédente ou qui avaient été vaccinés avec au moins une dose et avaient reçu au moins une dose contre la souche pandémique A/H1N1/2009 ou avaient eu une infection H1N1 confirmée par laboratoire, ont reçu une dose de Fluarix Tetra. Tous les autres sujets de ce groupe d'âge ont reçu 2 doses de Fluarix Tetra.
Les MGT, taux de séroconversion et taux de séroprotection suivants ont été constatés après vaccination:
|
Enfants/Adolescents de 3 à 17 ans
|
Fluarix Tetra
N = 791
|
Fluarix1
N = 818
|
TIV-22
N = 801
| |
|
MGT (intervalle de confiance à 95%)
| |
A/H1N1
|
386,2 (357,3; 417,4)
|
433,2 (401,0; 468,0)
|
422,3 (390,5; 456,5)
| |
A/H3N2
|
228,8 (215,0; 243,4)
|
227,3 (213,3; 242,3)
|
234,0 (219,1; 249,9)
| |
B (Victoria)3
|
244,2 (227,5; 262,1)
|
245,6 (229,2; 263,2)
|
88,4 (81,5; 95,8)
| |
B (Yamagata)4
|
569,6 (533,6; 608,1)
|
224,7 (207,9; 242,9)
|
643,3 (603,2; 686,1)
| |
|
Taux de séroconversion (intervalle de confiance à 95%)
| |
A/H1N1
|
91,4% (89,2; 93,3)
|
89,9% (87,6; 91,8)
|
91,6% (89,5; 93,5)
| |
A/H3N2
|
72,3% (69,0; 75,4)
|
70,7% (67,4; 73,8)
|
71,9% (68,6; 75,0)
| |
B (Victoria)
|
70,0% (66,7; 73,2)
|
68,5% (65,2; 71,6)
|
29,6% (26,5; 32,9)
| |
B (Yamagata)
|
72,5% (69,3; 75,6)
|
37,0% (33,7; 40,5)
|
70,8% (67,5; 73,9)
| |
|
Taux de séroprotection5 (intervalle de confiance à 95%)
| |
A/H1N1
|
96,6% (95,1; 97,7)
|
96,9% (95,5; 98,0)
|
97,1% (95,7; 98,2)
| |
A/H3N2
|
98,0% (96,7; 98,8)
|
97,8% (96,5; 98,7)
|
96,5% (95,0; 97,7)
| |
B (Victoria)
|
97,3% (96,0; 98,3)
|
96,6% (95,1; 97,7)
|
79,8% (76,8; 82,5)
| |
B (Yamagata)
|
99,2% (98,4; 99,7)
|
94,4% (92,6; 95,9)
|
99,6% (98,9; 99,9)
|
1 Contient A/H1N1, A/H3N2 et B (lignée Victoria)
2 Vaccin trivalent alternatif contenant A/H1N1, A/H3N2 et B (lignée Yamagata)
3 Souche recommandée par l'OMS pour la saison grippale 2010-2011
4 Souche B supplémentaire contenue dans Fluarix Tetra recommandée pour la saison grippale 2008-2009
5 Les «taux de séroprotection» sont définis comme les pourcentages de sujets atteignant un titre en anticorps IH de 1/40 ou plus. Ces valeurs dépendent du statut sérologique des sujets avant la vaccination, des précédentes vaccinations et de variations intersaisonnières. Un titre en anticorps IH de 1/40 ou plus a été associé dans la littérature à une protection d'environ 50% contre une exposition avec des virus grippaux de type A et B.
La réponse immunitaire contre la souche B non contenue dans les différents vaccins trivalents est indiquée en italique.
Efficacité du vaccin trivalent Fluarix contre la grippe confirmée par culture chez l'adulte de 18-64 ans (étude Fluarix-US-006)
Les données cliniques d'efficacité avec le vaccin trivalent Fluarix sont également pertinentes pour Fluarix Tetra, étant donné que les deux vaccins ont le même procédé de fabrication et que 3 sur 4 des composants viraux ont la même composition.
L'efficacité de Fluarix a été évaluée dans une étude randomisée, en double aveugle, contrôlée contre placebo et menée dans 2 pays européens pendant la saison de grippe 2006-2007. L'efficacité de Fluarix contenant les souches de virus grippal A/New Caledonia/20/1999 (H1N1), A/Wisconsin/67/2005 (H3N2) et B/Malaysia/2506/2004 était définie comme la prévention de cas de grippe A et/ou B confirmés par culture, pour les souches antigéniquement apparentées à celles du vaccin (Match) contre placebo. Des sujets en bonne santé âgés de 18 à 64 ans (âge moyen: 40 ans) ont été randomisés selon un rapport de 2:1 pour recevoir soit une vaccination par Fluarix (N = 5'103), soit un placebo (N = 2'549) et surveillés pendant environ 7 mois, commençant 2 semaines après la vaccination, pour tout développement d'un syndrome pseudo-grippal (Influenza-like Illness, ILI). 60% de la population totale étaient des femmes et 99,9% étaient caucasiens. L'évaluation des cas de grippe confirmés par culture était effectuée dans le cadre d'une surveillance active et passive de la survenue d'ILI. Le syndrome pseudo-grippal était défini comme au moins un symptôme général (fièvre ≥37,8°C et/ou myalgie) et au moins un symptôme respiratoire (toux et/ou maux de gorge). Après un épisode d'ILI, des frottis dans la cavité nasale et dans la gorge ont été effectués puis analysés. Les taux d'attaque et l'efficacité du vaccin ont été calculés.
Taux d'attaque et efficacité du vaccin contre la grippe A et/ou B confirmée par culture chez l'adulte (cohorte totale vaccinée)
|
|
Taux d'attaque (n/N)
|
Efficacité du vaccin
| |
|
N
|
N
|
%
|
%
|
LI
|
LS
| |
Souches antigéniquement apparentéesa
| |
Fluarix
|
5'103
|
49
|
1,0
|
66,9b
|
51,9
|
77,4
| |
Placebo
|
2'549
|
74
|
2,9
|
-
|
-
|
-
| |
Tous les cas de grippe confirmés par culture (apparentés, non apparentés et non typés)c
| |
Fluarix
|
5'103
|
63
|
1,2
|
61,6b
|
46,0
|
72,8
| |
Placebo
|
2'549
|
82
|
3,2
|
-
|
-
|
-
|
a Aucun cas de grippe A/New Caledonia/20/1999 (H1N1) ou B/Malaysia/2506/2004 confirmée par culture et antigéniquement apparentée au vaccin n'a été constaté sous Fluarix ou sous placebo.
b L'efficacité vaccinale de Fluarix a dépassé un seuil prédéfini de 35% pour la limite inférieure (LI) de l'intervalle de confiance bilatéral à 95%.
c Sur les 22 cas supplémentaires, 18 étaient non apparentés et 4 étaient non typés: 15 des 22 cas étaient de souche A (H3N2) (11 cas sous Fluarix et 4 cas sous placebo).
Dans une analyse exploratoire post-hoc en fonction de l'âge, l'efficacité du vaccin (contre les cas de grippe A et/ou B confirmés par culture et dus à des souches antigéniquement apparentées à celles du vaccin) chez des sujets âgés de 18 à 49 ans était de 73,4% (IC à 95%: 59,3; 82,8 [nombre de cas de grippe: Fluarix (n = 35/3'602) et placebo (n = 66/1'810)]). Chez des sujets âgés de 50 à 64 ans, l'efficacité du vaccin était de 13,8% (IC à 95%: -137,0; 66,3 [nombre de cas de grippe: Fluarix (n = 14/1'501) et placebo (n = 8/739)]). Vu que cette étude ne présentait pas une puissance statistique suffisante pour évaluer la différence d'efficacité entre les sous-groupes d'âge, la signification clinique de ces résultats est inconnue.
Efficacité du vaccin quadrivalent FluLaval contre la grippe confirmée par culture chez l'enfant de 3-8 ans (étude Q-QIV-006)
Dans une comparaison immunologique rétrospective chez des enfants de 3 à 8 ans, le vaccin antigrippal tétravalent «FluLaval Tetra» de production et de composition similaires à celles de Fluarix Tetra et fabriqué par le site de production canadien de GSK a présenté des titres absolus en anticorps et des taux de réponse au test d'IH similaires à ceux de Fluarix Tetra.
L'efficacité de FluLaval Tetra pour la prévention de la grippe A ou B chez des enfants de 3 à 8 ans a été évaluée dans l'étude clinique Q-QIV-006 en comparaison avec un groupe contrôle recevant un vaccin de l'hépatite A (Havrix) (étude réalisée dans les pays suivants: Bangladesh, République dominicaine, Honduras, Liban, Panama, Philippines, Thaïlande et Turquie). 9,8% des enfants de 3 à 8 ans inclus dans cette étude avaient déjà été immunisés par des vaccins saisonniers trivalents contre la grippe au cours des trois saisons précédentes. L'efficacité vaccinale de FluLaval Tetra contre toutes les infections grippales confirmées par PCR et associées à des symptômes infectieux de type grippal (critère primaire) était de 55,4%. Pour le critère secondaire, une réduction de 73,08% des cas modérés à sévères d'infections grippales A et B confirmées par PCR (fièvre > 39,0°C, pneumonie, bronchite, otite moyenne aiguë, dyspnée, complications cérébrales, etc.) a été observée.
Administration simultanée avec le vaccin adjuvanté contre le zona (Shingrix)
Dans le cadre de l'étude clinique Zoster-004, 828 adultes âgés de ≥50 ans ont été randomisés et ont reçu 2 doses de Shingrix à 2 mois d'intervalle, avec une dose de Fluarix Tetra, soit simultanément à la première dose (N=413), soit non simultanément (N=415). La réponse en anticorps à chacun des deux vaccins était similaire, qu'ils soient administrés ensemble ou non. En outre, les moyennes géométriques des titres d'anticorps anti-hémagglutination (HI) ont montré une non-infériorité entre l'administration simultanée et l'administration non simultanée pour les quatre souches contenues dans Fluarix Tetra.
Administration simultanée avec un vaccin à ARNm contre la COVID-19
Dans l'étude clinique ouverte, randomisée, contrôlée Zoster-091, 988 sujets adultes en bonne santé âgés de ≥18 ans ont reçu Fluarix Tetra et un vaccin de rappel monovalent à ARNm-1273 contre la COVID-19 (50 microgrammes) (souche originale de SARS-CoV-2), administrés soit simultanément (N = 498) soit non simultanément, à un intervalle de deux semaines (N = 490). La dose de rappel de vaccin ARNm contre la COVID-19 a été administrée à un intervalle minimal de 6 mois après l'immunisation de base avec deux doses. La non-infériorité immunologique entre administration simultanée et administration non simultanée a été démontrée pour les quatre souches contenues dans Fluarix Tetra en ce qui concerne les MGT des anticorps HI et pour le vaccin de rappel à ARNm-1273 contre la COVID-19 en ce qui concerne la CGM des anticorps anti-protéine S.
Efficacité clinique
Voir sous «Pharmacodynamique».
PharmacocinétiqueL'évaluation des propriétés pharmacocinétiques n'est pas requise pour les vaccins.
Absorption
Non pertinent.
Distribution
Non pertinent.
Métabolisme
Non pertinent.
Élimination
Non pertinent.
Données précliniquesLes données précliniques proviennent des études de sécurité usuelles de toxicité aigüe, de tolérance locale, de toxicité chronique et de toxicité sur les fonctions de reproduction et de développement, et ne suggèrent pas de risque particulier pour l'homme.
Remarques particulièresIncompatibilités
Des études de compatibilité n'ayant pas été effectuées, le produit ne doit pas être mélangé avec d'autres médicaments.
Stabilité
Le vaccin ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Conserver au réfrigérateur (2-8°C), à l'abri de la lumière dans l'emballage d'origine et hors de portée des enfants. Ne pas congeler!
Remarques concernant la manipulation
Le vaccin est une suspension incolore à légèrement opalescente.
Le vaccin doit être amené à température ambiante avant son utilisation.
Agiter avant l'emploi. Le vaccin doit être inspecté visuellement quant à la présence de substances étrangères et/ou de modifications physiques avant administration. Si des modifications sont observées, le vaccin doit être jeté.
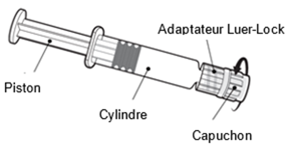
Mode d'emploi de la seringue préremplie
|
|
|
Tenez la seringue par le cylindre, pas par le piston.
Dévissez le capuchon de la seringue en le tournant dans le sens inverse des aiguilles d'une montre.
| |
|
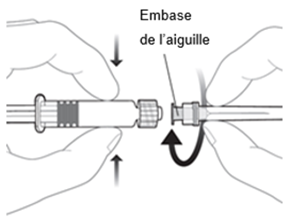
|
Pour fixer l'aiguille à la seringue, connectez l'embase de l'aiguille à l'adaptateur Luer-Lock et tournez l'aiguille d'un quart de tour dans le sens des aiguilles d'une montre jusqu'à ce que vous sentiez qu'elle s'enclenche.
Ne tirez pas le piston de la seringue hors du cylindre. Si cela se devait se produire, n'administrez pas le vaccin.
|
Les résidus de vaccin non utilisés et les déchets doivent être éliminés conformément à la réglementation locale en vigueur.
Numéro d’autorisation62961 (Swissmedic).
PrésentationEmballages de 1 ou 10 seringues préremplies (0,5 mL) avec aiguille séparée [B]
Titulaire de l’autorisationGlaxoSmithKline AG, 6340 Baar
Mise à jour de l’informationSeptembre 2023
|


