CompositionPrincipes actifs
Mercaptamine (cystéamine).
Excipients
Chlorure de benzalkonium (0,1 mg/ml solution), édétate disodique, carmellose sodique,
acide citrique monohydraté, hydroxyde de sodium (pour l’ajustement du pH), acide chlorhydrique (pour l’ajustement du pH), eau pour préparations injectables
Indications/Possibilités d’emploiCystadrops est indiqué pour le traitement des dépôts cornéens de cystine chez les adultes et les enfants de plus de 2 ans souffrant de cystinose.
Posologie/Mode d’emploiLe traitement par Cystadrops doit être initié sous la surveillance d’un médecin expérimenté dans la prise en charge de la cystinose.
Posologie
La posologie recommandée est d’une goutte dans chaque œil, 4 fois par jour lorsque le patient est éveillé. L’intervalle recommandé entre chaque instillation est de 4 heures. Cette posologie pourra être diminuée progressivement (jusqu’à une posologie minimale totale de 1 goutte par jour dans chaque œil) en fonction des examens ophtalmiques (par exemple, dépôts cornéens de cystine, photophobie).
Si le patient oublie une instillation, il doit lui être recommandé de poursuivre le traitement avec l’instillation suivante.
La posologie ne doit pas dépasser 4 gouttes par jour dans chaque œil.
L’accumulation de cristaux cornéens de cystine augmente en cas d’interruption du traitement par Cystadrops. Le traitement ne doit pas être arrêté.
Population pédiatrique
Cystadrops peut être administré aux enfants de plus de 2 ans à la même posologie que pour les adultes (voir la rubrique «efficacité et sécurité cliniques»).
La sécurité et l’efficacité de Cystadrops chez les enfants âgés de 0 à 2 ans n’ont pas été établies. Aucune donnée n’est disponible.
Mode d’administration
Pour usage ophtalmique.
Avant la première administration et pour faciliter l’administration, il faut demander au patient de laisser Cystadrops revenir à la température ambiante. Après la première ouverture, il faut demander au patient de conserver le flacon compte-goutte à la température ambiante.
Pour éviter les yeux collants le matin, il doit être recommandé au patient d’appliquer la dernière goutte de la journée au moins 30 minutes avant d’aller au lit.
Pour éviter toute contamination de l’embout compte-gouttes et de la solution, il convient de ne pas toucher les paupières, les surfaces voisines ou d’autres surfaces avec l’embout compte-gouttes du flacon compte-goutte.
Le patient doit être informé qu’il doit jeter le flacon compte-goutte après 7 jours d’utilisation.
En cas de traitement concomitant avec d’autres médicaments ophtalmiques locaux, il convient de patienter dix minutes entre les applications successives. Les pommades ophtalmiques doivent être appliquées en dernier.
Contre-indicationsHypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique «Composition, excipients».
Mises en garde et précautionsCystadrops contient du chlorure de benzalkonium.
Des irritations de l’oeil, des sécheresses oculaires et des dégradations du film lacrymal et de la surface de la cornée provoquées par le chlorure de benzalkonium ont été rapportées. Le médicament doit être utilisé avec précautions par les patients souffrant de sécheresse oculaire et par les patients présentant des lésions de la cornée.
En cas d’utilisation prolongée, une surveillance des patients doit être mise en place.
Lentilles de contact
Le chlorure de benzalkonium est connu pour colorer les lentilles de contact souples. Il convient donc d’éviter le contact avec les lentilles de contact souples. Les patients doivent retirer les lentilles de contact avant l’application du collyre et attendre au moins 15 minutes avant de les remettre.
InteractionsAucune étude d’interaction n’a été réalisée.
Dans la mesure où la posologie quotidienne totale recommandée de mercaptamine (cystéamine) base ne dépasse pas approximativement 0,4 % de la posologie maximale recommandée par voie orale de mercaptamine (cystéamine) base dans toute tranche d’âges, aucune interaction avec des médicaments administrés par voie orale n’est attendue.
Grossesse, AllaitementLa posologie ophtalmique quotidienne totale recommandée de mercaptamine (cystéamine) ne dépasse pas approximativement 0,4 % de la posologie maximale recommandée de mercaptamine administrée par voie orale dans toute tranche d’âges. En conséquence, l’exposition systémique à la mercaptamine après une administration ophtalmique est inférieure à l’exposition après une administration par voie orale. Bien qu’aucun effet pendant la grossesse et l’allaitement ne soit attendu dans la mesure où l’exposition systémique à la mercaptamine est négligeable, des mesures de précautions doivent être mises en œuvre en cas d’administration concomitante de mercaptamine par voie orale.
Grossesse
Il n’existe pas de données pertinentes sur l’utilisation de la mercaptamine (cystéamine) chez la femme enceinte. Les études effectuées chez l’animal ont mis en évidence une toxicité sur la reproduction, notamment de la tératogenèse (voir la rubrique «Données précliniques»). Les risques potentiels chez l’homme ne sont pas connus. Les effets de la cystinose non traitée sur la grossesse ne sont pas non plus connus.
C’est pourquoi la mercaptamine ne doit pas être administrée par voie orale au cours de la grossesse, en particulier pendant le premier trimestre, à moins d’une nécessité absolue.
Si une grossesse est diagnostiquée ou prévue, il faut prudemment reconsidérer le traitement et informer le patient du risque tératogène potentiel de la mercaptamine.
Allaitement
L’excrétion de la mercaptamine (cystéamine) dans le lait maternel n’est pas connue. Toutefois, compte tenu des résultats des études menées chez l’animal sur des femelles qui allaitent et des nouveau-nés (voir la rubrique «Données précliniques»), les femmes qui prennent de la mercaptamine par voie orale ne doivent pas allaiter.
Fertilité
Il n’existe pas de données sur les effets de la mercaptamine (cystéamine) sur la fertilité humaine. Les études réalisées sur les animaux ont montré une réduction de la fertilité (voir la rubrique «Données précliniques»).
Effet sur l’aptitude à la conduite et l’utilisation de machinesCystadrops peut avoir une influence mineure sur l’aptitude à conduire des véhicules et à utiliser des machines.
Une vision trouble transitoire (en moyenne moins de 1 minute) ou d’autres perturbations visuelles peuvent affecter l’aptitude à conduire ou à utiliser des machines.
En cas de vision trouble après l’instillation, le patient doit attendre que sa vision redevienne normale avant de conduire ou d’utiliser des machines.
Effets indésirablesRésumé du profil de tolérance
Les effets indésirables les plus courants sont des douleurs oculaires, une hyperémie oculaire, un prurit oculaire, une augmentation du flux lacrymal, une vision trouble ou une irritation des yeux. La majorité de ces effets indésirables sont provisoires et essentiellement légers ou modérés.
Tableau des effets indésirables
Les effets indésirables suivants ont été signalés pendant les essais cliniques et le programme d’autorisation temporaire d’utilisation (ATU) français concernant Cystadrops. Les effets indésirables observés sont indiqués ci-dessous, par classe de système organique et par fréquence (par patient).
Les fréquences sont définies comme suit : très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), occasionnel (≥ 1/1 000 à < 1/100), rare (≥ 1/10 000 à < 1/1 000), très rare (< 1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Affections oculaires
Très fréquent: douleurs oculaires, vision trouble, irritation des yeux, hyperémie oculaire, prurit oculaire, augmentation du flux lacrymal, dépôts oculaires
Fréquent: sensation anormale au niveau des yeux, sécheresse oculaire, sensation d’un corps étranger dans les yeux, œdème des paupières, irritation des paupières, déficience visuelle, orgelet
Troubles généraux et anomalies au site d’administration
Très fréquent: gêne au niveau du site d’instillation (principalement yeux collants et cils collants)
Fréquent: douleur au niveau du site d’instillation
Population pédiatrique
La fréquence, le type et la gravité des effets indésirables chez les enfants sont identiques à ceux observés chez les adultes.
69 enfants ont été suivis dans le cadre des essais cliniques et du programme d’ATU français. 19 patients avaient moins de 6 ans, 21 avaient entre 6 et 12 ans et 29 étaient âgés de 12 à 18 ans.
L’annonce d’effets secondaires présumés après l’autorisation est d’une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d’effet secondaire nouveau ou grave via le portail d’annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageL’administration ophtalmique ne devrait impliquer aucun surdosage.
En cas d’ingestion accidentelle, il convient de mettre en œuvre la surveillance et la gestion symptomatique du patient.
Propriétés/EffetsCode ATC
S01XA21
Classe pharmacothérapeutique: Médicaments ophtalmologiques, autres médicaments ophtalmologiques.
Mécanisme d’action
La mercaptamine (cystéamine) réduit l’accumulation des cristaux de cystine dans la cornée en favorisant la dissolution des cristaux de cystine par la conversion de la cystine en cystéine et en disulfures mixtes de cystéine-cystéamine.
Pharmacodynamique
Aucune information
Efficacité clinique
Cystadrops a fait l’objet de deux essais cliniques: un essai clinique portant sur un groupe unique comprenant 8 enfants et adultes (étude OCT-1), et un essai clinique de phase III, multicentrique, randomisé, comparatif et ouvert (étude CHOC) portant sur 32 patients.
Étude OCT-1
Cette étude a évalué l’efficacité et la sécurité de Cystadrops pendant 5 ans. Les posologies ont été adaptées après examen ophtalmique. Aucun des patients n’a arrêté le traitement pendant la période de suivi de 5 ans.
L’efficacité a été évaluée par le score total Microscopie confocale in-vivo (score IVCM, In-Vivo Confocal Microscopy) en quantifiant les cristaux de cystine dans les 7 couches de la cornée. Après 30 jours de traitement et une fréquence médiane de 4 instillations par jour, une diminution moyenne de 30% du score total IVCM a été observée. Une réduction moyenne de 30% des dépôts de cristaux de cystine dans la cornée par rapport à la valeur de référence s’est maintenue au fil du temps avec une posologie médiane de 3 gouttes/œil/jour (1 à 3 gouttes) chez 7 patients sur 8. Une tendance à l’amélioration de la photophobie au cours du temps a été observée.
Étude CHOC
Cette étude est un essai randomisé visant à évaluer le profil d’efficacité et de sécurité de Cystadrops (en comparaison avec le profil de chlorhydrate de mercaptamine à 0,10%) après 90 jours de traitement avec une posologie de 4 instillations par jour de 1 goutte de Cystadrops ou de chlorhydrate de mercaptamine à 0,10% dans chaque œil. Le score total IVCM est le principal critère d’évaluation de l’efficacité. 15 patients ont été exposés à Cystadrops, 17 patients se sont vu administrer du chlorhydrate de mercaptamine à 0,10%. Le score total IVCM moyen a été calculé pour 11 patients de chaque groupe (groupe traité par Cystadrops et groupe traité par chlorhydrate de mercaptamine à 0,10%). Une tendance à la baisse du score total IVCM dans le groupe traité par Cystadrops a été observée au bout de 30 jours. La diminution moyenne de 40% dans le groupe traité par Cystadrops (et la diminution moyenne de 0,7% dans le groupe traité par chlorhydrate de mercaptamine à 0,10%) a été confirmée au bout de 90 jours. La supériorité de Cystadrops a été démontrée par rapport au groupe témoin (chlorhydrate de mercaptamine 0,10 %; p < 0,001 IC 95 % [2,11; 5,58]) avec une posologie de 4 instillations par jour de 1 goutte de Cystadrops ou de chlorhydrate de mercaptamine à 0,10% dans chaque œil. La supériorité de Cystadrops a également été démontrée pour la photophobie évaluée par le médecin investigateur par rapport au groupe témoin (chlorhydrate de mercaptamine 0,10 %; p < 0,048 IC 95 % [0,23; 1,14]) avec une administration de 4 instillations par jour de Cytadrops ou de chlorhydrate de mercaptamine à 0,10%.
Sécurité et efficacité en pédiatrie
Les données cliniques sur la sécurité et l’efficacité ont été recueillies pendant les 2 essais cliniques (études OCT-1 et CHOC). Au total, 15 enfants ont été exposés au Cystadrops, dont 3 sujets (un âgé de 2 ans et un de 3 ans) avaient moins de 6 ans. Les résultats en termes d’efficacité et de sécurité sont similaires au sein des populations pédiatriques et adultes.
L’Agence européenne des médicaments a différé l’obligation de soumettre les résultats d’études réalisées avec Cystadrops dans un ou plusieurs sous-groupes de la population pédiatrique pour le traitement des dépôts de cristaux de cystine dans la cornée chez les patients souffrant de cystinose (voir la rubrique «Posologie/Mode d’emploi» pour les informations concernant l’usage pédiatrique).
PharmacocinétiqueAbsorption
La pharmacocinétique chez l’homme après l’administration ophtalmique de Cystadrops n’a pas été évaluée.
Comme pour tout autre médicament ophtalmique administré localement, une absorption systémique est probable.
Toutefois, il doit être considéré que la posologie quotidienne recommandée de mercaptamine (cystéamine) administrée sous forme de gouttes oculaires ne dépasse pas approximativement 0,4% de la posologie quotidienne maximale recommandée par voie orale de mercaptamine (cystéamine) dans toute tranche d’âges.
Distribution
Sans objet
Métabolisme
Sans objet
Élimination
Sans objet
Données précliniquesIl est attendu une exposition systémique faible après administration ophtalmique. En cas de traitement concomitant par voie orale et ophtalmique par mercaptamine (cystéamine), la contribution de l’administration ophtalmique au risque systémique est considérée négligeable.
Données précliniques sur la mercaptamine (cystéamine) administrée par voie orale:
Des études de génotoxicité ont été effectuées: l’induction d’aberrations chromosomiques dans des lignées cellulaires eucaryotes cultivées a été signalée; des études spécifiques portant sur la mercaptamine (cystéamine) n’ont montré aucun effet mutagène dans le test d’Ames ni aucun effet clastogène dans le test du micronoyau chez les souris.
Toxicité sur la reproduction
Les études sur la reproduction ont mis en évidence des effets embryo-fœtotoxiques (résorptions et avortements) chez des rates recevant une dose de mercaptamine (cystéamine) de 100 mg/kg/jour et chez des lapines recevant 50 mg/kg/jour. Des effets tératogènes ont été décrits chez le rat lorsque la mercaptamine est administrée durant la période d’organogenèse à la dose de 100 mg/kg/jour.
Cette dose équivaut chez le rat à 0,6 g/m²/jour, soit moins de la moitié de la dose d’entretien clinique recommandée de la mercaptamine, qui est de 1,30 g/m²/jour. On a observé une diminution de la fertilité chez les rats à la dose de 375 mg/kg/jour, dose à laquelle la prise de poids a été retardée. À cette dose, un retard de la prise de poids et une diminution de la survie de la progéniture pendant la période d’allaitement ont également été notés. La mercaptamine à fortes doses perturbe l’allaitement des nouveau-nés par leur mère. Des doses uniques du médicament inhibent la sécrétion de prolactine chez les animaux.
L’administration de mercaptamine à des rats nouveau-nés a entraîné l’apparition de cataractes.
L’administration de mercaptamine à fortes doses, par voie orale ou parentérale, provoque des ulcères duodénaux chez le rat et la souris, mais pas chez le singe. L’administration expérimentale du médicament entraîne la diminution de la somatostatine chez plusieurs espèces animales. Les conséquences de ce phénomène pour l’usage clinique du médicament sont inconnues.
Aucune étude de cancérogénicité n’a été réalisée avec la mercaptamine.
Remarques particulièresIncompatibilités
En l’absence d’études de compatibilité, ce médicament ne doit pas être mélangé avec d’autres médicaments.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques particulières concernant le stockage
Avant la première ouverture:
À conserver au réfrigérateur (entre 2 °C et 8 °C).
Conserver le flacon dans l’emballage extérieur à l’abri de la lumière.
Conserver hors de portée des enfants.
Stabilité après ouverture
Après la première ouverture: 7 jours. À conserver à une température ne dépassant pas 25 °C. Ne pas mettre au réfrigérateur (2°C – 8°C). Conserver le flacon compte-goutte soigneusement fermé dans l’emballage extérieur à l’abri de la lumière.
Remarques concernant la manipulation
5 ml de solution dans un flacon en verre brun de 10 ml avec bouchon en bromobutyle et scellé avec un capuchon à arracher en aluminium. Un embout compte-gouttes en PVC et un bouchon en PEHD sont emballés séparément et inclus dans chaque carton d’emballage.
Chaque carton d’emballage contient 1 flacon et 1 embout compte-gouttes.
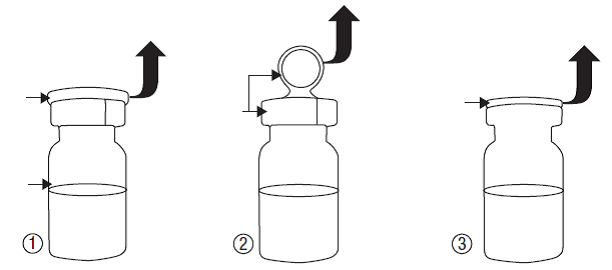
Il faut recommander au patient de suivre les instructions ci-dessous pour ouvrir le flacon et fixer l’embout compte-gouttes :
·Lavez-vous soigneusement les mains afin d’éviter la contamination microbiologique du contenu du flacon.
·Retirez le capuchon de protection vert (illustration 1).
·Retirez l’opercule métallique (illustration 2).
·Retirez le bouchon gris (illustration 3) du flacon.
·Ne touchez pas l’ouverture du flacon après avoir retiré le bouchon gris.
·Sortez le compte-gouttes de son sachet, sans toucher l’extrémité qui doit être fixée au flacon, fixez-le (illustration 4) au flacon et ne le retirez pas.
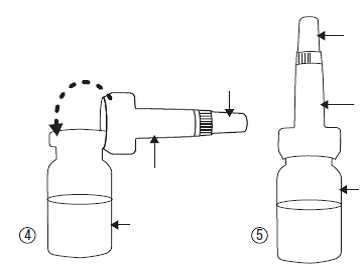
·Veillez à ne pas perdre le petit bouchon blanc (illustration 5) qui se trouve au-dessus du compte-gouttes.
Numéro d’autorisation67380 (Swissmedic).
PrésentationEmballages contenant 1 flacon de 5 ml et 1 embout compte-gouttes (B).
Titulaire de l’autorisationRecordati AG, 4057 Basel
Mise à jour de l’informationSeptembre 2020
| 

