ZusammensetzungWirkstoffe
Dupilumab, produziert mittels rekombinanter DNA-Technologie in Ovarialzellen des chinesischen Hamsters.
Hilfsstoffe
L-Histidinum, Histidini hydrochloridum monohydricum, Arginini hydrochloridum, Natrii Acetas Trihydricus, Acidum Aceticum Glaciale, Polysorbatum 80, Saccharum, Aqua ad iniectabile.
Eine Fertigspritze Dupixent 200 mg / 1,14 ml enthält 0,25 mg Natrium.
Eine Fertigspritze Dupixent 300 mg / 2 ml enthält 0,44 mg Natrium.
Ein Fertigpen Dupixent 200 mg / 1,14 ml enthält 0,25 mg Natrium.
Ein Fertigpen Dupixent 300 mg / 2 ml enthält 0,44 mg Natrium.
Indikationen/AnwendungsmöglichkeitenZur Behandlung von Kindern unter 2 Jahren ist nur die Fertigspritze indiziert (siehe «Dosierung/Anwendung» => Art der Anwendung).
Atopische Dermatitis
Dupixent wird angewendet zur Behandlung von Patienten ab 6 Monaten mit mittelschwerer bis schwerer atopischer Dermatitis, wenn eine Therapie mit verschreibungspflichtigen topischen Medikamenten keine angemessene Krankheitskontrolle ermöglicht oder nicht empfohlen wird.
Dupixent kann mit oder ohne topische Kortikosteroide verwendet werden.
Asthma
Dupixent ist angezeigt als Add-on-Erhaltungstherapie bei Erwachsenen und Kindern (ab 6 Jahren) mit schwerem Asthma, das folgenden Kriterien entspricht:
·Anzahl der Eosinophilen im Blut ≥0,15 G/Liter (≥150 Zellen/µl), unzureichende Asthma-Kontrolle und mindestens eine schwere Exazerbation in den letzten 12 Monaten trotz begleitender Behandlung mit inhalativen Kortikosteroiden und lang wirksamen Bronchodilatatoren;
·oder erforderliche Dauerbehandlung mit systemischen Kortikosteroiden.
Ausführliche Angaben zu den untersuchten Patientenpopulationen: siehe «Klinische Wirksamkeit».
Chronische Rhinosinusitis mit Nasenpolypen (CRSwNP)
Dupixent ist indiziert als Add-on-Therapie mit intranasalen Kortikosteroiden bei Erwachsenen mit schwerer CRSwNP, die mit systemischen Kortikosteroiden und/oder operativem Eingriff nicht ausreichend kontrolliert werden kann.
Prurigo nodularis (PN)
Dupixent ist indiziert zur Behandlung von mittelschwerer bis schwerer Prurigo nodularis (PN) bei Erwachsenen, deren Erkrankung mit verschreibungspflichtigen topischen Therapien nicht ausreichend kontrolliert werden kann oder wenn derartige Behandlungen nicht empfohlen werden.
Dupixent kann mit oder ohne topische Kortikosteroide angewendet werden.
Eosinophile Ösophagitis
Dupixent ist indiziert zur Behandlung von eosinophiler Ösophagitis (EoE) bei Patienten ab einem Jahr mit einem Körpergewicht von mindestens 15 kg, die mit einer konventionellen medikamentösen Therapie unzureichend therapiert sind, diese nicht vertragen oder für die eine solche Therapie nicht in Betracht kommt.
Ausführliche Angaben zu den untersuchten Patientenpopulationen: siehe «Klinische Wirksamkeit»
Chronisch obstruktive Lungenerkrankung
Dupixent ist indiziert als Add-on-Erhaltungstherapie bei erwachsenen Patienten mit durch eine erhöhte Anzahl an Eosinophilen im Blut gekennzeichneter chronisch obstruktiver Lungenerkrankung (COPD), die trotz einer Kombinationstherapie aus einem inhalativen Kortikosteroid (ICS), einem langwirksamen Beta-2-Agonisten (LABA) und einem langwirksamen Muskarinantagonisten (LAMA) oder, falls ICS nicht angebracht ist, einer Kombinationstherapie aus LABA und LAMA unzureichend kontrolliert ist. Ausführliche Angaben zu den untersuchten Patientenpopulationen: siehe «Klinische Wirksamkeit».
Dosierung/AnwendungDie Behandlung ist durch medizinisches Fachpersonal einzuleiten, das in der Diagnose und Behandlung von Erkrankungen, bei denen Dupilumab indiziert ist (siehe «Indikationen/Anwendungsmöglichkeiten»), erfahren ist.
Um die Rückverfolgbarkeit von biotechnologisch hergestellten Arzneimitteln sicherzustellen, wird empfohlen Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.
Atopische Dermatitis
Erwachsene:
Die empfohlene Dosierung von Dupilumab bei Erwachsenen ist eine Anfangsdosis von 600 mg als subkutane Injektion (zwei Injektionen zu je 300 mg), gefolgt von einer Dosis von 300 mg als subkutane Injektion alle zwei Wochen.
Kinder und Jugendliche (6 bis 17 Jahre):
Die empfohlene Dosierung für Dupilumab bei Kindern und Jugendlichen von 6 bis 17 Jahren ist in der Tabelle 1 unten angegeben.
Tabelle 1: Dosierungsschema Dupilumab zur subkutanen Anwendung bei Kindern und Jugendlichen von 6 bis 17 Jahren mit atopischer Dermatitis
|
Körpergewicht des Patienten
|
Anfangsdosis
|
Folgedosen
| |
15 kg bis < 30 kg
|
300 mg (eine Injektion zu 300 mg) an Tag 1,
gefolgt von 300 mg an Tag 15
|
300 mg
(alle vier Wochen),
beginnend vier Wochen nach der Dosis von Tag 15
| |
30 kg bis < 60 kg
|
400 mg
(zwei Injektionen zu je 200 mg)
|
200 mg
(alle zwei Wochen)
| |
ab 60 kg
|
600 mg
(zwei Injektionen zu je 300 mg)
|
300 mg
(alle zwei Wochen)
|
Kinder (6 Monate – 5 Jahre):
Die empfohlene Dosierung für Dupilumab bei Kindern von 6 Monaten bis 5 Jahren ist in der Tabelle 2 unten angegeben.
Tabelle 2: Dosierungsschema Dupilumab zur subkutanen Anwendung bei Kindern von 6 Monaten bis 5 Jahren mit atopischer Dermatitis
|
Körpergewicht des Patienten
|
Anfangsdosis
|
Folgedosen
| |
5 kg bis < 15 kg
|
200 mg (eine Injektion zu 200 mg)
|
200 mg
(alle vier Wochen)
| |
15 kg bis < 30 kg
|
300 mg
(eine Injektion zu 300 mg)
|
300 mg
(alle vier Wochen)
|
Die Dosierungsempfehlungen für Kinder mit einem Gewicht unter 7,4 kg basieren auf pharmakokinetischen Simulationen.
Dupilumab kann mit oder ohne topische Kortikosteroide verwendet werden. Die Anwendung topischer Calcineurin-Inhibitoren ist möglich, muss aber auf Problemzonen wie Gesicht, Hals, intertriginöse Bereiche und den Genitalbereich beschränkt bleiben.
Bei Patienten, die nach 16 Wochen nicht auf die Behandlung ansprechen, ist ein Abbruch der Behandlung in Betracht zu ziehen.
Asthma
Erwachsene und Jugendliche:
Die empfohlene Dosis für Dupilumab beträgt bei Erwachsenen und Jugendlichen (ab 12 Jahren):
·bei Patienten mit schwerem Asthma, das mit inhalativen Kortikosteroiden und lang wirksamen Bronchodilatatoren behandelt wird: 400 mg (in zwei Injektionen zu je 200 mg) als Anfangsdosis, gefolgt von 200 mg alle zwei Wochen als subkutane Injektion.
·bei schwerem Asthma, das mit oralen Kortikosteroiden behandelt wird, oder schwerem Asthma und komorbider mittelschwerer bis schwerer atopischer Dermatitis oder komorbider chronischer Rhinosinusitis mit Nasenpolypen nach der genehmigten Indikation: 600 mg (in zwei Injektionen zu je 300 mg) als Anfangsdosis, gefolgt von 300 mg alle zwei Wochen als subkutane Injektion.
Kinder (6 bis 11 Jahre):
Die empfohlene Dosierung für Dupilumab bei Kindern von 6 bis 11 Jahren ist in Tabelle 3 unten angegeben.
Tabelle 3: Dosierungsschema Dupilumab zur subkutanen Anwendung bei Kindern von 6 bis 11 Jahren mit Asthma
|
Körpergewicht des Patienten
|
Anfangsdosis und Folgedosen
| |
15 kg bis < 30 kg
|
300 mg alle vier Wochen
| |
30 kg bis < 60 kg
|
200 mg alle zwei Wochen
oder
300 mg alle vier Wochen
| |
ab 60 kg
|
200 mg alle zwei Wochen
|
Bei Kindern (6 bis 11 Jahre) mit schwerem Asthma und mittelschwerer bis schwerer atopischer Dermatitis sollte entsprechend der zugelassenen Indikation die in Tabelle 4 empfohlene Dosis verwendet werden.
Tabelle 4: Dosierungsschema Dupilumab zur subkutanen Anwendung bei Kindern und Jugendlichen von 6 bis 11 Jahren mit Asthma und atopischer Dermatitis
|
Körpergewicht des Patienten
|
Anfangsdosis
|
Folgedosen
| |
15 kg bis < 30 kg
|
600 mg
(zwei Injektionen zu je 300 mg)
|
300 mg
(alle vier Wochen)
| |
30 kg bis < 60 kg
|
400 mg
(zwei Injektionen zu je 200 mg)
|
200 mg
(alle zwei Wochen)
| |
ab 60 kg
|
600 mg
(zwei Injektionen zu je 300 mg)
|
300 mg
(alle zwei Wochen)
|
Patienten, die gleichzeitig auf orale Kortikosteroide eingestellt sind, können ihre Kortikoiddosis verringern, sobald es unter Dupilumab zu einer klinischen Verbesserung gekommen ist. Die Kortikoiddosis ist schrittweise zu verringern.
Dupilumab ist für die Langzeitbehandlung bestimmt. Die Notwendigkeit einer Fortsetzung der Therapie sollte mindestens einmal im Jahr beurteilt werden, beruhend auf einer ärztlichen Einschätzung der Asthmakontrolle des Patienten.
Chronische Rhinosinusitis mit Nasenpolypen (CRSwNP)
Die empfohlene Dosierung für Dupilumab bei erwachsenen Patienten ist eine Anfangsdosis von 300 mg, gefolgt von 300 mg alle zwei Wochen.
Dupilumab ist für die Langzeitbehandlung bestimmt. Bei Patienten, die nach 24 Wochen nicht auf die Behandlung der CRSwNP ansprechen, ist eine Beendigung der Behandlung in Betracht zu ziehen. Einige Patienten mit einem anfänglich partiellen Ansprechen können von einer über 24 Wochen hinaus fortgeführten Behandlung profitieren.
Prurigo nodularis (PN)
Die empfohlene Dosierung von Dupilumab bei Erwachsenen ist eine Anfangsdosis von 600 mg (zwei Injektionen zu je 300 mg), gefolgt von 300 mg alle zwei Wochen.
Dupilumab kann mit oder ohne topische Kortikosteroide angewendet werden. Aus klinischen Studien zu Prurigo nodularis liegen Daten von Patienten vor, die bis zu 24 Wochen behandelt wurden. Bei Patienten, die nach 24 Wochen nicht auf die Behandlung der PN ansprechen, sollte eine Beendigung der Behandlung in Betracht gezogen werden.
Eosinophile Ösophagitis (EoE)
Erwachsene und pädiatrische Patienten ab einem Jahr und mit einem Körpergewicht von mindestens 15 kg
Die empfohlene Dosis von Dupilumab bei Erwachsenen und Kindern ab einem Jahr und einem Körpergewicht von mindestens 15 kg ist in der Tabelle 5 angegeben.
Tabelle 5: Dosierungsschema von Dupilumab zur subkutanen Anwendung bei Erwachsenen und pädiatrischen Patienten ab einem Jahr mit EoE.
|
Körpergewicht des Patienten
|
Dosis
| |
15 kg bis < 30 kg
|
200 mg alle zwei Wochen
| |
30 kg bis < 40 kg
|
300 mg alle zwei Wochen
| |
ab 40 kg
|
300 mg wöchentlich
|
Dupilumab ist für die Langzeitbehandlung bestimmt. Die Gabe von Dupilumab zur Behandlung von eosinophiler Ösophagitis über 52 Wochen hinaus wurde nicht untersucht.
Chronisch obstruktive Lungenerkrankung
Die empfohlene Dosierung von Dupilumab bei Erwachsenen entspricht einer Dosis von 300 mg Dupilumab alle zwei Wochen.
Dupilumab ist für die Langzeitbehandlung vorgesehen. Die Verabreichung über 52 Wochen hinaus wurde nicht untersucht.
Versäumte Dosis (bei allen Indikationen):
Falls eine wöchentlich zu verabreichende Dosis versäumt wird, ist diese so schnell wie möglich nachzuholen. Basierend auf dem Datum dieser Dosisgabe ist ein neuer Anwendungszeitplan zu erstellen.
Falls eine zweiwöchentlich zu verabreichende Dosis versäumt wird, ist die Injektion innerhalb von 7 Tagen nach der versäumten Dosis nachzuholen. Danach kann mit dem ursprünglichen Anwendungszeitplan des Patienten fortgefahren werden. Wird die versäumte Dosis nicht innerhalb von 7 Tagen nachgeholt, muss bis zur im ursprünglichen Anwendungszeitplan festgelegten nächsten Dosis gewartet werden.
Falls eine vierwöchentlich zu verabreichende Dosis versäumt wird, ist die Injektion innerhalb von 7 Tagen nach der versäumten Dosis nachzuholen. Danach kann mit dem ursprünglichen Anwendungszeitplan des Patienten fortgefahren werden. Wird die versäumte Dosis später als 7 Tage nachgeholt, ist basierend auf dem Datum dieser Dosisgabe ein neuer Anwendungszeitplan zu erstellen.
Spezielle Dosierungsanweisungen:
Patienten mit Leberfunktionsstörungen
Es liegen keine Daten für Patienten mit einer Einschränkung der Leberfunktion vor (siehe «Pharmakokinetik»).
Patienten mit Nierenfunktionsstörungen
Bei Patienten mit leichter oder mittelschwerer Niereninsuffizienz ist keine Dosisanpassung erforderlich. Zu Patienten mit einer schweren Niereninsuffizienz liegen nur sehr begrenzte Daten vor (siehe «Pharmakokinetik»).
Ältere Patienten (≥65 Jahre)
Bei älteren Patienten ist keine Dosisanpassung erforderlich (siehe «Pharmakokinetik»).
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Dupilumab zur Behandlung von atopischer Dermatitis bei Kindern unter 6 Monaten mit atopischer Dermatitis ist bisher nicht nachgewiesen. Die Sicherheit und Wirksamkeit von Dupilumab bei Kindern mit einem Körpergewicht < 7,4 kg ist bisher nicht nachgewiesen.
Es liegen keine Daten vor.
Die Sicherheit und Wirksamkeit von Dupilumab bei Kindern unter 6 Jahren mit schwerem Asthma ist bisher nicht nachgewiesen. Es liegen keine Daten vor.
CRSwNP tritt normalerweise nicht bei Kindern auf.
Die Sicherheit und Wirksamkeit bei Kindern unter 18 Jahren mit CRSwNP ist nicht erwiesen (siehe «Eigenschaften/Wirkungen»).
Es liegen keine Daten vor.
Die Sicherheit und Wirksamkeit von Dupilumab bei Kindern unter 18 Jahren mit Prurigo nodularis sind nicht erwiesen. Es liegen keine Daten vor.
Die Sicherheit und Wirksamkeit von Dupilumab bei Kindern unter einem Jahr mit eosinophiler Ösophagitis sind nicht erwiesen.
COPD tritt bei Kindern normalerweise nicht auf. Die Sicherheit und Wirksamkeit bei pädiatrischen Patienten mit COPD unter 18 Jahren wurde bisher nicht nachgewiesen (siehe «Eigenschaften/Wirkungen».
Körpergewicht
Bei Patienten im Alter ab 12 Jahren mit Asthma und Erwachsenen mit atopischer Dermatitis, CRSwNP, Prurigo nodularis oder COPD wird keine körpergewichtsbezogene Dosisanpassung empfohlen.
Bei Patienten im Alter von 6 bis 17 Jahren mit atopischer Dermatitis beträgt die empfohlene Dosis 300 mg alle 4 Wochen (15 kg bis < 30 kg), 200 mg alle 2 Wochen (30 kg bis < 60 kg) oder 300 mg alle 2 Wochen (≥60 kg).
Bei Patienten im Alter von 6 Monaten bis 5 Jahren mit atopischer Dermatitis beträgt die empfohlene Dosis 200 mg alle 4 Wochen (5 kg bis < 15 kg) und 300 mg alle 4 Wochen (15 kg bis < 30 kg).
Bei Patienten von 6 bis 11 Jahren mit Asthma betragen die empfohlenen Dosen 300 mg alle 4 Wochen (≥15 kg bis < 30 kg), 200 mg alle 2 Wochen oder 300 mg alle 4 Wochen (≥30 kg bis < 60 kg) und 200 mg alle 2 Wochen (≥60 kg).
Die empfohlene Dosierung für Patienten ab einem Jahr mit eosinophiler Ösophagitis ist 200 mg alle zwei Wochen (15 bis < 30 kg), 300 mg alle zwei Wochen (30 bis < 40 kg) und 300 mg wöchentlich (≥40 kg).
Art der Anwendung
Subkutane Anwendung.
Betreffend die Anwendung des Fertigpens: Die Patienten sollten angewiesen werden, die Gebrauchsanweisung zu lesen, zu befolgen und darauf zu achten, dass sie den gesamten Inhalt des Fertigpens injizieren. Die Injektion kann bis zu 20 Sekunden dauern.
Der Fertigpen mit Dupilumab ist für Erwachsene und Kinder ab 2 Jahren bestimmt. Die Fertigspritze mit Dupilumab ist für Erwachsene und Kinder ab 6 Monaten bestimmt. Der Fertigpen mit Dupilumab ist nicht für die Anwendung bei Kindern unter 2 Jahren bestimmt.
Dupilumab wird subkutan in den Oberschenkel oder das Abdomen ausserhalb eines Umkreises von 5 cm um den Bauchnabel herum injiziert. Falls die Injektion durch eine andere Person erfolgt, kommt als Injektionsstelle auch der Oberarm infrage.
Die Anfangsdosis von (400 mg oder 600 mg je nach Indikation) ist in Form von zwei konsekutiven Injektionen zu je 200 mg oder 300 mg Dupilumab (je nach Indikation) an zwei unterschiedlichen Injektionsstellen zu verabreichen.
Die Einstichstelle muss bei jeder Injektion gewechselt werden. Dupilumab darf nicht an Stellen injiziert werden, an denen die Haut empfindlich oder verletzt ist oder Ekchymosen oder Narben vorliegen.
Dupilumab kann durch den Patienten selbst oder durch eine Pflegeperson injiziert werden, wenn das medizinische Fachpersonal dies als angemessen erachtet. Vor der Anwendung sind der Patient und/oder die Pflegepersonen gemäss den Hinweisen zur Anwendung in der Packungsbeilage in der Vorbereitung und Verabreichung von Dupilumab zu unterweisen.
Bei Jugendlichen (12–17 Jahre) wird empfohlen, dass Dupixent von oder unter Aufsicht eines Erwachsenen verabreicht wird.
Bei Kindern von 6 Monaten bis unter 12 Jahren ist Dupilumab durch eine Pflegeperson zu verabreichen.
Wie bei allen selbst verabreichten Therapeutika muss der Arzt / die Ärztin die Einhaltung der Behandlung durch den Patienten sorgfältig überwachen. In klinischen Phase-III-Studien vergassen Patienten, die sich die Injektionen selbst verabreichten, etwa ein Sechstel der Dosen. Dabei wurden 17,5 % der Dosen Dupilumab und 26,2 % der Placebo-Dosen versäumt.
Weitere Informationen zur Verabreichung dieses Arzneimittels sind unter «Hinweise für die Handhabung» zu entnehmen.
KontraindikationenÜberempfindlichkeit gegen den Wirkstoff oder einen unter «Zusammensetzung» genannten Hilfsstoffe.
Warnhinweise und VorsichtsmassnahmenAkute Symptome von Asthma oder der chronisch obstruktiven Lungenerkrankung oder akute Verschlechterung der Krankheit
Dupilumab darf nicht zur Behandlung von akuten Asthma- oder COPD-Symptomen oder akuten Exazerbationen angewendet werden. Dupilumab darf nicht zur Behandlung von akutem Bronchospasmus oder Status asthmaticus angewendet werden.
Verringerung der Kortikosteroiddosis
Systemische, topische oder inhalative Kortikosteroide dürfen nach Einleitung der Therapie mit Dupilumab nicht abrupt abgesetzt werden. Eine Verringerung der Kortikosteroiddosis, sofern angemessen, sollte schrittweise unter ärztlicher Aufsicht erfolgen. Eine solche Dosisreduktion kann mit systemischen Entzugssymptomen einhergehen und/oder Krankheiten demaskieren, die zuvor durch die systemische Kortikosteroidtherapie unterdrückt wurden.
Die Expression von Biomarkern der Typ-2-Inflammation kann durch systemische Kortikosteroide unterdrückt werden. Dies sollte bei der Bestimmung des Typ-2-Status bei Patienten, die auf orale Kortikosteroide eingestellt sind, berücksichtigt werden (siehe «Eigenschaften/Wirkungen»).
Überempfindlichkeitsreaktionen:
Bei einer (unmittelbaren oder verzögerten) allgemeinen systemischen Überempfindlichkeitsreaktion ist die Anwendung von Dupilumab sofort zu unterbrechen und eine geeignete Behandlung einzuleiten.
Es wurde über Überempfindlichkeitsreaktionen einschliesslich Anaphylaxie, Serumkrankheit oder serumkrankheitsähnliche Symptome und Angioödem berichtet (siehe «Unerwünschte Wirkungen»).
Hypereosinophilie:
Bei Patienten, die mit Dupilumab behandelt wurden, wurden Fälle von eosinophiler Pneumonie sowie Vaskulitis, die mit einer eosinophilen Granulomatose mit Polyangiitis (EGPA) verbunden sind, berichtet. Die berichteten Fälle traten tendenziell bei Patienten mit Asthma oder CRSwNP mit komorbidem Asthma auf. Diese Patienten werden häufig mit oralen Kortikosteroiden behandelt und das Auftreten dieser Ereignisse kann mit der Reduzierung oder dem Absetzen der oralen Kortikosteroidbehandlung in Zusammenhang stehen. Patienten, die mit Dupilumab behandelt werden, können mit schwerwiegender systemischer Hypereosinophilie vorstellig werden. Bei Patienten mit Hypereosinophilie sollten Ärzte besonders auf das Auftreten von vaskulitischem Hautausschlag, einer Verschlechterung der Lungensymptomatik, Herzkomplikationen und/oder Neuropathie achten.
Helminthose:
Patienten mit einer bekannten Helminthose wurden von den klinischen Studien ausgeschlossen. Dupilumab kann durch Hemmung der IL-4/IL-13-Signalwege die Immunreaktion auf eine Helminthose beeinflussen. Patienten mit einer vorbestehenden Helminthose sind zu behandeln, bevor die Behandlung mit Dupilumab eingeleitet wird. Wenn der Patient sich während der Behandlung mit Dupilumab infiziert und nicht auf eine Behandlung gegen Helminthose anspricht, muss die Behandlung mit Dupilumab ausgesetzt werden, bis die Infektion abgeklungen ist. Bei Kindern von 6 bis 11 Jahren, die am pädiatrischen Entwicklungsprogramm für Asthma teilnahmen, wurden Fälle von Enterobiasis berichtet (siehe «Unerwünschte Wirkungen»).
Ereignisse im Zusammenhang mit Konjunktivitis und Keratitis:
Bei Patienten mit atopischer Dermatitis wurde über Konjunktivitis und Keratitis mit Dupixent berichtet.
Einige Patienten haben über Sehstörungen (z.B. verschwommenes Sehen) im Zusammenhang mit Konjunktivitis oder Keratitis berichtet (siehe «Unerwünschte Wirkungen»). Die Patienten und die Personen, die kleine Kinder betreuen, müssen ihrem Arzt / ihrer Ärztin alle neu auftretenden oder sich verschlimmernden Augensymptome mitteilen.
Patienten, einschliesslich Säuglinge und Kleinkinder, die unter der Behandlung mit Dupilumab eine Konjunktivitis entwickeln, die nach der Standardbehandlung nicht abklingt oder die Anzeichen einer Keratitis entwickeln, sollten sich gegebenenfalls einer ophthalmologischen Untersuchung unterziehen (siehe «Unerwünschte Wirkungen»).
Patienten mit komorbidem Asthma:
Patienten, die mit Dupilumab behandelt werden und die gleichzeitig ein komorbides Asthma aufweisen, dürfen ihre Asthma-Behandlung ohne vorherige Absprache mit ihrem Arzt / ihrer Ärztin nicht anpassen oder absetzen.
Asthmapatienten sind nach dem Absetzen der Behandlung mit Dupilumab sorgfältig zu überwachen.
Impfungen
Lebendimpfstoffe und attenuierte Lebendimpfstoffe dürfen nicht zeitgleich mit Dupilumab angewendet werden, da die klinische Sicherheit und Wirksamkeit nicht erwiesen wurden. Die Immunantworten auf TdaP- und Meningokokken-Polysaccharid-Impfstoff wurden untersucht. Es wird empfohlen, vor der Behandlung mit Dupilumab den Impfstatus von Patienten hinsichtlich Impfungen mit Lebendimpfstoffen und attenuierten Lebendimpfstoffen entsprechend den aktuellen Impfempfehlungen auf den neuesten Stand zu bringen (siehe «Interaktionen»).
Hilfsstoffe:
Dieses Arzneimittel enthält weniger als 1 mmol (23 mg) Natrium pro 300-mg- und pro 200-mg-Dosis, d.h., es ist nahezu «natriumfrei».
InteraktionenPharmakokinetische Interaktionen
In-vivo-Daten
Interaktionen mit CYP-Substraten:
Atopische Dermatitis: Die Auswirkungen von Dupilumab auf die Pharmakokinetik von CYP-Substraten wurden im Rahmen einer klinischen Studie an Patienten mit atopischer Dermatitis untersucht. Die aus dieser Studie gewonnenen Daten zeigen keine klinisch relevanten Auswirkungen von Dupilumab auf die Aktivität von CYP1A2, CYP3A4, CYP2C19, CYP2D6 oder CYP2C9.
Asthma: Es ist nicht damit zu rechnen, dass sich Dupilumab auf die PK gleichzeitig verabreichter Arzneimittel auswirkt. Die Populationsanalysen ergaben keine Auswirkungen auf die Pharmakokinetik von Dupilumab bei Patienten mit mittelschwerem bis schwerem Asthma.
Andere Interaktionen
Impfungen:
Die Sicherheit und Wirksamkeit der gleichzeitigen Anwendung von Dupilumab und Lebendimpfstoffen wurden nicht untersucht. Die Anwendung von Lebendimpfstoffen bei Patienten, die mit Dupilumab behandelt werden, ist zu vermeiden. Es wird empfohlen, vor der Behandlung mit Dupilumab den Impfstatus von Patienten hinsichtlich Impfungen mit Lebendimpfstoffen und attenuierten Lebendimpfstoffen entsprechend den aktuellen Impfempfehlungen auf den neuesten Stand zu bringen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Inaktivierte Impfstoffe: Die Immunreaktionen auf eine Impfung wurden in einer Studie untersucht, in der erwachsene Studienteilnehmer mit atopischer Dermatitis 16 Wochen lang einmal wöchentlich mit 300 mg Dupilumab behandelt wurden (dies entspricht dem Doppelten der empfohlenen Dosierungsfrequenz). Nach einer zwölfwöchigen Anwendung von Dupilumab wurden die Patienten mit einem Tdap-Impfstoff (Adacel®) und einem Meningokokken-Polysaccharid-Impfstoff (Menomune®) geimpft. Vier Wochen später wurden die Antikörperreaktionen auf das Tetanustoxoid und den Polysaccharid-Impfstoff gegen Meningokokken der Serogruppe C beurteilt. Die humorale Immunantwort auf den Tetanus-Impfstoff und auf den Meningokokken-Polysaccharid-Impfstoff war bei Patienten, die Dupilumab erhielten, ähnlich wie bei Placebo-Patienten. Die Immunreaktionen auf die anderen Wirkstoffe der Impfstoffe Adacel® und Menomune® wurden nicht untersucht.
Schwangerschaft, StillzeitSchwangerschaft
Es gibt nur wenige Daten zur Anwendung von Dupilumab bei Schwangeren.
Tierexperimentelle Studien ergaben hinsichtlich der Reproduktionstoxizität keine Hinweise auf direkte oder indirekte gesundheitsschädliche Wirkungen (siehe «Präklinische Daten»). Dupilumab darf während der Schwangerschaft nicht angewendet werden, es sei denn, der potenzielle Nutzen übersteigt das potenzielle Risiko für den Fötus.
Stillzeit
Es ist nicht bekannt, ob Dupilumab in die Muttermilch übergeht oder ob es nach der Einnahme systemisch resorbiert wird. Es muss eine Entscheidung getroffen werden, ob das Stillen oder die Behandlung mit Dupilumab unterbrochen werden soll. Dabei ist der Nutzen des Stillens für das Kind gegen den Nutzen der Therapie für die Mutter abzuwägen.
Fertilität
In tierexperimentellen Studien wurde keine Beeinträchtigung der Fertilität nachgewiesen (siehe «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenDie Auswirkungen von Dupilumab auf die Fahrtüchtigkeit oder das Bedienen von Maschinen wurden nicht direkt untersucht.
Unerwünschte Wirkungen1) Atopische Dermatitis
Zusammenfassung des Sicherheitsprofils
Die häufigsten unerwünschten Nebenwirkungen waren Reaktionen an der Injektionsstelle, Konjunktivitis, Herpes labialis und sonstige Infektionen mit Herpes-Simplex-Viren (Herpes-Ekzem ausgenommen), Eosinophilie und Kopfschmerzen. Im Entwicklungsprogramm zu atopischer Dermatitis wurde nach der Anwendung von Dupilumab in seltenen Fällen über Serumkrankheit oder serumkrankheitsähnliche Symptome berichtet (siehe «Warnhinweise und Vorsichtsmassnahmen»).
In den Studien zur Anwendung von Dupilumab in Monotherapie bei Erwachsenen lag der Anteil der Patienten, die die Behandlung aufgrund unerwünschter Wirkungen abbrachen, in der Placebo-Gruppe bei 1,9 %, in der Gruppe, die alle zwei Wochen (Q2W) 300 mg Dupilumab erhielt, bei 1,9 %, und in der Gruppe, die einmal wöchentlich 300 mg Dupilumab erhielt, bei 1,5 %.
In der Studie mit gleichzeitiger Anwendung topischer Kortikosteroide (TCS) bei Erwachsenen lag der Anteil der Patienten, die die Behandlung aufgrund unerwünschter Wirkungen abbrachen, in der Gruppe Placebo + TCS bei 7,6 %, in der Gruppe, die 300 mg Dupilumab Q2W + TCS erhielt, bei 1,8 %, und in der Gruppe, die 300 mg Dupilumab QW + TCS erhielt, bei 2,9 %.
In einer multizentrischen, offenen Phase-III-Verlängerungsstudie (OLE, AD-1225) wurde die Langzeitsicherheit bei wiederholten Injektionen von Dupilumab bei Erwachsenen mit mittelschwerer bis schwerer atopischer Dermatitis untersucht, die zuvor an kontrollierten Studien mit Dupilumab teilgenommen hatten bzw. in einer Phase-III-Studie eingeschlossen wurden (SOLO1 oder SOLO2). Die Sicherheitsdaten der AD-1225 widerspiegeln die Dupilumab-Exposition bei 2'677 erwachsenen Patienten mit atopischer Dermatitis, von denen 2'254 mindestens 52 Behandlungswochen, 1'224 mindestens 100 Wochen, 561 Patienten mindestens 148 Wochen und 179 Patienten mindestens 260 Wochen an der Studie teilgenommen haben. Der Mehrheit der Patienten in der klinischen Studie 5 (99,7 %) wurde eine wöchentliche Dosis von 300 mg Dupilumab (QW) verabreicht. Das in dieser Studie beobachtete Langzeit-Sicherheitsprofil von bis zu 5 Jahren stimmte insgesamt mit dem in den kontrollierten Studien beobachteten Sicherheitsprofil von Dupilumab überein.
Liste der unerwünschten Wirkungen
Die Anwendungssicherheit von Dupilumab wurde in vier randomisierten, placebokontrollierten, doppelblinden Studien und in einer Dosisfindungsstudie bei Patienten mit einer mittelschweren bis schweren atopischen Dermatitis untersucht. In diesen fünf Studien erhielten 1'689 Studienteilnehmer Dupilumab als subkutane Injektion mit oder ohne begleitende Behandlung mit topischen Kortikosteroiden (TCS). Insgesamt wurden 305 Patienten mindestens ein Jahr lang mit Dupilumab behandelt.
Die unerwünschten Wirkungen aus klinischen Studien zu atopischer Dermatitis sind nach MedDRA-Systemorganklassen und Häufigkeit gemäss folgender Konvention geordnet: sehr häufig (≥1/10), häufig (≥1/100, <1/10), gelegentlich (≥1/1'000, <1/100), selten (≥1/10'000, <1/1'000) oder sehr selten (<1/10'000). Innerhalb jeder Häufigkeitskategorie sind die unerwünschten Wirkungen nach abnehmendem Schweregrad aufgeführt.
Infektionen und parasitäre Erkrankungen
Häufig: Konjunktivitis, Herpes labialis, sonstige Infektionen mit Herpes-Simplex-Viren (Herpes-Ekzem ausgenommen).
Erkrankungen des Blutes und des Lymphsystems
Häufig: Eosinophilie.
Erkrankungen des Immunsystems
Selten: Serumkrankheit / serumkrankheitsähnliche Reaktionen.
Erkrankungen des Nervensystems
Häufig: Kopfschmerzen.
Augenerkrankungen
Häufig: Konjunktivitis.
Gelegentlich: Keratitis, Augenjucken, Blepharitis, trockene Augen.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Reaktionen an der Injektionsstelle (9,6 %).
Atopische Dermatitis der Hände und Füsse
Die Sicherheit von Dupilumab wurde an 133 erwachsenen und jugendlichen Patienten im Alter von 12 bis 17 Jahren mit mittelschwerer bis schwerer atopischer Dermatitis der Hände und Füsse untersucht (AD-1924). Das Sicherheitsprofil von Dupilumab bei den Patienten, die bis Woche 16 nachbeobachtet wurden, war mit dem Sicherheitsprofil in Studien an Erwachsenen und pädiatrischen Patienten ab 6 Monaten mit mittelschwerer bis atopischer Dermatitis vergleichbar.
2) Asthma
Zusammenfassung des Sicherheitsprofils
Die häufigste Nebenwirkung war ein Erythem an der Injektionsstelle. Eine anaphylaktische Reaktion wurde im Rahmen des Asthma-Entwicklungsprogramms selten gemeldet (siehe «Warnhinweise und Vorsichtsmassnahmen»).
In den Studien DRI12544 und QUEST betrug der Anteil an Patienten, welche die Behandlung aufgrund von Nebenwirkungen abbrachen, 4,3 % in der Placebo-Gruppe, 3,2 % in der Gruppe mit Dupilumab 200 mg Q2W und 6,1 % in der Gruppe, die mit Dupilumab 300 mg Q2W behandelt wurde.
Unerwünschte Wirkungen
Es wurden insgesamt 2'888 erwachsene und jugendliche Patienten mit mittelschwerem bis schwerem Asthma in drei randomisierten, placebokontrollierten, multizentrischen Studien mit 24- bis 52-wöchiger Dauer beurteilt (DRI12544, QUEST und VENTURE). Von diesen Studienteilnehmern wiesen 2'678 im Jahr vor der Studienaufnahme trotz regelmässiger Anwendung von inhalativen Kortikosteroiden in mittlerer bis hoher Dosierung plus einem oder mehreren weiteren Arzneimitteln als Basismedikamente eine oder mehrere schwere Exazerbationen auf (DRI12544 und QUEST). Insgesamt wurden 210 Patienten, die zur Asthmabehandlung auf Kortikosteroide angewiesen waren und hochdosierte inhalative Kortikosteroide und höchstens bis zu zwei weiteren Arzneimitteln erhielten, in die VENTURE-Studie eingeschlossen.
Die Langzeitsicherheit von Dupilumab wurde in einer offenen Verlängerungsstudie bei 2'282 Patienten ab 12 Jahren mit mittelschwerem bis schwerem Asthma untersucht (TRAVERSE). In dieser Studie wurden die Patienten während 96 Wochen nachbeobachtet, was einer kumulativen Dupilumab-Exposition von 3'169 Patientenjahren entspricht. Das Sicherheitsprofil von Dupilumab stimmte in der TRAVERSE-Studie mit dem Sicherheitsprofil überein, das in den Zulassungsstudien zu Asthma bei Patienten, die bis zur Woche 52 begleitet wurden, beobachtet wurde.
Im Folgenden sind die in den klinischen Studien zu Asthma beobachteten Nebenwirkungen gemäss der Systemorganklasse und Häufigkeit anhand von folgenden Kategorien aufgeführt: sehr häufig (≥1/10), häufig (≥1/100, < 1/10), gelegentlich (≥1/1'000, < 1/100), selten (≥1/10'000, < 1/1'000), sehr selten (< 1/10'000). Innerhalb jeder Häufigkeitsgruppe sind die Nebenwirkungen nach absteigendem Schweregrad geordnet:
Erkrankungen des Immunsystems
Selten: Anaphylaktische Reaktion.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Erytheme an der Injektionsstelle (14,6 %).
Häufig: Ödem an der Injektionsstelle (4,8 %); Schmerzen an der Injektionsstelle (3,8 %); Pruritus an der Injektionsstelle (4,7 %).
3) Chronische Rhinosinusitis mit Nasenpolypen (CRSwNP)
Zusammenfassung des Sicherheitsprofils
Zu den häufigsten Nebenwirkungen zählen Reaktionen an der Injektionsstelle und Schwellung an der Injektionsstelle.
Im Sicherheitsdatenpool lag der Anteil der Patienten, die die Behandlung aufgrund von unerwünschten Wirkungen abbrachen, bei 2,0 % in der Gruppe mit Dupilumab 300 mg Q2W und bei 4,6 % in der Placebo-Gruppe.
Liste der unerwünschten Wirkungen:
Es wurden insgesamt 722 erwachsene Patienten mit CRSwNP in 2 randomisierten, placebokontrollierten, multizentrischen Studien mit 24- bis 52-wöchiger Dauer beurteilt (SINUS-24 und SINUS-52).
Der Sicherheitsdatenpool umfasste Daten aus den ersten 24 Behandlungswochen.
Die unerwünschten Wirkungen aus klinischen Studien zur CRSwNP beobachteten unerwünschten Wirkungen sind im Folgenden geordnet nach Systemorganklassen und nach Häufigkeit aufgeführt; hierbei gelten folgende Häufigkeitsangaben: sehr häufig (≥1/10), häufig (≥1/100, <1/10), gelegentlich (≥1/1'000, <1/100), selten (≥1/10'000, <1/1'000) oder sehr selten (<1/10'000). Innerhalb jeder Häufigkeitskategorie sind die unerwünschten Wirkungen nach abnehmendem Schweregrad aufgeführt.
Infektionen und parasitäre Erkrankungen
Häufig: Konjunktivitis.
Erkrankungen des Blutes und des Lymphsystems
Häufig: Hypereosinophilie.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Reaktionen an der Injektionsstelle, Schwellung an der Injektionsstelle.
Erkrankungen des Gastrointestinaltrakts
Häufig: Gastritis, Zahnschmerzen.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Häufig: Arthralgie.
Psychiatrische Erkrankungen
Häufig: Schlaflosigkeit.
4) Prurigo nodularis
Zusammenfassung des Sicherheitsprofils
Das häufigste unerwünschte Ereignis war eine Konjunktivitis, einschliesslich einer allergischen Konjunktivitis.
Liste der unerwünschten Wirkungen
Insgesamt 309 erwachsene Patienten mit Prurigo nodularis (PN) wurden in zwei 24-wöchigen, multizentrischen, randomisierten, doppelblinden, placebokontrollierten Studien (PRIME und PRIME2) untersucht. Der Sicherheitsdatenpool umfasste die Daten des 24-wöchigen Behandlungs- und des 12-wöchigen Nachbeobachtungszeitraums beider Studien.
Im Sicherheitsdatenpool betrug der Anteil der Patienten, die die Behandlung aufgrund unerwünschter Ereignisse abbrachen, 3 % in der Placebogruppe sowie 0 % in der Gruppe, die Dupilumab 300 mg Q2W erhielt.
Die unerwünschten Wirkungen aus klinischen Studien zur Prurigo nodularis sind nach MedDRA-Systemorganklassen und Häufigkeit gemäss folgender Konvention geordnet: sehr häufig (≥1/10), häufig (≥1/100, <1/10), gelegentlich (≥1/1'000, <1/100), selten (≥1/10'000, <1/1'000) oder sehr selten (<1/10'000). Innerhalb jeder Häufigkeitskategorie sind die unerwünschten Wirkungen nach abnehmendem Schweregrad aufgeführt.
Infektionen und parasitäre Erkrankungen:
Häufig: Konjunktivitis (4 %), einschliesslich allergischer Konjunktivitis.
5) Eosinophile Ösophagitis
Zusammenfassung des Sicherheitsprofils
Zu den häufigsten Nebenwirkungen zählen Reaktionen an der Injektionsstelle, insbesondere Schwellung und Blutergüsse an der Injektionsstelle.
Im Sicherheitsdatenpool betrug der Anteil an Patienten, welche die Behandlung aufgrund von Nebenwirkungen abbrachen, 1,7 % in der Placebo-Gruppe und 2,5 % in der Gruppe mit Dupilumab 300 mg einmal wöchentlich.
Liste der unerwünschten Wirkungen
Es wurden insgesamt 321 Erwachsene und Jugendliche (von 12 bis 17 Jahren) mit eosinophiler Ösophagitis beurteilt im Rahmen einer randomisierten, doppelblinden, multizentrischen und placebokontrollierten Parallelgruppenstudie, die aus zwei Studien mit 24-wöchiger Dauer bestand (TREET Teil A und TREET Teil B). Die Patienten, die den 24-wöchigen, doppelblinden Behandlungszeitraum in Teil A oder B durchlaufen hatten, erhielten die Möglichkeit, an einer 28-wöchigen Verlängerungsstudie mit aktiver Behandlung teilzunehmen (TREET Teil C). Die angegebenen Sicherheitsdaten stammen von 239 Patienten der Teile A und B, die entweder 300 mg Dupilumab einmal wöchentlich (QW) oder Placebo erhalten hatten.
Das Sicherheitsprofil von Dupilumab bis Woche 52 war im Wesentlichen vergleichbar mit dem Sicherheitsprofil, das in Woche 24 beobachtet wurde.
Die unerwünschten Wirkungen, die während der klinischen Studien zur eosinophilen Ösophagitis beobachtet wurden, sind im Folgenden nach Systemorganklassen und Häufigkeit anhand von folgenden Kategorien aufgeführt: sehr häufig (≥1/10), häufig (≥1/100 bis <1/10), gelegentlich (≥1/1'000 bis <1/100), selten (≥1/10'000 bis <1/1'000) oder sehr selten (<1/10'000). Innerhalb jeder Häufigkeitskategorie sind die unerwünschten Wirkungen nach abnehmendem Schweregrad aufgeführt.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Reaktionen an der Injektionsstelle (12,3 %), einschliesslich Schwellung und Bluterguss an der Injektionsstelle.
6) Chronisch obstruktive Lungenerkrankung
Zusammenfassung des Sicherheitsprofils
Die häufigsten unerwünschten Wirkungen waren Reaktionen an der Injektionsstelle.
Der Anteil der Patienten, die die Behandlung aufgrund von unerwünschten Wirkungen abbrachen, betrug 3 % in der Placebo-Gruppe und 3 % in der Dupilumab-300-mg-Gruppe alle zwei Wochen.
Liste der unerwünschten Wirkungen
Insgesamt 1872 erwachsene COPD-Patienten wurden in zwei randomisierten, doppelblinden, multizentrischen, placebokontrollierten Parallelgruppenstudien über einen Behandlungszeitraum von 52 Wochen untersucht (BOREAS und NOTUS). In beiden Studien wurden die Patienten randomisiert und erhielten entweder 300 mg Dupilumab alle zwei Wochen oder ein entsprechendes Placebo.
Die in den klinischen Studien zur COPD beobachteten unerwünschten Wirkungen sind im Folgenden nach Systemorganklasse und Häufigkeit anhand der folgenden Kategorien aufgeführt: sehr häufig (≥1/10); häufig (≥1/100, < 1/10); gelegentlich (≥1/1000, < 1/100); selten (≥1/10'000, 1/1000); sehr selten (< 1/10'000). Innerhalb jeder Häufigkeitsgruppe sind die unerwünschten Wirkungen nach abnehmendem Schweregrad aufgeführt.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Reaktionen an der Injektionsstelle, einschliesslich Erythem, Ekchymose, Induration, Ausschlag, Schmerzen, Dermatitis und Pruritus.
Beschreibung spezifischer unerwünschter Wirkungen
Beschreibung spezifischer unerwünschter Wirkungen bei den Indikationen atopische Dermatitis, Asthma, CRSwNP, Prurigo nodularis, eosinophile Ösophagitis und COPD:
Überempfindlichkeitsreaktionen
Es wurde über Überempfindlichkeitsreaktionen einschliesslich Anaphylaxie, Angioödem und Serumkrankheit oder serumkrankheitsähnliche Symptome berichtet (siehe «Kontraindikationen» und «Warnhinweise und Vorsichtsmassnahmen»).
Konjunktivitis- und Keratitis-bezogene Ereignisse
Ereignisse im Zusammenhang mit Konjunktivitis und Keratitis traten bei Patienten mit atopischer Dermatitis, die in den placebokontrollierten Studien Dupilumab erhielten, häufiger auf. Bei den meisten Patienten klang die Konjunktivitis oder Keratitis während des Behandlungszeitraums ab bzw. war im Abklingen begriffen.
Die Konjunktivitis- bzw. Keratitisraten blieben in der Langzeitstudie OLE (AD-1225) über 5 Jahre ähnlich.
Bei Asthma- und COPD-Patienten war die Häufigkeit einer Konjunktivitis und einer Keratitis gering und in den Gruppen mit Dupixent und Placebo vergleichbar.
Bei Patienten mit CRSwNP und Prurigo nodularis war die Häufigkeit einer Konjunktivitis gering, jedoch unter Dupixent höher als unter Placebo.
Bei Patienten mit eosinophiler Ösophagitis war die Häufigkeit einer Konjunktivitis gering und in den Gruppen mit Dupilumab und Placebo vergleichbar.
Im Entwicklungsprogramm für CRSwNP, PN oder eosinophile Ösophagitis wurden keine Fälle von Keratitis berichtet (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Eczema herpeticum
In den 16-wöchigen Studien zur Anwendung von Dupilumab als Monotherapie bei atopischer Dermatitis lag der Anteil der Patienten, bei denen ein Eczema herpeticum berichtet wurde, in den Dupilumab-Gruppen bei < 1 % und in der Placebo-Gruppe bei < 1 %.
In der 52-wöchigen Studie mit Dupilumab + TCS wurde ein Eczema herpeticum in der mit Dupilumab + TCS behandelten Gruppe bei 0,2 % der Patienten gemeldet und in der Gruppe unter Placebo + TCS bei 1,9 %.
Hypereosinophilie
In den Anwendungsgebieten atopische Dermatitis, Asthma, chronische Rhinosinusitis mit Nasenpolypen und COPD kam es bei Patienten, die mit Dupilumab behandelt wurden, im Schnitt zu einem grösseren initialen Anstieg der Eosinophilenzahl gegenüber dem Ausgangswert als bei Patienten, die Placebo erhielten. Während der Studienbehandlung gingen die Eosinophilenzahlen annähernd auf die Ausgangswerte zurück. Die Eosinophilenzahl sank während der offenen Verlängerungsstudie bei Asthmapatienten weiter unter den Referenzwert.
Im Vergleich zu Placebo wurde bei Prurigo nodularis (Studien PRIME und PRIME2) kein Anstieg der mittleren Eosinophilenzahlen im Blut beobachtet. Die mittleren und medianen Eosinophilenzahlen gingen bei Patienten mit eosinophiler Ösophagitis unter Studienbehandlung annähernd auf die Ausgangswerte bei Einschluss zurück oder blieben unterhalb der Ausgangswerte.
Bei COPD war die Inzidenz einer unter der Behandlung aufgetretenen Eosinophilie (≥500 Zellen/µl) bei Patienten mit < 500 Zellen/µl bei Einschluss in der Dupilumab-Gruppe (16,2 %) höher als in der Placebo-Gruppe (8,6 %); keiner dieser Fälle war mit klinischen Symptomen assoziiert.
Bei den Indikationen atopische Dermatitis, Asthma und Nasenpolypen war die Inzidenz der unter der Behandlung aufgetretenen Eosinophilie (≥500 Zellen/µl) in den Dupilumab-Gruppen und in der Placebo-Gruppe vergleichbar. Bei eosinophiler Ösophagitis lag die Inzidenz der unter der Behandlung aufgetretenen Eosinophilie in der Dupilumab-Gruppe (≥500 Zellen/µl) unterhalb der Inzidenz innerhalb der Placebo-Gruppe.
Eine unter der Behandlung auftretende Hypereosinophilie (≥5'000 Zellen/µl) wurde bei < 3 % der mit Dupilumab behandelten Patienten und < 0,5 % der Patienten unter Placebo berichtet (Studien SOLO1, SOLO2, AD-1021, DRI12544, QUEST, SINUS-24 und SINUS-52, PRIME und PRIME2, TREET Teil A und Teil B, BOREAS und NOTUS).
Eine unter der Behandlung auftretende Hypereosinophilie (≥5'000 Zellen/µl) wurde bei 8,4 % der mit Dupilumab behandelten Patienten und 0 % der Patienten unter Placebo in der Studie AD-1539 berichtet. Die Eosinophilenzahlen sanken bis zum Ende der Behandlung unter den Referenzwert.
Bei Patienten, die mit Dupilumab behandelt wurden, wurden Fälle von eosinophiler Pneumonie sowie Vaskulitis, die mit einer eosinophilen Granulomatose mit Polyangiitis (EGPA) verbunden sind, berichtet. Die berichteten Fälle traten tendenziell bei Patienten mit Asthma oder CRSwNP mit komorbidem Asthma auf. (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Infektionen
In den 16-wöchigen klinischen Studien zur Anwendung von Dupilumab als Monotherapie bei atopischer Dermatitis bei Erwachsenen lag in der Gesamtheit der primären Sicherheitsdaten der Anteil der Patienten, bei denen schwerwiegende Infektionen berichtet wurden, in der Placebo-Gruppe bei 1,0 % und in der Dupilumab-Gruppe bei 0,5 %. In der 52-wöchigen CHRONOS-Studie lag der Anteil der Patienten, bei denen schwerwiegende Infektionen berichtet wurden, in der Placebo-Gruppe bei 0,6 % und in der Dupilumab-Gruppe bei 0,2 %. Die Rate schwerer Infektionen blieb in der Langzeitstudie OLE (AD-1225) über 5 Jahre stabil.
In der Gesamtheit der Sicherheitsdaten über 24 Wochen aus klinischen Studien zu Asthma lag der Anteil der Patienten, bei denen schwerwiegenden Infektionen gemeldet wurden, in der Dupilumab-Gruppe bei 1,0 % und in der Placebo-Gruppe bei 1,1 %. In der 52-wöchtigen QUEST-Studie lag der Anteil der Patienten, bei denen schwerwiegende Infektionen berichtet wurden, in der Dupilumab-Gruppe bei 1,3 % und in der Placebo-Gruppe bei 1,4 %.
In der Gesamtheit der Sicherheitsdaten über 24 Wochen aus klinischen Studien zu CRSwNP lag der Anteil der Patienten, bei denen schwerwiegenden Infektionen gemeldet wurden, in der Dupilumab-Gruppe bei 0,7 % und in der Placebo-Gruppe bei 1,1 %. In der 52-wöchtigen SINUS-52-Studie lag der Anteil der Patienten, bei denen schwerwiegende Infektionen berichtet wurden, in der Dupilumab-Gruppe bei 1,3 % und in der Placebo-Gruppe bei 1,3 %.
In der Gesamtheit der Sicherheitsdaten aus klinischen Studien zu Prurigo nodularis wurde kein Anstieg der Gesamtinzidenz von Infektionen unter Dupilumab im Vergleich zu Placebo beobachtet. In der Gesamtheit der Sicherheitsdaten wurden schwerwiegende Infektionen bei 1,3 % der mit Dupilumab behandelten Patienten und 1,3 % der mit Placebo behandelten Patienten berichtet.
Die Gesamtinzidenz von Infektionen im Sicherheitsdatenpool über 24 Wochen der TREET-Studien (Teil A und Teil B) zu eosinophiler Ösophagitis lag in der Dupilumab-Gruppe (32,0 %) im Vergleich zur Placebo-Gruppe (24,8 %) höher. Die Gesamtinzidenz von Infektionen lag in der Placebo-Gruppe (41,2 %) im Vergleich zur Dupilumab-Gruppe (35,8 %) in der Studie EoE KIDS (Teil A) höher. In der Gesamtheit der Sicherheitsdaten der Studien TREET (Teil A und B) zu eosinophiler Ösophagitis wurden schwerwiegende Infektionen bei 0,5 % der mit Dupilumab behandelten Patienten und bei 0 % der mit Placebo behandelten Patienten berichtet. In der Studie EoE KIDS (Teil A) wurden keine schwerwiegenden Infektionen beobachtet. Die Infektionen der oberen Atemwege umfassen mehrere Begriffe, unter anderem COVID-19, Sinusitis und Infektionen der oberen Atemwege, und lagen unter Dupilumab (17,2 %) im Vergleich zu Placebo (10,3 %) in den Studien TREET EoE (Teil A und B) höher. In den Gesamtinfektionen der oberen Atemwege (26,9 % für Dupilumab im Vergleich zu 20,6 % für Placebo) wurde ein geringerer Unterschied in der Studie EoE KIDS (Teil A) beobachtet.
Bei den gesamten Sicherheitsdaten aus den klinischen Studien zu COPD wurde kein Anstieg der Gesamtinzidenz von Infektionen unter Dupilumab gegenüber Placebo beobachtet. Schwere Infektionen wurden bei 4,9 % der mit Dupilumab behandelten Patienten und bei 4,8 % der mit Placebo behandelten Patienten berichtet.
Herpes zoster
Herpes zoster wurde in den 16-wöchigen Monotherapie-Studien in den Dupilumab-Gruppen bei < 0,1 % und in der Placebo-Gruppe bei < 1 % der Patienten berichtet. In der 52-wöchigen Studie mit Dupilumab + TCS wurde Herpes zoster in der mit Dupilumab + TCS behandelten Gruppe bei 1 % der Patienten gemeldet und in der Gruppe unter Placebo + TCS bei 2 %.
Immunogenität
Wie alle therapeutischen Proteine ist Dupilumab mit einem Immunogenitätsrisiko verbunden.
Etwa 5 % der Patienten mit atopischer Dermatitis, Asthma oder CRSwNP, die Dupilumab 300 mg Q2W über 52 Wochen erhielten, entwickelten ADA gegen Dupilumab; ca. 2 % zeigten anhaltende ADA-Reaktionen und ungefähr 2 % wiesen neutralisierende Antikörper auf. Vergleichbare Ergebnisse wurden bei erwachsenen Patienten mit Prurigo nodularis beobachtet, die über 24 Wochen 300 mg Dupilumab Q2W erhielten, bei pädiatrischen Patienten (6 Monate bis 11 Jahre) mit atopischer Dermatitis beobachtet, die über 16 Wochen Dupilumab in der Dosierung von entweder 200 mg alle zwei Wochen oder 200 mg alle 4 Wochen oder 300 mg alle vier Wochen erhielten, sowie bei Patienten (6 bis 11 Jahre) mit Asthma, die über 52 Wochen alle zwei Wochen Dupilumab 100 mg oder 200 mg erhielten.
Etwa 16 % der jugendlichen Patienten mit atopischer Dermatitis, die über 16 Wochen 300 mg oder 200 mg Q2W erhielten, entwickelten Antikörper gegen Dupilumab; ca. 3 % zeigten anhaltende ADA-Reaktionen und ungefähr 5 % wiesen neutralisierende Antikörper auf.
Etwa 9 % der Patienten mit Asthma, die Dupilumab 200 mg Q2W über 52 Wochen erhielten, entwickelten ADA gegen Dupilumab; ca. 4 % zeigten anhaltende ADA-Reaktionen und ungefähr 4 % wiesen neutralisierende Antikörper auf.
Rund 8 % der COPD-Patienten, die Dupilumab 300 mg alle zwei Wochen über 52 Wochen erhielten, entwickelten Antikörper gegen Dupilumab; etwa 3 % zeigten persistierende ADA-Antworten und etwa 3 % wiesen neutralisierende Antikörper auf.
Etwa 1 % der Patienten ab einem Jahr mit eosinophiler Ösophagitis, die über 52 Wochen 300 mg einmal wöchentlich (≥40 kg), 300 mg alle 2 Wochen (≥30 kg) oder 200 mg alle 2 Wochen (≥15 bis < 30 kg) erhielten, entwickelten Antikörper gegen Dupilumab; die ADA-Reaktionen waren weder langanhaltend noch neutralisierend.
Unabhängig von Alter und Population wurden bis zu 4 % Patienten in der Placebo-Gruppe positiv auf Antikörper gegen Dupilumab getestet; bis zu 2 % zeigte langanhaltende ADA-Reaktionen und etwa 1 % wies neutralisierende Antikörper auf. Weniger als 1,5 % der Patienten, die Dupixent erhielten, entwickelten erhöhte Antikörpertiter.
Bei den Studienteilnehmern, die Dupixent erhielten, war die Entwicklung erhöhter Antikörpertiter gegen Dupilumab mit niedrigeren Serumkonzentrationen von Dupilumab verbunden. Manche Studienteilnehmer, die hohe Antikörpertiter aufwiesen, hatten zusätzlich keine nachweisbare Serumkonzentration von Dupilumab.
Zwei erwachsene Studienteilnehmer mit atopischer Dermatitis, die starke ADA-Reaktionen aufwiesen, entwickelten während der Behandlung mit Dupilumab eine Serumkrankheit oder serumkrankheitsähnliche Reaktionen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Unerwünschte Wirkungen nach Markteinführung
Die folgenden zusätzlichen unerwünschten Wirkungen wurden im Rahmen der Anwendung nach der Marktzulassung von Dupixent gemeldet. Die unerwünschten Wirkungen stammen aus Spontanmeldungen, ihre Häufigkeit ist daher nicht bekannt (aufgrund der verfügbaren Daten nicht abschätzbar).
Erkrankungen des Immunsystems:
·Angioödem.
Funktionsstörungen der Haut und des Unterhautzellgewebes:
·Hautausschlag im Gesicht.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen:
·Arthralgie.
Augenerkrankungen:
·Keratitis und ulzerative Keratitis.
Pädiatrische Population
Atopische Dermatitis
Jugendliche mit atopischer Dermatitis
Die Sicherheit von Dupilumab wurde in einer Studie an 250 Patienten von 12 bis 17 Jahren mit mittelschwerer bis schwerer atopischer Dermatitis untersucht, von denen 166 mit Dupilumab behandelt wurden (AD-1526). Das bei diesen Patienten bis einschliesslich Woche 16 beobachtete Sicherheitsprofil von Dupilumab war mit dem Sicherheitsprofil in Studien an Erwachsenen mit atopischer Dermatitis vergleichbar.
Die Langzeitsicherheit von Dupilumab wurde in einer unverblindeten Verlängerungsstudie an Patienten von 12 bis 17 Jahren mit mittelschwerer bis schwerer atopischer Dermatitis (AD-1434) untersucht. Das bei diesen Patienten bis einschliesslich Woche 52 beobachtete Sicherheitsprofil von Dupilumab war mit dem in Woche 16 beobachteten Sicherheitsprofil in der Studie AD-1526 vergleichbar. Das bei Jugendlichen beobachtete Langzeit-Sicherheitsprofil von Dupilumab entsprach dem bei Erwachsenen mit atopischer Dermatitis beobachteten Profil.
Kinder (6 bis 11 Jahre) mit atopischer Dermatitis
Die Sicherheit von Dupilumab in Kombination mit topischen Kortikosteroiden (TCS) wurde in einer Studie mit 367 Patienten im Alter von 6 bis 11 Jahren mit schwerer atopischer Dermatitis untersucht (AD-1652). Das Sicherheitsprofil von Dupilumab + TCS war bei diesen Patienten bis Woche 16 vergleichbar mit dem Sicherheitsprofil in Studien an Erwachsenen und Jugendlichen mit atopischer Dermatitis.
Die Langzeitsicherheit von Dupilumab + TCS wurde in einer offenen Verlängerungsstudie mit 368 Patienten im Alter von 6 bis 11 Jahren mit atopischer Dermatitis untersucht (AD-1434). Von den Patienten, die an der Studie AD-1434 teilnahmen, litten bei der Baseline 110 (29,9 %) an mittelschwerer atopischer Dermatitis und 72 (19,6 %) an schwerer atopischer Dermatitis. Das Sicherheitsprofil von Dupilumab + TCS bei Patienten, die bis Woche 52 nachbeobachtet wurden, war vergleichbar mit dem Sicherheitsprofil, das in der Studie AD-1652 bis Woche 16 beobachtet wurde. Das bei pädiatrischen Patienten beobachtete Langzeit-Sicherheitsprofil von Dupilumab + TCS war vergleichbar mit dem in Studien an Erwachsenen und Jugendlichen mit atopischer Dermatitis beobachteten Sicherheitsprofil.
Kinder (6 Monate bis 5 Jahre) mit atopischer Dermatitis
Die Sicherheit von Dupilumab in Kombination mit topischen Kortikosteroiden (TCS) wurde in einer Studie mit 161 Patienten im Alter von 6 Monaten bis 5 Jahren mit mittelschwerer bis schwerer atopischer Dermatitis untersucht (AD-1539). Das Sicherheitsprofil von Dupilumab + TCS war bei diesen Patienten bis Woche 16 vergleichbar mit dem Sicherheitsprofil in Studien an Erwachsenen, Jugendlichen und Kindern von 6 bis 17 Jahren mit atopischer Dermatitis.
Die Langzeitsicherheit von Dupilumab + TCS wurde in einer offenen Verlängerungsstudie mit 180 Patienten im Alter von 6 Monaten bis 5 Jahren mit atopischer Dermatitis untersucht (AD-1434). Das Sicherheitsprofil von Dupilumab + TCS bei Patienten, die bis Woche 52 nachbeobachtet wurden, war vergleichbar mit dem Sicherheitsprofil, das bis Woche 16 beobachtet wurde.
Asthma
Pädiatrische Population (6 bis 11 Jahre)
Die Sicherheit von Dupilumab wurde an 405 Patienten im Alter von 6 bis 11 Jahren mit mittelschwerem bis schwerem Asthma untersucht (VOYAGE). Das Sicherheitsprofil von Dupilumab war bei diesen Patienten bis zur Woche 52 mit dem Sicherheitsprofil in Studien bei Erwachsenen und Jugendlichen mit mittelschwerem bis schwerem Asthma vergleichbar, mit Enterobiasis und Eosinophilie als zusätzlichen unerwünschten Wirkungen. Enterobiasis wurde bei 1,8 % (5 Patienten) in den Dupilumab-Gruppen berichtet und in der Placebo-Gruppe nicht beobachtet. Alle Fälle von Enterobiasis waren leicht bis mittelschwer, und die Patienten erholten sich unter Behandlung mit Anthelminthika, ohne dass die Behandlung mit Dupilumab abgesetzt wurde.
Eosinophilie (Eosinophilenzahl im Blut ≥3'000 Zellen/µl oder vom Prüfarzt als unerwünschtes Ereignis eingestuft) wurde bei 6,6 % der Patienten in den Dupilumab-Gruppen und bei 0,7 % der Patienten in der Placebo-Gruppe berichtet.
Die Langzeitsicherheit von Dupilumab wurde in einer unverblindeten Verlängerungsstudie (EXCURSION) bei Kindern im Alter von 6 bis 11 Jahren mit mittelschwerem bis schwerem Asthma, die bereits an der VOYAGE-Studie teilgenommen haben, untersucht. Von den 365 Patienten, die an der Studie EXCURSION teilgenommen haben, haben 350 Patienten eine 52-wöchige Behandlung abgeschlossen und 228 Patienten haben eine kumulative Behandlungsdauer von 104 Wochen abgeschlossen (VOYAGE und EXCURSION). Das Langzeit-Sicherheitsprofil von Dupilumab in der EXCURSION-Studie entsprach dem Sicherheitsprofil, das in der pivotalen Asthmastudie (VOYAGE) über 52 Behandlungswochen beobachtet wurde.
Eosinophile Ösophagitis
Pädiatrische Patienten ( 1 bis 11 Jahren)
Die Sicherheit von Dupilumab war in einer Studie an 101 Patienten im Alter von 1 bis 11 Jahren mit EoE (EoE KIDS Teil A) höher. Das Sicherheitsprofil von Dupilumab bei Patienten bis Woche 16 war vergleichbar mit dem Sicherheitsprofil, das bei Erwachsenen und Jugendlichen im Alter von 12 bis 17 Jahren mit EoE beobachtet wurde.
Die Patienten, die den Behandlungszeitraum in Teil A durchlaufen hatten, erhielten die Möglichkeit, an einer 36-wöchigen Verlängerungsstudie mit aktiver Behandlung teilzunehmen (EoE-KIDS Teil B). Das Sicherheitsprofil von Dupilumab bis Woche 52 war vergleichbar mit dem Sicherheitsprofil, das in Woche 16 beobachtet wurde. Reaktionen an der Injektionsstelle (einschliesslich Erytheme an der Injektionsstelle) wurde in 24,3 % der pädiatrischen Patienten, die mit Dupilumab in der EoE-Studie behandelt wurden, berichtet. Im Teil B wurde Helminthose bei einem Studienteilnehmer gemeldet, der mit Dupilumab behandelt wurde.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungEs gibt keine besondere Behandlung für eine Überdosierung mit Dupilumab. Im Falle einer Überdosierung ist der Patient auf Anzeichen oder Symptome von Nebenwirkungen zu überwachen und im Bedarfsfall ist umgehend eine entsprechende symptomatische Behandlung einzuleiten.
Eigenschaften/WirkungenATC-Code
D11AH05
Wirkungsmechanismus
Dupilumab ist ein rekombinanter, humaner, monoklonaler IgG4-Antikörper, der die Signalwege von Interleukin 4 (IL-4) und Interleukin 13 (IL-13) hemmt. Dupilumab hemmt den IL-4-Signalweg über den Typ-I-Rezeptor (IL-4Rα/γc) und die Signalwege von IL-4 und IL-13 über den Typ-II-Rezeptor (IL-4Rα/IL-13Rα).
IL-4 und IL-13 sind Zytokine im Zusammenhang mit entzündlichen Erkrankungen vom Typ-2 wie atopische Dermatitis und Asthma. Durch Hemmung des IL-4-/IL-13-Signalwegs mit Dupilumab kommt es zu einer Verringerung mehrerer Mediatoren der Typ-2-Inflammation.
Dupilumab normalisiert das Expressionsprofil der RNA der Ösophagusbiopsien, einschliesslich der Gene, die mit Typ-2-Inflammationen, Eosinophilen und mit sonstigen an der eosinophilen Ösophagitis beteiligten biologischen Prozessen (wie Zellproliferation, Barrierefunktion, Fibrose und Remodeling) in Verbindung stehen.
Pharmakodynamik
In klinischen Studien zu atopischer Dermatitis war die Behandlung mit Dupilumab mit einer Senkung der Konzentration von Biomarkern der Immunität Typ 2 wie thymusaktivitätsregulierten Chemokinen (TARC/CCL17), dem Gesamt-IgE im Serum sowie dem allergenspezifischen IgE im Serum gegenüber den Ausgangswerten assoziiert. Unter der Behandlung mit Dupilumab wurde bei Erwachsenen und Jugendlichen mit atopischer Dermatitis eine Abnahme der Laktatdehydrogenase (LDH) beobachtet.
Während der Behandlung kommt es durch die Präsenz von Dupilumab zu einem Anstieg des IgG4-Spiegels. Die Auswirkungen einer Langzeittherapie mit einem monoklonalen IgG4-Antikörper wurden noch nicht ausreichend untersucht.
In klinischen Studien zu Asthma kam es unter der Behandlung mit Dupilumab im Vergleich zu Placebo zu einer deutlichen Verringerung der FeNO-Werte und der Konzentrationen an Eotaxin-3, Gesamt-IgE, allergenspezifischem IgE, TARC und Periostin im Blutkreislauf. Diese Verringerungen von Biomarkern der Typ-2-Inflammation waren für die Behandlungsschemata mit 200 mg Q2W und 300 mg Q2W vergleichbar. Diese Marker waren nach 2-wöchiger Behandlung nahezu nicht nachweisbar, mit Ausnahme von IgE, das einen langsameren Rückgang zeigte. Diese Wirkungen hielten über die gesamte Behandlungsdauer an.
Bei COPD-Patienten verringerte die Behandlung mit Dupilumab gegenüber Placebo die Typ-2-Biomarker, insbesondere FeNO und Gesamt-IgE. Ein Rückgang von FeNO wurde bereits in Woche 4 beobachtet. Diese Auswirkungen auf die Typ-2-Biomarker blieben während der gesamten Behandlung mit Dupilumab erhalten.
Klinische Wirksamkeit
1) Atopische Dermatitis
Klinische Wirksamkeit und Sicherheit bei atopischer Dermatitis bei Erwachsenen
Die Wirksamkeit und Sicherheit von Dupilumab als Monotherapie und mit einer begleitenden Behandlung mit topischen Kortikosteroiden wurden in drei randomisierten, placebokontrollierten, doppelblinden Zulassungsstudien (SOLO 1, SOLO 2 und CHRONOS) untersucht. Eingeschlossen waren 2'119 Patienten ab 18 Jahren mit einer mittelschweren bis schweren atopischen Dermatitis (AD), definiert durch einen Investigator's Global Assessment-Score (IGA) ≥3, einen EASI-Score (Eczema Area and Severity Index) ≥16 und eine betroffene Körperoberfläche von 10 % oder mehr. Die für diese drei Studien geeigneten und darin eingeschlossenen Patienten hatten vorher nur unzureichend auf eine topische Behandlung angesprochen.
In den drei Studien erhielten die Patienten 1) eine Anfangsdosis von 600 mg Dupilumab (zwei Injektionen zu je 300 mg) an Tag 1, gefolgt von 300 mg einmal alle zwei Wochen (Q2W); 2) eine Anfangsdosis von 600 mg Dupilumab an Tag 1, gefolgt von 300 mg einmal wöchentlich oder 3) ein entsprechendes Placebo. Dupilumab wurde in allen Studien als subkutane (s. c.) Injektion verabreicht. Um als unerträglich empfundene Symptome der atopischen Dermatitis zu lindern, konnten die Patienten nach Ermessen des Prüfarztes eine Rescue-Therapie erhalten (u.a. topische Steroide mit höherer Wirksamkeit oder systemische Immunsuppressiva). Patienten, die eine Rescue-Therapie erhielten, wurden als Non-Responder eingestuft.
In die Studie SOLO 1 wurden 671 Patienten eingeschlossen (224 in die Placebo-Gruppe, 224 in die Gruppe mit Dupilumab 300 mg Q2W und 223 in die Gruppe mit Dupilumab 300 mg QW). Der Behandlungszeitraum betrug 16 Wochen.
In die Studie SOLO 2 wurden 708 Patienten eingeschlossen (236 in die Placebo-Gruppe, 233 in die Gruppe mit Dupilumab 300 mg Q2W und 239 in die Gruppe mit Dupilumab 300 mg QW). Der Behandlungszeitraum betrug 16 Wochen.
In die Studie CHRONOS wurden 740 Patienten eingeschlossen (315 in die Gruppe Placebo + TCS, 106 in die Gruppe mit Dupilumab 300 mg Q2W + TCS und 319 in die Gruppe mit Dupilumab 300 mg QW + TCS). Der Behandlungszeitraum betrug 52 Wochen. Die Patienten erhielten ab Baseline Dupilumab oder ein Placebo sowie eine begleitende Therapie mit TCS gemäss standardisiertem Behandlungsschema. Die Patienten konnten auch topische Calcineurin-Inhibitoren (TCI) erhalten.
Primäre Endpunkte:
Die co-primären Endpunkte aller drei Zulassungsstudien waren der Anteil der Patienten, bei denen sich der Wert auf einer IGA-Skala (von 0 bis 4) von der Baseline bis Woche 16 um ≥2 Punkte auf dann 0 oder 1 («erscheinungsfrei» oder «fast erscheinungsfrei») verbesserte sowie der Anteil der Patienten, deren EASI-Score sich von der Baseline bis Woche 16 um mindestens 75 % (EASI-75) verbesserte. Die weiteren untersuchten Resultate umfassten den Anteil der Patienten mit einer EASI-Verbesserung von mindestens 50 % (EASI-50) bzw. 90 % (EASI-90), einer Verringerung des Juckreizes gemessen an der numerischen Bewertungsskala für Pruritus (Peak Pruritus Numerical Rating Scale [NRS]) und einer prozentualen Veränderung des SCORAD (SCORing Atopic Dermatitis) von der Baseline bis Woche 16. Zusätzliche sekundäre Endpunkte umfassten die mittlere Veränderung des POEM (Patient-Oriented Eczema Measure), des DLQI (Dermatology Life Quality Index) sowie des HADS-Werts (Hospital Anxiety and Depression Scale) von der Baseline bis Woche 16. In der CHRONOS-Studie wurde die Wirksamkeit auch in Woche 52 bewertet.
Patientencharakteristika bei der Baseline:
In allen Behandlungsgruppen der Monotherapie-Studien (SOLO 1 und SOLO 2) lag das mittlere Alter bei 38,3 Jahren und das mittlere Gewicht bei 76,9 kg. 42,1 % der Studienteilnehmer waren Frauen, 68,1 % Weisse, 21,8 % Asiaten und 6,8 % Schwarze. In diesen Studien hatten 51,6 % der Patienten einen Baseline-IGA-Score von 3 (mittelschwere AD), 48,3 % einen Baseline-IGA-Score von 4 (schwere AD) und 32,4 % der Patienten wurden in der Vergangenheit mit systemischen Immunsuppressiva behandelt. Bei Behandlungsbeginn betrug der mittlere EASI-Score 33,0, der wöchentliche Durchschnittswert gemäss Pruritus NRS 7,4, der mittlere SCORAD 67,8, der mittlere POEM 20,5, der mittlere DLQI 15,0 und der mittlere HADS-Gesamtwert 13,3.
In allen Behandlungsgruppen der Studie mit begleitender TCS-Therapie (CHRONOS) lag das mittlere Alter bei 37,1 Jahren und das mittlere Gewicht bei 74,5 kg. 39,7 % der Studienteilnehmer waren Frauen, 66,2 % Weisse, 27,2 % Asiaten und 4,6 % Schwarze. In dieser Studie hatten 53,1 % der Patienten einen Baseline-IGA-Score von 3, 46,9 % einen Baseline-IGA-Score von 4 und 33,6 % der Patienten wurden in der Vergangenheit mit systemischen Immunsuppressiva behandelt. Bei Behandlungsbeginn betrug der mittlere EASI-Score 32,5, der wöchentliche Durchschnittswert gemäss Pruritus NRS 7,3, der mittlere SCORAD 66,4, der mittlere POEM 20,1, der mittlere DLQI 14,5 und der mittlere HADS-Gesamtwert 12,7.
Klinische Wirksamkeit: 16-wöchige Monotherapie-Studien (SOLO 1 und SOLO 2)
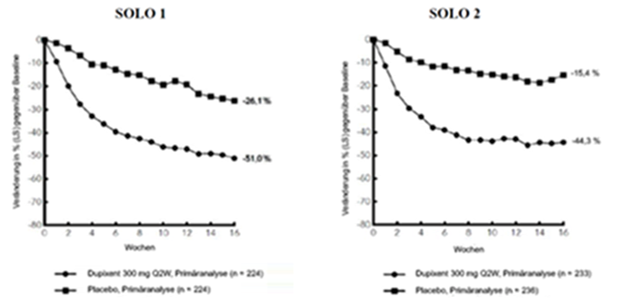
Im Vergleich zu Placebo erreichte in den Studien SOLO 1 und SOLO 2 von der Baseline bis Woche 16 ein signifikant höherer Anteil an Patienten, denen randomisiert Dupilumab zugewiesen worden war, einen IGA-Score von 0 oder 1, den EASI-75 und/oder eine Verbesserung um > 4 Punkte gemäss Pruritus NRS (siehe Tabelle 6).
Im Vergleich zu Placebo erreichte ein signifikant höherer Anteil an Patienten, die randomisiert Dupilumab erhielten, eine schnelle Verbesserung gemäss Pruritus NRS (definiert als Verbesserung um ≥4 Punkte bereits in Woche 2; p < 0,01); im Laufe des Behandlungszeitraums stieg der Patientenanteil mit einem Ansprechen gemäss Pruritus NRS weiterhin an. Die Verbesserung gemäss Pruritus NRS trat parallel zu einer Verbesserung der objektiven Anzeichen der atopischen Dermatitis auf.
Abbildung 1 und Abbildung 2 stellen die mittlere prozentuale Veränderung der EASI- bzw. Pruritus NRS-Scores von der Baseline bis Woche 16 dar.
Tabelle 6: Wirksamkeitsergebnisse der Dupilumab-Monotherapie in Woche 16
|
|
SOLO 1 (FSA) a
|
SOLO 2 (FSA) a
| |
|
Placebo
|
Dupilumab
300 mg Q2W
|
Placebo
|
Dupilumab
300 mg Q2W
| |
Randomisierte Patienten
|
224
|
224
|
236
|
233
| |
IGA 0 oder 1b,
% der Responderc
|
10,3 %
|
37,9 %e
|
8,5 %
|
36,1 %e
| |
EASI-50,
% der Responderc
|
24,6 %
|
68,8 %e
|
22,0 %
|
65,2 %e
| |
EASI-75,
% der Responderc
|
14,7 %
|
51,3 %e
|
11,9 %
|
44,2 %e
| |
EASI-90,
% der Responderc
|
7,6 %
|
35,7 %e
|
7,2 %
|
30,0 %e
| |
Anzahl Patienten mit Pruritus NRS-Wert bei Baseline ≥4
|
212
|
213
|
221
|
225
| |
Pruritus gemäss NRS (Verbesserung ≥4 Punkte)
% der Responderc,d
|
12,3 %
|
40,8 %e
|
9,5 %
|
36,0 %e
|
LS = Least Squares [Methode der kleinsten Quadrate]; SE = Standard Error [Standardfehler]
a Die Full-Sample-Analyse (FSA) umfasst alle randomisierten Patienten.
b Als Responder angesehen wurden Patienten mit einem IGA-Score von 0 oder 1 («erscheinungsfrei» oder «fast erscheinungsfrei») mit einer Verbesserung um ≥2 Punkte auf einer von 0 bis 4 reichenden IGA-Skala.
c Patienten, die eine Rescue-Therapie erhielten oder bei denen Daten fehlten, wurden als Non-Responder eingestuft.
d In Woche 2 war der Anteil der Patienten, bei denen eine Verbesserung gemäss Pruritus NRS um ≥4 Punkte festzustellen war, in den Dupilumab-Gruppen signifikant höher als in der Placebo-Gruppe (p < 0,01).
e p < 0,0001
Abbildung 1: Mittlere prozentuale Veränderung des EASI-Score gegenüber der Baseline in den Studien SOLO 1a und SOLO 2a (FSA)b
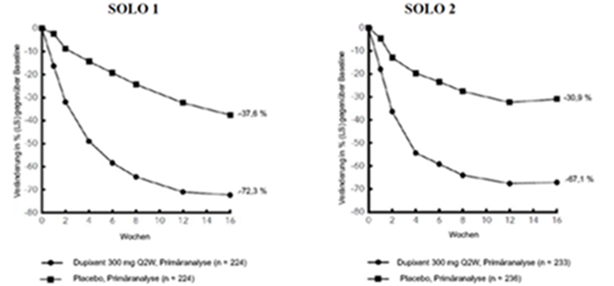
Abbildung 2: Mittlere prozentuale Veränderung gemäss Pruritus NRS gegenüber der Baseline in den Studien SOLO 1a und SOLO 2a (FSA)b
LS = Least Squares
a In den primären Analysen der Wirksamkeitsendpunkte wurden Patienten, die eine Rescue-Therapie erhielten oder bei denen Daten fehlten, als Non-Responder eingestuft.
b Die Full-Sample-Analyse (FSA) umfasst alle randomisierten Patienten.
In den Studien SOLO 1 und SOLO 2 stimmten die Wirksamkeit der Behandlung in den Untergruppen (Gewicht, Alter, Geschlecht, ethnische Herkunft sowie Basistherapie einschliesslich Immunsuppressiva) mit den Ergebnissen der gesamten Studienpopulation überein.
Klinische Wirksamkeit: 52-wöchige Studie mit begleitender Therapie mit TCS (CHRONOS)
Im Vergleich zu Placebo + TCS erreichte in der Studie CHRONOS von der Baseline bis Woche 16 und 52 ein signifikant höherer Anteil an Patienten, denen randomisiert Dupilumab 300 mg Q2W + TCS zugewiesen worden war, einen IGA-Score von 0 oder 1, den EASI-75 und/oder eine Verbesserung um > 4 Punkte gemäss Pruritus NRS (siehe Tabelle 7).
Im Vergleich zu Placebo + TCS erreichte ein signifikant höherer Anteil an Patienten, die randomisiert Dupilumab + TCS erhielten, eine schnelle Verbesserung gemäss Pruritus NRS (definiert als Verbesserung um > 4 Punkte bereits in Woche 2; p < 0,05); im Laufe des Behandlungszeitraums stieg der Patientenanteil mit einem Ansprechen gemäss Pruritus NRS weiterhin an. Die Verbesserung gemäss Pruritus NRS trat im Zusammenhang mit einer Verbesserung der objektiven Anzeichen der atopischen Dermatitis auf.
Abbildung 3 und Abbildung 4 stellen die mittlere prozentuale Veränderung der EASI- bzw. NRS-Scores in der CHRONOS-Studie von der Baseline bis Woche 52 dar.
Tabelle 7: Wirksamkeitsergebnisse von Dupilumab mit begleitenden TCSa in Woche 16 und Woche 52 in der CHRONOS-Studie
|
|
Woche 16 (FSA)b
|
Woche 52 (FSA Woche 52)b
| |
|
Placebo
+
TCS
|
Dupilumab
300 mg
Q2W + TCS
|
Placebo
+
TCS
|
Dupilumab
300 mg
Q2W + TCS
| |
Randomisierte Patienten
|
315
|
106
|
264
|
89
| |
IGA 0 oder 1c,
% der Responderd
|
12,4 %
|
38,7 %f
|
12,5 %
|
36,0 %f
| |
EASI-50,
% der Responderd
|
37,5 %
|
80,2 %f
|
29,9 %
|
78,7 %f
| |
EASI-75,
% der Responderd
|
23,2 %
|
68,9 %f
|
21,6 %
|
65,2 %f
| |
EASI-90,
% der Responderd
|
11,1 %
|
39,6 %f
|
15,5 %
|
50,6 %f
| |
Anzahl Patienten mit Pruritus NRS-Wert bei Baseline ≥4
|
299
|
102
|
249
|
86
| |
Pruritus NRS-Wert
(Verbesserung ≥4 Punkte),
% der Responderd,e
|
19,7 %
|
58,8 %f
|
12,9 %
|
51,2 %f
|
LS = Least Squares [Methode der kleinsten Quadrate]; SE = Standard Error [Standardfehler]
a Alle Patienten erhielten eine Basistherapie mit TCS. Die Patienten konnten topische Calcineurin-Inhibitoren anwenden.
b Die Full-Sample-Analyse (FSA) umfasst alle randomisierten Patienten. Die FSA in Woche 52 umfasst alle Patienten, die mindestens ein Jahr vor dem Enddatum der Primäranalyse randomisiert wurden.
c Als Responder angesehen wurden Patienten mit einem IGA-Score von 0 oder 1 («erscheinungsfrei» oder «fast erscheinungsfrei») mit einer Verbesserung um ≥2 Punkte auf einer von 0 bis 4 reichenden IGA-Skala.
d Patienten, die eine Rescue-Therapie erhielten oder bei denen Daten fehlten, wurden als Non-Responder eingestuft.
e In Woche 2 war der Anteil der Patienten, bei denen eine Verbesserung gemäss Pruritus NRS um ≥4 Punkte festzustellen war, unter Dupilumab signifikant höher als unter Placebo (p < 0,05).
f p < 0,0001
g p = 0,0015
h p = 0,0003
i p = 0,0005
Abbildung 3: Mittlere Veränderung (in %) des EASI-Score gegenüber der Baseline in der CHRONOS-Studiea (FSA in Woche 52)b
CHRONOS
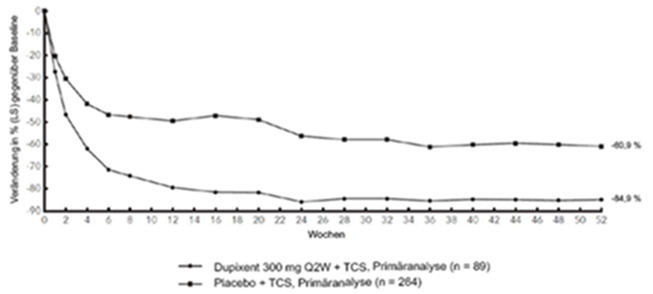
Abbildung 4: Mittlere Veränderung (in %) gemäss Pruritus NRS gegenüber der Baseline in der CHRONOS-Studiea (FSA in Woche 52)b
CHRONOS

LS = Least Squares [Methode der kleinsten Quadrate]
a In den primären Analysen der Wirksamkeitsendpunkte wurden Patienten, die eine Rescue-Therapie erhielten oder bei denen Daten fehlten, als Non-Responder eingestuft.
b Die FSA in Woche 52 umfasst alle Patienten, die mindestens ein Jahr vor dem Enddatum der Primäranalyse randomisiert wurden.
In der CHRONOS-Studie stimmte die Wirksamkeit der Behandlung in den Untergruppen (Gewicht, Alter, Geschlecht, ethnische Herkunft sowie Basistherapie einschliesslich Immunsuppressiva) mit den Ergebnissen der gesamten Studienpopulation überein.
Klinische Wirksamkeit: Patienten, die unter einer Ciclosporin-Behandlung unzureichend eingestellt waren, eine Unverträglichkeit gegenüber Ciclosporin aufwiesen oder für die diese Behandlung medizinisch nicht indiziert war (CAFE-Studie)
Im Rahmen der CAFE-Studie wurde die Wirksamkeit von Dupilumab mit begleitender TCS-Therapie gegenüber Placebo innerhalb eines 16-wöchigen Behandlungszeitraums bewertet. Bei den Studienteilnehmern handelte es sich um erwachsene Patienten mit schwerer atopischer Dermatitis, die unter einem oralen Ciclosporin unzureichend eingestellt waren, dieses nicht vertrugen oder für die diese Behandlung derzeit kontraindiziert oder medizinisch nicht angezeigt ist.
Insgesamt wurden 325 Patienten eingeschlossen, von denen 210 bereits in der Vergangenheit mit Ciclosporin behandelt wurden, während 115 Patienten noch nie Ciclosporin erhalten hatten oder eine Ciclosporin-Behandlung bei ihnen medizinisch nicht angezeigt war. Das mittlere Alter lag bei 38,4 Jahren, 38,8 % der Patienten waren Frauen. Bei Behandlungsbeginn betrug der mittlere EASI-Score 33,1, die durchschnittliche betroffene Körperoberfläche 55,7, der wöchentliche Durchschnittswert gemäss Pruritus NRS 6,4, der mittlere SCORAD 67,2 und der mittlere DLQI 13,8.
Primärer Endpunkt war der Anteil der Patienten mit einem EASI-75 in Woche 16.
In Tabelle 8 sind sowohl die primären als auch die sekundären Endpunkte der 16-wöchigen CAFE-Studie zusammengefasst.
Tabelle 8: Ergebnisse der primären und sekundären Endpunkte der CAFE-Studie
|
|
Placebo + TCS
|
Dupilumab
300 mg Q2W + TCS
| |
Randomisierte Patienten
|
108
|
107
| |
EASI-75, Responder (in %)
|
29,6 %
|
62,6 %
| |
EASI, mittlere prozentuale Veränderung (LS) gegenüber den Ausgangswerten (+/– SE)
|
-46,6
(2,76)
|
-79,8
(2,59)
| |
Wert gemäss Pruritus NRS, mittlere prozentuale Veränderung (LS) gegenüber den Ausgangswerten (+/– SE)
|
-25,4 % (3,39)
|
-53,9 % (3,14)
| |
SCORAD, mittlere prozentuale Veränderung (LS) gegenüber den Ausgangswerten (+/– SE)
|
-29,5 % (2,55)
|
-62,4 % (2,48)
| |
DLQI, mittlere Veränderung (LS) gegenüber den Ausgangswerten (SE)
|
-4,5
(0,49)
|
-9,5
(0,46)
|
In der Patientenuntergruppe der 52-wöchigen CHRONOS-Studie, die der Studienpopulation der CAFE-Studie ähnelte, erreichten bis Woche 16 69,6 % der mit Dupilumab 300 mg Q2W behandelten Patienten ein EASI-75-Ansprechen, während es bei den mit Placebo behandelten Patienten 18,0 % waren. Bis Woche 52 erreichten 52,4 % der mit Dupilumab 300 mg Q2W behandelten Patienten ein EASI-75-Ansprechen gegenüber 18,6 % in der Placebo-Gruppe. In dieser Untergruppe lag die mittlere prozentuale Veränderung des Pruritus NRS-Werts von der Baseline bis Woche 16 bei –51,4 % unter Dupilumab 300 mg Q2W und bei –30,2 % unter Placebo, beziehungsweise bis Woche 52 bei –54,8 % in der Gruppe mit Dupilumab 300 mg Q2W und bei –30,9 % in der Placebo-Gruppe.
Aufrechterhaltung und Dauer des Ansprechens (Studie SOLO CONTINUE)
Um Aufrechterhaltung und Dauer des Ansprechens zu untersuchen, wurden die Studienteilnehmer, die in den Studien SOLO 1 und SOLO 2 16 Wochen lang mit Dupilumab behandelt wurden und einen IGA-Wert von 0 oder 1 oder ein EASI-75-Ansprechen erreichten, im Rahmen der Studie SOLO CONTINUE erneut randomisiert. Diese Studie umfasste eine zusätzliche 36-wöchige Behandlung mit Dupilumab oder Placebo, sodass sich die Gesamtdauer der Studienbehandlung auf 52 Wochen belief. Die Beurteilung der Endpunkte erfolgte in Woche 51 oder 52.
Die co-primären Endpunkte waren der Unterschied zwischen der Baseline (Woche 0) und Woche 36 gemessen an der prozentualen Veränderung des EASI-Score gegenüber der Baseline der Studien SOLO 1 und SOLO 2 sowie der prozentuale Anteil an Patienten mit einem EASI-75-Ansprechen in Woche 36 bei Patienten, die bereits bei Behandlungsbeginn ein EASI-75-Ansprechen hatten.
Bei Patienten, die dasselbe Behandlungsschema beibehielten, mit dem sie in den Studien SOLO 1 und SOLO 2 behandelt worden waren (300 mg Q2W oder 300 mg QW), konnte ein optimaler Erhaltungseffekt des klinischen Ansprechens nachgewiesen werden, wohingegen sich die Wirksamkeit bei anderen Dosierungsschemata dosisabhängig verringerte.
Sowohl die primären als auch die sekundären Endpunkte der 52-wöchigen Studie SOLO CONTINUE sind in Tabelle 9 zusammengefasst.
Tabelle 9: Ergebnisse der primären und sekundären Endpunkte der Studie SOLO CONTINUE
|
|
Placebo
|
Dupilumab 300 mg
| |
|
n = 83
|
Q8W
n = 84
|
Q2W/QW
n = 169
| |
Co-primäre Endpunkte
| |
Mittlerer Unterschied (LS) (+/– SE) zwischen der Baseline und Woche 36 in prozentualer EASI-Veränderung gegenüber der Baseline der Vorläufer-Studien
|
21,7
(3,13)
|
6,8***
(2,43)
|
0,1***
(1,74)
| |
Prozentualer Anteil an Patienten mit EASI-75-Ansprechen in Woche 36 bei Patienten mit EASI-75-Ansprechen bei der Baseline (n [%])
|
24/79
(30,4 %)
|
45/82*
(54,9 %)
|
116/162***
(71,6 %)
| |
Wichtige sekundäre Endpunkte:
| |
Prozentualer Anteil an Patienten, deren IGA-Wert in Woche 36 um nicht mehr als 1 Punkt vom Baseline-Wert abwich, unter den Patienten mit IGA 0 oder 1 bei der Baseline (n [%])
|
18/63
(28,6)
|
32/64†
(50,0)
|
89/126***
(70,6)
| |
Prozentualer Anteil an Patienten mit einem IGA-Wert von 0 oder 1 in Woche 36 unter den Patienten mit IGA von 0 oder 1 bei der Baseline (n [%])
|
9/63
(14,3)
|
21/64†
(32,8)
|
68/126***
(54,0)
| |
Prozentualer Anteil an Patienten, deren maximaler Pruritus NRS-Wert von der Baseline bis Woche 35 um ≥3 Punkte anstieg, unter den Patienten mit einem maximalen Baseline-Pruritus NRS-Wert ≤7 (n [%])
|
56/80
(70,0)
|
45/81
(55,6)
|
57/168***
(33,9)
|
† p < 0,05; *p < 0,01; **p < 0,001; ***p ≤0,0001
In der Studie SOLO CONTINUE wurde bei verlängerten Dosierungsintervallen eine Tendenz zu einer behandlungsbedingten stärkeren Produktion von Antikörpern gegen den Wirkstoff (Anti-Drug Antibodies, ADA) beobachtet.
Behandlungsbedingte ADA-Reaktionen: QW: 1,2 %; Q2W: 4,3 %; Q4W: 6,0 %; Q8W: 11,7 %. ADA-Reaktionen, die länger als 12 Wochen andauerten: QW: 0,0 %; Q2W: 1,4 %; Q4W: 0,0 %; Q8W: 2,6 %.
Lebensqualität / von Patienten berichtete Ergebnisse (Patient Reported Outcomes, PRO)
In den Studien SOLO 1 und SOLO 2 wurde mit Dupilumab im Vergleich zu Placebo gemäss der POEM-, der DLQI- und der HADS-Gesamtbewertung jeweils eine signifikante Verbesserung der Symptome der atopischen Dermatitis (AD), der gesundheitsbezogenen Lebensqualität sowie der Angst- und Depressionssymptome erzielt.
In der CHRONOS-Studie wurde mit Dupilumab im Vergleich zu Placebo gemäss der POEM- und der DLQI-Gesamtbewertung nach 16 Wochen jeweils eine signifikante Verbesserung der Symptome der AD und der gesundheitsbezogenen Lebensqualität erzielt.
In den Studien SOLO 1 und SOLO 2 waren die mittleren Veränderungen (± SE) der Least Squares der POEM-, der DLQI- und der HADS-Gesamtbewertung von der Baseline bis Woche 16 bei Patienten, die Dupilumab erhielten, signifikant höher als bei Placebo-Patienten (p < 0,0001 für alle Vergleiche ausser HADS in der Studie SOLO 2, p < 0,001), siehe Tabelle 10.
In der Studie CHRONOS waren die mittleren Veränderungen (± SE) der Least Squares der POEM- und der DLQI-Gesamtbewertung von der Baseline bis Woche 16 bei Patienten, die Dupilumab erhielten, signifikant höher als bei Placebo-Patienten (p < 0,0001 für alle Vergleiche), siehe Tabelle 10.
Tabelle 10: Zusätzliche Ergebnisse des sekundären Endpunkts der Dupilumab-Behandlung mit oder ohne TCS in Woche 16
|
|
Monotherapie in Woche 16
|
Begleitende Therapie mit TCS in Woche 16
| |
|
SOLO 1
|
SOLO 2
|
CHRONOS
| |
|
Placebo
|
Dupilumab
300 mg Q2W
|
Placebo
|
Dupilumab
300 mg Q2W
|
Placebo
|
Dupilumab
300 mg Q2W
| |
Randomisierte Patienten
|
224
|
224
|
236
|
233
|
315
|
106
| |
POEM, mittlere Veränderung (LS) gegenüber der Baseline (SE)
|
-5,1
(0,67)
|
-11,6a
(0,49)
|
-3,3
(0,55)
|
-10,2a
(0,49)
|
-5,3
(0,41)
|
-12,7a
(0,64)
| |
DLQI, mittlere Veränderung (LS) gegenüber der Baseline (SE)
|
-5,3
(0,50)
|
-9,3a
(0,40)
|
-3,6
(0,50)
|
-9,3a
(0,38)
|
-5,8
(0,34)
|
-10,0a
(0,50)
|
LS = Least Squares [Methode der kleinsten Quadrate]; SE = Standard Error [Standardfehler]
a p < 0,0001
Klinische Wirksamkeit und Sicherheit bei Jugendlichen mit atopischer Dermatitis:
Die Wirksamkeit und Sicherheit einer Monotherapie mit Dupilumab bei Jugendlichen wurden in einer multizentrischen, randomisierten, doppelblinden, placebokontrollierten Studie (AD-1526) bei 251 jugendlichen Patienten von 12 bis 17 Jahren mit mittelschwerer bis schwerer atopischer Dermatitis (AD) beurteilt. Diese wurde definiert als ein Wert ≥3 gemäss IGA (Investigator's Global Assessment) bei der Gesamtbeurteilung der AD-Läsionen auf einer Schweregrad-Skala von 0 bis 4, ein Wert ≥16 gemäss EASI (Eczema Area and Severity Index) auf einer Skala von 0 bis 72 und eine betroffene Körperoberfläche (Body Surface Area, BSA) ≥10 %. Patienten, die für die Studie geeignet waren und in diese eingeschlossen wurden, hatten zuvor nur unzureichend auf eine topische Medikation angesprochen.
Die Patienten erhielten:
1.eine Anfangsdosis von 400 mg Dupilumab (zwei Injektionen zu je 200 mg) an Tag 1, gefolgt von 200 mg einmal alle zwei Wochen (Q2W), bei einem Ausgangsgewicht von < 60 kg oder eine Anfangsdosis von 600 mg Dupilumab (zwei Injektionen zu je 300 mg) an Tag 1, gefolgt von 300 mg Q2W, bei einem Ausgangsgewicht von ≥60 kg;
2.eine Anfangsdosis von 600 mg Dupilumab (zwei Injektionen zu je 300 mg) an Tag 1, gefolgt von 300 mg alle 4 Wochen (Q4W), unabhängig vom Ausgangsgewichtoder
3.ein entsprechendes Placebo.
Dupilumab wurde als subkutane (s. c.) Injektion verabreicht. Um als unerträglich empfundene Symptome der atopischen Dermatitis zu lindern, konnten die Patienten nach Ermessen des Prüfarztes eine Rescue-Therapie erhalten. Patienten, die eine Rescue-Therapie erhielten, wurden als Non-Responder eingestuft.
In dieser Studie betrug das mittlere Alter 14,5 Jahre, das mediane Körpergewicht 59,4 kg, 41,0 % der Patienten waren weiblich, 62,5 % Weisse, 15,1 % Asiaten und 12,0 % Schwarze. Zu Studienbeginn hatten 46,2 % der Patienten einen Baseline-IGA-Wert von 3 (mittelschwere AD), 53,8 % einen Baseline-IGA-Wert von 4 (schwere AD), die mittlere BSA-Beteiligung betrug 56,5 %, und 42,4 % der Patienten hatten in der Vergangenheit systemische Immunsuppressiva erhalten. Bei der Aufnahme in die Studie betrug der mittlere EASI-Wert 35,5, der wöchentliche Durchschnittswert gemäss Pruritus NRS (Numeral Rating Scale) 7,6, der mittlere SCORAD (SCORing Atopic Dermatitis)-Wert 70,3, der mittlere POEM (Patient Oriented Eczema Measure)-Wert 21,0 und der mittlere CDLQI (Children Dermatology Life Quality Index)-Wert 13,6. Insgesamt lag bei 92,0 % der Patienten mindestens eine allergische Begleiterkrankung vor; 65,6 % hatten allergische Rhinitis, 53,6 % Asthma und 60,8 % Nahrungsmittelallergien.
Co-primäre Endpunkte waren der Anteil der Patienten mit IGA 0 oder 1 mit einer Verbesserung um mindestens 2 Punkte und der Anteil der Patienten mit EASI-75 (EASI-Verbesserung um mindestens 75 %) zwischen Baseline und Woche 16. Die weiteren beurteilten Endpunkte umfassten den Anteil der Patienten mit EASI-50 bzw. EASI-90 (EASI-Verbesserung von mindestens 50 % bzw. 90 % gegenüber Baseline), die Verringerung des Juckreizes gemäss Peak Pruritus NRS und die prozentuale Veränderung auf der SCORAD-Skala zwischen Baseline und Woche 16. Zusätzliche sekundäre Endpunkte beinhalteten die mittlere Veränderung des POEM- und CDLQI-Scores zwischen Baseline und Woche 16.
Klinische Wirksamkeit
Die Wirksamkeitsergebnisse aus Woche 16 der Studie für atopische Dermatitis bei Jugendlichen sind in der folgenden Tabelle 11 angegeben.
Tabelle 11: Wirksamkeitsergebnisse der Dupilumab-Therapie aus Woche 16 der Studie für atopische Dermatitis bei Jugendlichen (FAS)
|
|
AD-1526 (FAS)a
| |
|
Placebo
|
Dupilumab 200 mg (< 60 kg) und 300 mg (≥60 kg) Q2W
| |
Randomisierte Patienten
|
85a
|
82a
| |
IGA 0 oder 1b, % Responderc
|
2,4 %
|
24,4 %
| |
EASI-50, % Responderc
|
12,9 %
|
61,0 %
| |
EASI-75, % Responderc
|
8,2 %
|
41,5 %
| |
EASI-90, % Responderc
|
2,4 %
|
23,2 %
| |
EASI, mittlere LS-Veränderung in % gegenüber Baseline (+/- SE)
|
-23,6 %
(5,49)
|
-65,9 %
(3,99)
| |
SCORAD, mittlere LS-Veränderung in % gegenüber Baseline (+/- SE)
|
-17,6 %
(3,76)
|
-51,6 %
(3,23)
| |
Pruritus NRS, mittlere LS-Veränderung in % gegenüber Baseline (+/- SE)
|
-19,0 %
(4,09)
|
-47,9 %
(3,43)
| |
Pruritus NRS (> 4 Punkte Verbesserung), % Responderc
|
4,8 %
|
36,6 %
| |
BSA, mittlere LS-Veränderung in % gegenüber Baseline (+/- SE)
|
-11,7 %
(2,72)
|
-30,1 %
(2,34)
| |
CDLQI, mittlere LS-Veränderung in % gegenüber Baseline (+/- SE)
|
-5,1
(0,62)
|
-8,5
(0,50)
| |
CDLQI (≥6 Punkte Verbesserung), % Responder
|
19,7 %
|
60,6 %
| |
POEM, mittlere LS-Veränderung in % gegenüber Baseline (+/- SE)
|
-3,8
(0,96)
|
-10,1
(0,76)
| |
POEM (≥ 6 Punkte Verbesserung), % Responder
|
9,5 %
|
63,4 %
|
a Die FAS- (Full Analysis Set [Gesamtanalyse-Datensatz]) Population umfasst alle randomisierten Patienten.
b Responder wurde definiert als ein Patient mit IGA 0 oder 1 («erscheinungsfrei» oder «fast erscheinungsfrei») mit einer Verbesserung um ≥2 Punkte auf einer von 0 bis 4 reichenden IGA-Skala.
c Patienten, die eine Rescue-Therapie erhielten oder bei denen Daten fehlten, wurden als Non-Responder eingestuft (58,8 % im Placebo-Arm und 20,7 % im Dupixent-Arm).
Alle p-Werte < 0,0001.
Ein grösserer Anteil der in die Placebo-Gruppe randomisierten Patienten benötigte eine Rescue-Therapie (topische Kortikosteroide, systemische Kortikosteroide oder systemische nichtsteroidale Immunsuppressiva) im Vergleich zur Dupilumab-Gruppe (58,8 % bzw. 20,7 %).
Im Vergleich zu Placebo erreichte ein signifikant höherer Anteil der in die Dupilumab-Gruppe randomisierten Patienten eine schnelle Verbesserung gemäss Pruritus NRS (definiert als Verbesserung um > 4 Punkte bereits in Woche 4; nominaler p-Wert < 0,001); im Laufe des Behandlungszeitraums stieg der Patientenanteil mit einem Ansprechen gemäss Pruritus NRS weiterhin an (siehe Abbildung 5 unten). Die Verbesserung gemäss Pruritus NRS trat im Zusammenhang mit einer Verbesserung der objektiven Anzeichen der atopischen Dermatitis auf.
Abbildung 5: Anteil der Jugendlichen mit einer Verbesserung um ≥4 Punkte gemäss Pruritus NRS in der AD-1526-Studie (FAS)b
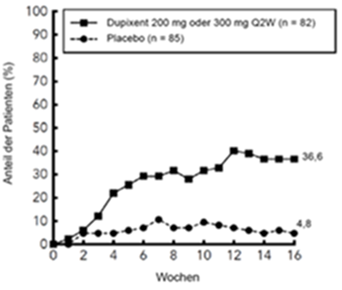
a In den Primäranalysen der Wirksamkeitsendpunkte wurden Patienten, die eine Rescue-Therapie erhielten oder bei denen Daten fehlten, als Non-Responder eingestuft.
b Die FAS-(Full Analysis Set [Gesamtanalyse-Datensatz])Population umfasst alle randomisierten Patienten.
Im Vergleich zu Placebo wurde in der Dupilumab-Gruppe in Woche 16 eine signifikante Verbesserung der von Patienten angegebenen Symptome verzeichnet. Dies galt auch für die Auswirkungen der AD auf die Schlafqualität und die gesundheitsbezogene Lebensqualität gemäss den POEM-, SCORAD- und CDLQI-Werten.
Die langfristige Wirksamkeit von Dupilumab bei Jugendlichen mit mittelschwerer bis schwerer AD, die an den vorherigen klinischen Studien mit Dupilumab teilgenommen hatten, wurde in einer unverblindeten Verlängerungsstudie (AD-1434) untersucht. Wirksamkeitsdaten aus dieser Studie weisen darauf hin, dass der in Woche 16 erzielte klinische Nutzen bis einschliesslich Woche 52 anhielt.
Klinische Wirksamkeit und Sicherheit bei Kindern (6 bis 11 Jahre) mit atopischer Dermatitis
Die Wirksamkeit und Sicherheit der Anwendung von Dupilumab in Kombination mit TCS bei pädiatrischen Patienten wurden in einer multizentrischen, randomisierten, doppelblinden, placebokontrollierten Studie (AD-1652) mit 367 Patienten im Alter von 6 bis 11 Jahren untersucht. Atopische Dermatitis wurde dabei definiert als ein Wert von 4 gemäss IGA (Skala von 0 bis 4), ein Wert ≥21 gemäss EASI (Skala von 0 bis 72) und eine betroffene Körperoberfläche (Body Surface Area, BSA) von ≥15 %. Patienten, die für die Studie geeignet waren und in diese eingeschlossen wurden, hatten zuvor nur unzureichend auf eine topische Medikation angesprochen. Die Rekrutierung erfolgte stratifiziert nach Ausgangsgewicht (< 30 kg; ≥30 kg).
Patienten in der Gruppe Dupilumab Q4W + TCS erhielten unabhängig vom Gewicht eine Anfangsdosis von 600 mg an Tag 1, gefolgt von 300 mg Q4W von Woche 4 bis Woche 12. Patienten in der Gruppe Dupilumab Q2W + TCS mit einem Ausgangsgewicht von < 30 kg erhielten eine Anfangsdosis von 200 mg an Tag 1, gefolgt von 100 mg Q2W von Woche 2 bis Woche 14; Patienten mit einem Ausgangsgewicht von ≥30 kg erhielten eine Anfangsdosis von 400 mg an Tag 1, gefolgt von 200 mg Q2W von Woche 2 bis Woche 14. Die Patienten konnten nach Ermessen des Prüfarztes eine Rescue-Therapie erhalten. Patienten, die eine Rescue-Therapie erhielten, wurden als Non-Responder eingestuft.
In der Studie AD-1652 betrug das mittlere Alter 8,5 Jahre, das mediane Körpergewicht 29,8 kg, 50 % der Patienten waren weiblich, 69,2 % Weisse, 16,7 % Schwarze und 7,6 % Asiaten. Zu Beginn betrug die mittlere BSA-Beteiligung 57,6 %, und 16,9 % hatten in der Vergangenheit bereits systemische nichtsteroidale Immunsuppressiva erhalten. Zu Beginn betrug der mittlere EASI-Score 37,9, der wöchentliche Durchschnittswert des täglich stärksten Juckreizes lag bei 7,8 auf einer Skala von 0 bis 10, der mittlere SCORAD bei der Baseline betrug 73,6, der mittlere POEM 20,9 und der mittlere CDLQI 15,1. Insgesamt lag bei 91,7 % der Patienten mindestens eine allergische Begleiterkrankung vor; 64,4 % hatten Nahrungsmittelallergien, 62,7 % andere Allergien, 60,2 % allergische Rhinitis und 46,7 % Asthma.
Primärer Endpunkt war der Anteil der Patienten mit IGA 0 («erscheinungsfrei») oder 1 («fast erscheinungsfrei») in Woche 16. Die weiteren untersuchten Resultate umfassten den Anteil der Patienten mit EASI-75 bzw. EASI-90 (EASI-Verbesserung von mindestens 75 % bzw. 90 % gegenüber Baseline), die prozentuale Veränderung des EASI-Scores zwischen Baseline und Woche 16 sowie die Verringerung des Juckreizes gemäss Pruritus NRS (Verbesserung um ≥4 Punkte). Zusätzliche sekundäre Endpunkte beinhalteten die mittlere Veränderung des POEM- und CDLQI-Scores zwischen Baseline und Woche 16.
Tabelle 12 zeigt die nach Ausgangsgewicht stratifizierten Ergebnisse für die zugelassenen Dosierungsschemata.
Tabelle 12: Wirksamkeitsergebnisse von DUPIXENT mit begleitenden TCS in der Studie AD-1652 in Woche 16 (FAS)a
|
|
DUPIXENT
300 mg Q4Wd
+ TCS
(n = 61)
|
Placebo
+ TCS
(n = 61)
|
DUPIXENT
200 mg Q2We
+ TCS
(n = 59)
|
Placebo
+ TCS
(n = 62)
| |
< 30 kg
|
< 30 kg
|
≥30 kg
|
≥30 kg
| |
IGA 0 oder 1 b, % Responderc
|
29,5 %
|
13,1 %
|
39,0 %
|
9,7 %
| |
EASI-50, % Responderc
|
95,1 %
|
42,6 %
|
86,4 %
|
43,5 %
| |
EASI-75, % Responderc
|
75,4 %
|
27,9 %
|
74,6 %
|
25,8 %
| |
EASI-90, % Responderc
|
45,9 %
|
6,6 %
|
35,6 %
|
8,1 %
| |
EASI, mittlere LS-Veränderung in % gegenüber Baseline (+/- SE)
|
-84,3 %
(3,08)
|
-49,1 %
(3,30)
|
-80,4 %
(3,61)
|
-48,3 %
(3,63)
| |
SCORAD, mittlere LS-Veränderung in % gegenüber Baseline (+/- SE)
|
-65,3 %
(2,87)
|
-28,9 %
(3,05)
|
-62,7 %
(3,14)
|
-30,7 %
(3,28)
| |
Pruritus NRS, mittlere LS-Veränderung in % gegenüber Baseline (+/- SE)
|
-55,1 %
(3,94)
|
-27,0 %
(4,24)
|
-58,2 %
(4,01)
|
-25,0 %
(3,95)
| |
Pruritus NRS (≥4 Punkte Verbesserung), % Responderc
|
54,1 %
|
11,7 %
|
61,4 %
|
12,9 %
| |
CDLQI, mittlere LS-Veränderung gegenüber Baseline (+/- SE)
|
-11,5
(0,69)
|
-7,2
(0,76)
|
-9,8
(0,63)
|
-5,6
(0,66)
| |
CDLQI (≥6 Punkte Verbesserung), % Responder
|
81,8 %
|
48,3 %
|
80,8 %
|
35,8 %
| |
POEM, mittlere LS-Veränderung gegenüber Baseline (+/- SE)
|
-14,0
(0,95)
|
-5,9
(1,04)
|
-13,6
(0,90)
|
-4,7
(0,91)
|
a Die FAS-(Full Analysis Set [Gesamtanalyse-Datensatz])Population umfasst alle randomisierten Patienten.
b Responder wurde definiert als ein Patient mit IGA 0 oder 1 («erscheinungsfrei» oder «fast erscheinungsfrei»).
c Patienten, die eine Rescue-Therapie erhielten oder bei denen Daten fehlten, wurden als Non-Responder eingestuft.
d An Tag 1 erhielten die Patienten 600 mg Dupilumab.
e An Tag 1 erhielten die Patienten 200 mg (Ausgangsgewicht < 30 kg) oder 400 mg (Ausgangsgewicht ≥30 kg) DUPIXENT.
Im Vergleich zu Placebo + TCS erreichte ein grösserer Anteil an Patienten, die randomisiert Dupilumab + TCS erhielten, eine Verbesserung gemäss Pruritus NRS (definiert als Verbesserung ≥4 Punkte in Woche 16). Siehe Abbildung 6.
Abbildung 6: Anteil der pädiatrischen Patienten mit einer Verbesserung um ≥4 Punkte auf der Pruritus NRS in Woche 16 der Studie AD-1652a (FAS)b
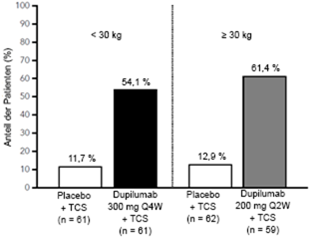
a In den Primäranalysen der Wirksamkeitsparameter wurden Patienten, die eine Rescue-Therapie erhielten oder bei denen Daten fehlten, als Non-Responder eingestuft.
b Die FAS- (Full Analysis Set [Gesamtanalyse-Datensatz]) Population umfasst alle randomisierten Patienten.
Im Vergleich zu Placebo wurde in der Dupilumab-Gruppe in Woche 16 eine signifikante Verbesserung der von Patienten angegebenen Symptome verzeichnet. Dies galt auch für die Auswirkungen der AD auf die Schlafqualität und die gesundheitsbezogene Lebensqualität gemäss den POEM-, SCORAD- und CDLQI-Werten.
Die langfristige Wirksamkeit von Dupilumab + TCS bei pädiatrischen Patienten mit atopischer Dermatitis, die an den vorherigen klinischen Studien mit Dupilumab + TCS teilgenommen hatten, wurde in einer unverblindeten Verlängerungsstudie (AD-1434) untersucht. In dieser Studie zeigten die in Woche 52 verfügbaren nicht kontrollierten Daten zu 45 Patienten, dass der Anteil der Patienten mit klinisch bedeutsamen IGA- oder EASI-Verbesserungen im Laufe der Zeit stabil blieb.
Klinische Wirksamkeit und Sicherheit bei Kindern (6 Monate bis 5 Jahre) mit atopischer Dermatitis
Die Wirksamkeit und Sicherheit der Anwendung von Dupilumab in Kombination mit TCS bei pädiatrischen Patienten wurden in einer multizentrischen, randomisierten, doppelblinden, placebokontrollierten Studie (AD-1539) bei 162 Patienten im Alter von 6 Monaten bis 5 Jahren mit mittelschwerer bis schwerer atopischer Dermatitis untersucht. Mittelschwere bis schwere atopische Dermatitis wurde dabei definiert als ein Wert von ≥3 gemäss IGA (Skala von 0 bis 4), ein Wert ≥16 gemäss EASI (Skala von 0 bis 72) und eine betroffene Körperoberfläche (Body Surface Area, BSA) von ≥10 %. Patienten, die für die Studie geeignet waren und in diese eingeschlossen wurden, hatten zuvor nur unzureichend auf eine topische Medikation angesprochen. Die Rekrutierung erfolgte stratifiziert nach Ausgangsgewicht (≥5 bis < 15 kg und ≥15 bis < 30 kg).
Patienten in der Gruppe Dupilumab Q4W + TCS mit einem Ausgangsgewicht von ≥5 bis < 15 kg erhielten eine Anfangsdosis von 200 mg an Tag 1, gefolgt von 200 mg Q4W von Woche 4 bis Woche 12; Patienten mit einem Ausgangsgewicht von ≥15 bis < 30 kg erhielten eine Anfangsdosis von 300 mg an Tag 1, gefolgt von 300 mg Q4W von Woche 4 bis Woche 12. Die Patienten konnten nach Ermessen des Prüfarztes eine Rescue-Therapie erhalten. Patienten, die eine Rescue-Therapie erhielten, wurden als Non-Responder eingestuft.
In der Studie AD-1539 betrug das mittlere Alter 3,8 Jahre, das mediane Körpergewicht 16,5 kg, 38,9 % der Patienten waren weiblich, 68,5 % Weisse, 18,5 % Schwarze und 6,2 % Asiaten. Zu Beginn betrug der mittlere EASI-Score 34,1, 22,8 % hatten einen IGA-Wert von 3 und 77,2 % einen IGA-Wert von 4.
Primärer Endpunkt war der Anteil der Patienten mit IGA 0 («erscheinungsfrei») oder 1 («fast erscheinungsfrei») in Woche 16 und die wichtigsten sekundären Hauptendpunkte umfassten den Anteil der Patienten mit EASI-75 (EASI-Verbesserung von mindestens 75 % gegenüber Baseline).
Klinisches Ansprechen
Die Wirksamkeitsergebnisse der Woche 16 für die Studie AD-1539 sind in der Tabelle 13 dargestellt.
Tabelle 13: Wirksamkeitsergebnisse von DUPIXENT mit begleitenden TCS in der Studie AD-1539 in Woche 16 (FAS)abei pädiatrischen Patienten im Alter von 6 Monaten bis 5 Jahren mit mittelschwerer bis schwerer atopischer Dermatitis
|
|
DUPIXENT
200 mg (5 bis < 15 kg) oder 300 mg (15 bis < 30 kg) Q4Wd
+ TCS
(n = 83)a
|
Placebo
+ TCS
(n = 79)a
| |
IGA 0 oder 1b,c
|
27,7 %
|
3,9 %
| |
EASI-50, % Responderc
|
68,7 %
|
20,2 %
| |
EASI-75c
|
53,0 %
|
10,7 %
| |
EASI-90c
|
25,3 %
|
2,8 %
| |
EASI, mittlere LS-Veränderung in % gegenüber Baseline (+/- SE)
|
-70,0 %e
(4,85)
|
-19,6 %
(5,13)
| |
SCORAD, mittlere LS-Veränderung in % gegenüber Baseline (+/- SE)
|
-54,7 %e
(3,39)
|
-16,2 %
(3,54)
| |
Pruritus NRS, mittlere LS-Veränderung in % gegenüber Baseline (+/- SE)
|
-49,4 %e
(5,03)
|
-2,2 %
(5,22)
| |
Pruritus NRS (≥4 Punkte Verbesserung), % Responderc
|
48,1 %
|
8,9 %
| |
Schlafqualität NRS, mittlere LS-Veränderung in % gegenüber Baseline (+/- SE)*
|
2,0e
(0,25)
|
0,3
(0,26)
| |
Hautschmerzen NRS, mittlere LS-Veränderung in % gegenüber Baseline (+/- SE)*
|
-3,9e
(0,30)
|
-0,6
(0,30)
| |
POEM, mittlere LS-Veränderung gegenüber Baseline (+/- SE)*
|
-12,9e
(0,89)
|
-3,8
(0,92)
|
a Die FAS-(Full Analysis Set [Gesamtanalyse-Datensatz])Population umfasst alle randomisierten Patienten.
b Responder wurde definiert als ein Patient mit IGA 0 oder 1 («erscheinungsfrei» oder «fast erscheinungsfrei»).
c Patienten, die eine Rescue-Therapie erhielten (62,8 % und 19 % in der Placebo- bzw. Dupixent-Gruppe) oder bei denen Daten fehlten, wurden als Non-Responder eingestuft.
d An Tag 1 erhielten die Patienten 200 mg (5 bis < 15 kg) oder 300 mg (15 bis < 30 kg) DUPIXENT
e Werte von p < 0,0001
*Vom Pflegeperson berichtetes Ergebnis
Im Vergleich zu Placebo + TCS erreichte ein grösserer Anteil an Patienten, die randomisiert Dupilumab + TCS erhielten, eine Verbesserung gemäss Pruritus NRS (definiert als Verbesserung ≥4 Punkte ab Woche 3, nominaler p-Wert < 0,005), und der Anteil der Patienten, die gemäss Pruritus NRS ansprachen, stieg während der gesamten Behandlung weiter an (siehe Abbildung 7).
Abbildung 7: Anteil der pädiatrischen Patienten im Alter von 6 Monaten bis 5 Jahren mit einer Verbesserung um ≥4 Punkte auf der Pruritus NRS in Woche 16 der Studie AD-1539 (FAS)b
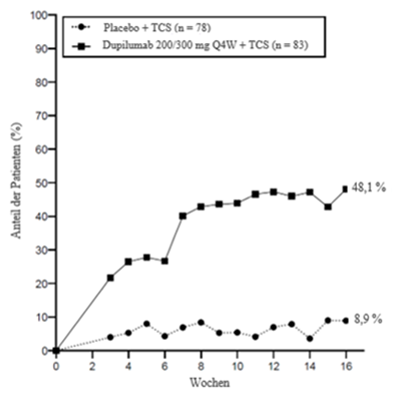
Die langfristige Wirksamkeit und Sicherheit von Dupilumab + TCS bei pädiatrischen Patienten mit mittelschwerer bis schwerer atopischer Dermatitis, die an den vorherigen klinischen Studien mit Dupilumab + TCS teilgenommen hatten, wurde in einer unverblindeten Verlängerungsstudie (AD-1434) untersucht. In dieser Studie zeigen die Wirksamkeitsdaten, dass die in Woche 16 erreichten klinischen Verbesserungen bis Woche 52 anhalten. Das Sicherheitsprofil von Dupilumab bei den Patienten, die bis Woche 52 nachbeobachtet wurden, war vergleichbar mit dem Sicherheitsprofil, das in Woche 16 in der Studie AD-1539 beobachtet wurde.
Atopische Dermatitis der Hände und Füsse
Die Wirksamkeit und Sicherheit von Dupilumab wurde in einer 16-wöchigen multizentrischen, randomisierten, doppelblinden, placebokontrollierten Parallelgruppenstudie (AD-1924) mit 106 erwachsenen und 27 pädiatrischen Patienten im Alter von 12 bis 17 Jahren mit mittelschwerer bis schwerer atopischer Dermatitis der Hände und Füsse, definiert durch einen IGA-Score (Hände und Füsse) ≥3 (auf einer Skala von 0 bis 4) und einen Score für den maximalen Pruritus ≥4 (auf einer Skala von 0 bis 10) auf der numerischen Bewertungsskala für den maximalen Pruritus (NRS) der Hände und Füsse, untersucht. Die geeigneten Patienten hatten zuvor nur unzureichend auf die topische Behandlung der atopischen Dermatitis der Hände und Füsse angesprochen oder haben diese nicht vertragen.
Zu Beginn der Studie waren 38 % der Patienten männlich, 80 % waren weiss, 72 % der Patienten hatten beim Studieneinschluss einen IGA-Score (Hände und Füsse) von 3 (mittelschwere atopische Dermatitis der Hände und Füsse) und 28 % der Patienten hatten beim Studieneinschluss einen IGA-Score (Hände und Füsse) von 4 (schwere atopische Dermatitis der Hände und Füsse). Der wöchentliche Durchschnittswert gemäss Pruritus NRS der Hände und Füsse betrug bei Studieneinschluss 7,1.
Der primäre Endpunkt war der Anteil der Patienten mit einem IGA-Score für Hände und Füsse von 0 («erscheinungsfrei») oder 1 («fast erscheinungsfrei») in der Woche 16. Der wichtigste sekundäre Endpunkt war die Verringerung des Juckreizes gemessen an der numerischen Bewertungsskala für den maximalen Pruritus der Hände und Füsse (Verbesserung um ≥4 Punkte). Die anderen Patienten-berichtete Endpunkte umfassten Hautschmerzen NRS (0–10) der Hände und Füsse, Schlafqualität NRS (0–10), den Wert für die Lebensqualität im Fragebogen zu Handekzem (0–117) (QoLHEQ) sowie den Score für die Arbeitsproduktivität und die Beeinträchtigung von Aktivitäten (WPAI) (0–100 %).
Der Anteil an Patienten mit einem IGA (Hände und Füsse) von 0 («erscheinungsfrei») oder 1 («fast erscheinungsfrei») in der Woche 16 betrug 40,3 % bei Dupilumab und 16,7 % beim Placebo (Behandlungsunterschied 23,6 %; 95 %-KI: 8,84; 38,42; p-Wert = 0,0030). Der Anteil an Patienten mit Verbesserung (Verringerung) des wöchentlichen Durchschnittswerts gemäss Pruritus NRS der Hände und Füsse ≥4 in der Woche 16 betrug 52,2 % bei Dupilumab und 13,6 % beim Placebo (Behandlungsunterschied 38,6 %; 95 %-KI: 24,06; 53,15; p-Wert = 0,0001).
In der Dupilumab-Gruppe wurden grössere Verbesserungen des Hautschmerzen NRS für Hände und Füsse, des Schlafqualität NRS, des QoLHEQ-Scores für die Arbeitsproduktivität und die Beeinträchtigung von Aktivitäten zwischen Studieneinschluss und Woche 16 im Vergleich zur Placebo-Gruppe beobachtet (mittlerer LS-Unterschied von Dupilumab im Vergleich zum Placebo: -4,66 vs. -1,93 (p < 0,0001); 0,88 vs. -0,00 (p < 0,05); -40,28 vs. -16,18 (p < 0,0001); -38,57 % vs. -22,83 % (nominaler p-Wert < 0,001) und -36,39 % vs. -21,26 % (nominaler p-Wert < 0,001)).
2) Asthma
Klinische Wirksamkeit und Sicherheit bei Erwachsenen und Jugendlichen mit Asthma:
Das Entwicklungsprogramm zu Asthma beinhaltete drei randomisierte, doppelblinde, placebokontrollierte, multizentrische Parallelgruppenstudien (DRI12544, QUEST und VENTURE) mit 24- bis 52-wöchiger Behandlungsdauer, in die insgesamt 2'888 Patienten (ab 12 Jahren) eingeschlossen wurden.
Die Patienten wurden unabhängig von ihren Eosinophilwerten im Blut bzw. ihrer FeNO- oder IgE-Konzentration aufgenommen.
In den Studien DRI12544 und QUEST umfassten die präspezifizierten Subgruppenanalysen Eosinophil-(EOS-)Werte im Blut von ≥150 und ≥300 Zellen/μl.
Bei DRI12544 handelte es sich um eine 24-wöchige Dosisfindungsstudie, in die 776 Patienten (ab 18 Jahren) eingeschlossen wurden. Dupilumab wurde bei erwachsenen Patienten mit mittelschwerem bis schwerem Asthma, die ein mittel- bis hochdosiertes inhalatives Kortikosteroid und ein langwirksames Beta-2-Sympathomimetikum anwendeten, im Vergleich zu Placebo beurteilt. Der primäre Endpunkt war die Veränderung des FEV1 (Liter) zwischen dem Ausgangswert und Woche 12 bei Patienten mit einem Eosinophilen-Ausgangswert ≥300 Zellen/µl. Die schweren Asthma-Exazerbationsereignisse während des 24-wöchigen placebokontrollierten Behandlungszeitraums wurden ebenfalls für einen einjährigen Zeitraum bestimmt. Die Auswertung der Ergebnisse erfolgte für die Gesamtpopulation (ohne Einschränkung des Mindestausgangswerts für Eosinophile) und die Subgruppen, die auf dem Eosinophilen-Ausgangswert im Blut beruhten.
Bei QUEST handelte es sich um eine 52-wöchige konfirmatorische Studie, in die 1'902 Patienten (ab 12 Jahren) eingeschlossen wurden. Dupilumab im Vergleich zu Placebo wurde bei 107 jugendlichen und 1'795 erwachsenen Patienten mit persistierendem Asthma, die ein mittel- bis hochdosiertes inhalatives Kortikosteroid (ICS) und ein zweites Arzneimittel als Basistherapie anwendeten, beurteilt. Patienten, die ein drittes Arzneimittel als Basistherapie benötigten, durften ebenfalls an dieser Studie teilnehmen. Nach der Randomisierung erhielten die Patienten entweder 200 mg (n = 631) oder 300 mg (n = 633) Dupilumab alle zwei Wochen (oder das entweder 200 mg (n = 317) oder 300 mg (n = 321) entsprechende Placebo alle zwei Wochen) nach einer Anfangsdosis von 400 mg bzw. 600 mg bzw. Placebo. Die primären Endpunkte waren die Jahresrate schwerer Exazerbationsereignisse während des 52-wöchigen placebokontrollierten Zeitraums und die Veränderung des FEV1 vor Anwendung eines Bronchodilatators zwischen der Baseline und Woche 12 in der Gesamtpopulation (ohne Einschränkung des Mindestausgangswerts für Eosinophile).
Die sekundären Endpunkte umfassten die Jahresrate schwerer Exazerbationsereignisse und FEV1 in den Subgruppen, die auf dem Eosinophilen-Ausgangswert im Blut beruhten.
Bei VENTURE handelte es sich um eine 24-wöchige Studie zur Reduktion von oralen Kortikosteroiden (OCS) bei 210 Asthmapatienten ohne Einschränkung der Biomarker-Ausgangswerte für die Typ-2-Inflammation, die täglich orale Kortikosteroide zusätzlich zur regelmässigen Anwendung hochdosierter inhalativer Kortikosteroide plus ein weiteres Arzneimittel als Basistherapie benötigten. Nach Optimierung der OCS-Dosis während des Screeningzeitraums erhielten die Patienten 300 mg Dupilumab (n = 103) oder Placebo (n = 107) einmal alle zwei Wochen über 24 Wochen, nach einer Anfangsdosis von 600 mg oder Placebo. Während der Studie erhielten die Patienten weiter ihre bestehende Asthmamedikation, die OCS-Dosis wurde jedoch während der OCS-Reduktionsphase (Woche 4–20) alle 4 Wochen verringert, solange die Asthmakontrolle aufrechterhalten werden konnte. Der primäre Endpunkt war die prozentuale Verringerung der oralen Kortikosteroiddosis, beurteilt in der Gesamtpopulation, beruhend auf einem Vergleich der oralen Kortikosteroiddosis in den Wochen 20 bis 24, bei der die Asthmakontrolle aufrechterhalten wurde, mit der zuvor (bei Studienbeginn) optimierten Dosis oraler Kortikosteroide in der Gesamtpopulation (ohne Einschränkung des Mindestausgangswerts für Eosinophile). Weitere sekundäre Endpunkte umfassten die Jahresrate schwerer Exazerbationsereignisse im Behandlungszeitraum und den Prozentsatz der Responder beim ACQ-5- und AQLQ-Score (S).
Die demografischen Angaben und Baseline-Charakteristika bzgl. Asthma sind für diese 3 Studien in nachfolgender Tabelle 14 dargestellt.
Tabelle 14: Demografische Angaben und Baseline-Charakteristika in den Asthma-Studien
|
Parameter
|
DRI12544
(n = 776)
|
QUEST
(n = 1'902)
|
VENTURE
(n = 210)
| |
Mittleres Alter in Jahren (SD)
|
48,6 (13,0)
|
47,9 (15,3)
|
51,3 (12,6)
| |
% weiblich
|
63,1
|
62,9
|
60,5
| |
% weiss
|
78,2
|
82,9
|
93,8
| |
Dauer des Asthmas (Jahre), Mittelwert ± SD
|
22,03 (15,42)
|
20,94 (15,36)
|
19,95 (13,90)
| |
Nie geraucht, (%)
|
77,4
|
80,7
|
80,5
| |
Mittlere Anzahl der Exazerbationen im vorherigen Jahr ± SD
|
2,17 (2,14)
|
2,09 (2,15)
|
2,09 (2,16)
| |
Anwendung hochdosierter ICS (%)a
|
49,5
|
51,5
|
88,6
| |
FEV1 (Liter) vor Verabreichung bei der Baseline ± SD
|
1,84 (0,54)
|
1,78 (0,60)
|
1,58 (0,57)
| |
Mittlere prozentuelle Veränderung des FEV1 bei der Baseline (%) (± SD)
|
60,77 (10,72)
|
58,43 (13,52)
|
52,18 (15,18)
| |
% Reversibilität (± SD)
|
26,85 (15,43)
|
26,29 (21,73)
|
19,47 (23,25)
| |
Mittlerer ACQ-5-Score (± SD)
|
2,74 (0,81)
|
2,76 (0,77)
|
2,50 (1,16)
| |
Mittlerer AQLQ-Score (± SD)
|
4,02 (1,09)
|
4,29 (1,05)
|
4,35 (1,17)
| |
Atopische Krankheiten in der Anamnese% insgesamt
(AD %, NP %, AR %)
|
72,9
(8,0, 10,6, 61,7)
|
77,7
(10,3, 12,7, 68,6)
|
72,4
(7,6, 21,0, 55,7)
| |
Mittelwert FeNO in ppb (± SD)
|
39,10 (35,09)
|
34,97 (32,85)
|
37,61 (31,38)
| |
% Patienten mit FeNO ppb
| |
≥25
|
49,9
|
49,6
|
54,3
| |
≥50
|
21,6
|
20,5
|
25,2
| |
Mittelwert Gesamt-IgE, I.E./ml (± SD)
|
435,05 (753,88)
|
432,40 (746,66)
|
430,58 (775,96)
| |
Mittlere Eosinophilenzahl bei der Baseline (± SD) in Zellen/µl
|
350 (430)
|
360 (370)
|
350 (310)
| |
% Patienten mit EOS
| |
≥150 Zellen/µl
|
77,8
|
71,4
|
71,4
| |
≥300 Zellen/µl
|
41,9
|
43,7
|
42,4
|
ICS = inhalatives Kortikosteroid; FEV1 = Einsekundenkapazität (forciertes Exspirationsvolumen (1 s));
ACQ-5 = Fragebogen zur Asthmakontrolle (Asthma Control Questionnaire-5); AQLQ = Fragebogen zur Lebensqualität bei Asthma (Asthma Quality of Life Questionnaire); AD = atopische Dermatitis; NP = Nasenpolypen; AR = allergische Rhinitis; FeNO = fraktioniertes exhaliertes Stickstoffmonoxid; EOS= Eosinophilenzahl im Blut
a Die Population, die in Studien zur Therapie von Asthma mit Dupilumab behandelt wurde, umfasste Patienten mit mittleren und hochdosierten ICS. Die mittlere ICS-Dosis war definiert als gleichwertig zu 500 μg Fluticason oder Äquivalent pro Tag.
Exazerbationen
Die Studien DRI12544 und QUEST untersuchten die Häufigkeit schwerer Asthmaexazerbationen, definiert als eine Verschlechterung des Asthmas, die die Anwendung systemischer Kortikosteroide über mindestens 3 Tage, eine Hospitalisierung oder einen Besuch der Notfallstation aufgrund eines Asthmas, das systemische Kortikosteroide erfordert, notwendig macht.
In der Primäranalysenpopulation (Patienten mit einem Eosinophilen-Ausgangswert ≥300 Zellen/µl in der Studie DRI12544 und der Gesamtpopulation in der Studie QUEST) kam es bei den Teilnehmern, die DUPIXENT 200 mg oder 300 mg Q2W erhielten, zu einem signifikativen Rückgang der Rate schwerer Asthmaexazerbationen im Vergleich zu Placebo. In der Gesamtpopulation der Studie QUEST lag die Rate schwerer Exazerbationen bei 0,46 für DUPIXENT 200 mg Q2W bzw. 0,52 für DUPIXENT 300 mg Q2W, unter Placebo bei 0,87 bzw. 0,97.
Die Rate schwerer Exazerbationen im Vergleich zu Placebo lag bei 0,52 (95 %-KI: 0,41, 0,66) und 0,54 (95 %-KI: 0,43, 0,68) für DUPIXENT 200 mg Q2W bzw. 300 mg Q2W. Die Ergebnisse für die Patienten mit einem Eosinophilen-Ausgangswert im Blut ≥150 Zellen/µl und ≥300 Zellen/µl in den Studien DRI12544 und QUEST sind in Tabelle 15 dargestellt.
Die Responder-Quote nach Eosinophilen-Ausgangswert für die Studie QUEST ist in Abbildung 8 angegeben. Die präspezifizierten Subgruppenanalysen der Studien DRI12544 und QUEST belegten stärkere Verringerungen von schweren Exazerbationen bei Teilnehmern mit höheren Eosinophilen-Ausgangswerten im Blut. In der Studie QUEST war die Reduzierung von Exazerbationen in der Subgruppe mit einem Eosinophilen-Ausgangswert im Blut ≥150 Zellen/µl signifikant. Bei Patienten mit Eosinophilen-Werten im Blut < 150 Zellen/µl war die Rate schwerer Exazerbationen unter DUPIXENT und Placebo vergleichbar.
In der Studie QUEST lag die Rate schwerer Exazerbationen, die zu Hospitalisierungen und/oder Besuchen der Notfallstation führten, im Vergleich zu Placebo bei 0,53 (95 %-KI: 0,28, 1,03) und 0,74 (95 %-KI: 0,32, 1,70) unter DUPIXENT 200 mg bzw. 300 mg Q2W.
Tabelle 15: Rate schwerer Exazerbationen in DRI12544 und QUEST
|
Behandlung
|
EOS-Wert im Blut
| |
|
≥150 Zellen/µl
|
≥300 Zellen/µl
| |
Exazerbationen pro Jahr
|
% Reduktion
|
Exazerbationen pro Jahr
|
%
Reduktion
| |
N
|
Rate
(95 %-KI)
|
Ratenverhältnis (95 %-KI)
|
N
|
Rate
(95 %-KI)
|
Ratenverhältnis (95 %-KI)
| |
Schwere Exazerbationen gesamt
| |
DRI12544 Studie
| |
Dupilumab 200 mg Q2W
|
120
|
0,29
(0,16, 0,53)
|
0,28a
(0,14, 0,55)
|
72 %
|
65
|
0,30
(0,13, 0,68)
|
0,29c
(0,11, 0,76)
|
71 %
| |
Dupilumab 300 mg
Q2W
|
129
|
0,28
(0,16, 0,50)
|
0,27b
(0,14, 0,52)
|
73 %
|
64
|
0,20
(0,08, 0,52)
|
0,19d
(0,07, 0,56)
|
81 %
| |
Placebo
|
127
|
1,05
(0,69, 1,60)
|
|
|
68
|
1,04
(0,57, 1,90)
|
|
| |
QUEST Studie
| |
Dupilumab 200 mg
Q2W
|
437
|
0,45
(0,37, 0,54)
|
0,44e
(0,34,0,58)
|
56 %
|
264
|
0,37
(0,29, 0,48)
|
0,34e
(0,24,0,48)
|
66 %
| |
Placebo
|
232
|
1,01
(0,81, 1,25)
|
|
|
148
|
1,08
(0,85, 1,38)
|
|
| |
Dupilumab 300 mg
Q2W
|
452
|
0,43
(0,36, 0,53)
|
0,40 e
(0,31,0,53)
|
60 %
|
277
|
0,40
(0,32, 0,51)
|
0,33e
(0,23,0,45)
|
67 %
| |
Placebo
|
237
|
1,08
(0,88, 1,33)
|
|
|
142
|
1,24
(0,97, 1,57)
|
|
|
Abbildung 8: Relatives Risiko in Bezug auf die jährliche Rate schwerer Exazerbationen nach Eosinophilen-Ausgangswerten im Blut (Zellen/µl) in QUEST
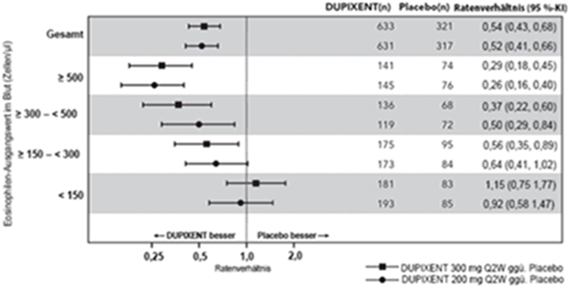
In der Studie QUEST verging bei Patienten unter DUPIXENT mehr Zeit bis zur ersten Exazerbation als bei Patienten unter Placebo (Abbildung 9).
Abbildung 9: Kaplan-Meier-Kurve der Zeit bis zur ersten schweren Exazerbation bei Patienten mit Eosinophilen-Ausgangswerten im Blut ≥300 Zellen/µl (QUEST)a
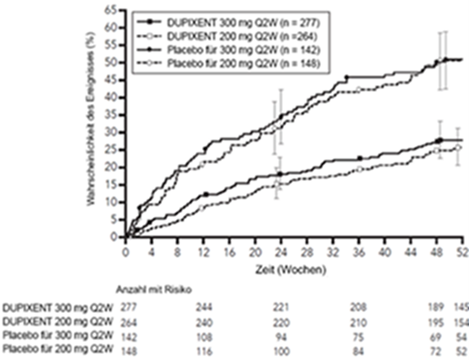
a Zum Zeitpunkt des Schliessens der Datenbank hatten noch nicht alle Patienten Woche 52 beendet.
Lungenfunktion
Klinisch signifikante Zunahmen des FEV1 vor Anwendung eines Bronchodilatators wurden in Woche 12 der Studien DRI12544 und QUEST in den Primäranalysenpopulationen (Patienten mit einem Eosinophilen-Ausgangswert ≥300 Zellen/µl in der Studie DRI12544 und der Gesamtpopulation in der Studie QUEST) beobachtet. In der Gesamtpopulation der Studie QUEST lag die mittlere Veränderung des FEV1 (l) gegenüber dem Ausgangswert bei 0,32 l (21%) und 0,34 l (23 %) für DUPIXENT 200 mg Q2W bzw. 300 mg Q2W im Vergleich zur durchschnittlichen Veränderung unter Placebo von 0,18 l (12 %) bzw. 0,21 l (14 %).
Der mittlere Behandlungsunterschied gegenüber Placebo betrug 0,14 l (95 %-KI: 0,08, 0,19) bzw. 0,13 l (95 %-KI: 0,08, 0,18) für DUPIXENT 200 mg Q2W bzw. 300 mg Q2W. Die Ergebnisse bei den Patienten mit einem Eosinophilen-Ausgangswert im Blut ≥150 Zellen/µl und ≥300 Zellen/µl in den Studien DRI12544 und QUEST sind in Tabelle 16 aufgeführt. Die Verbesserungen des FEV1. je nach Eosinophilen-Ausgangswert für die Studie QUEST sind in Abbildung 10 dargestellt. Die Subgruppenanalyse der Studien DRI12544 und QUEST ergab eine grössere Verbesserung bei den Teilnehmern mit einem höheren Eosinophilen-Ausgangswert.
Tabelle 16: Mittlere Veränderung des FEV1 vor Anwendung eines Bronchodilatators gegenüber der Baseline in Woche 12 in DRI12544 und QUEST
|
Behandlung
|
EOS-Ausgangswert im Blut
| |
|
≥150 Zellen/µl
|
≥300 Zellen/µl
| |
n
|
Mittlere LS-Veränderung
gegenüber der
Baseline
l (%)
|
Mittlerer LS-Unterschied
vs.
Placebo (95 %-
KI)
|
n
|
Mittlere LS-Veränderung
gegenüber der
Baseline
l (%)
|
Mittlerer LS-Unterschied
vs.
Placebo
(95 %-KI)
| |
Studie DRI12544
| |
Dupilumab 200 mg Q2W
|
120
|
0,32 (18,25)
|
0,23a
(0,13, 0,33)
|
65
|
0,43 (25,9)
|
0,26c
(0,11, 0,40)
| |
Dupilumab 300 mg Q2W
|
129
|
0,26 (17,1)
|
0,18b
(0,08, 0,27)
|
64
|
0,39 (25,8)
|
0,21d
(0,06, 0,36)
| |
Placebo
|
127
|
0,09 (4,36)
|
|
68
|
0,18 (10,2)
|
| |
Studie QUEST
| |
Dupilumab 200 mg Q2W
|
437
|
0,36 (23,6)
|
0,17e
(0,11, 0,23)
|
264
|
0,43 (29,0)
|
0,21e
(0,13, 0,29)
| |
Placebo
|
232
|
0,18 (12,4)
|
|
148
|
0,21 (15,6)
|
| |
Dupilumab 300 mg Q2W
|
452
|
0,37 (25,3)
|
0,15e
(0,09, 0,21)
|
277
|
0,47 (32,5)
|
0,24e
(0,16, 0,32)
| |
Placebo
|
237
|
0,22 (14,2)
|
|
142
|
0,22 (14,4)
|
|
a p-Wert < 0,0001, b p-Wert = 0,0004, c p-Wert = 0,0008, d p-Wert = 0,0063, e p-Wert < 0,0001
Abbildung 10: Mittlerer LS-Unterschied im Vergleich zu Placebo bzgl. FEV1 vor Anwendung eines Bronchodilatators gegenüber der Baseline in Woche 12 der QUEST-Studie nach Eosinophilen-Ausgangswert im Blut (Zellen/µl) in QUEST
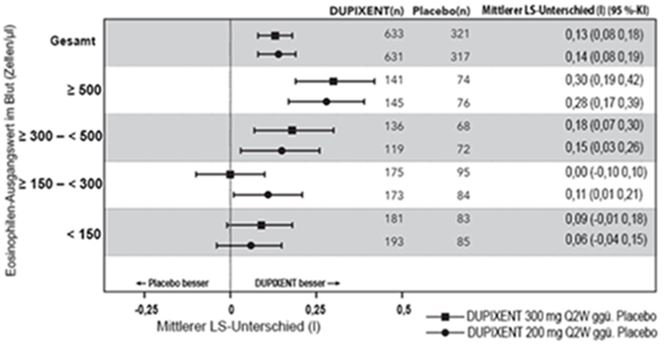
Die mittlere Veränderung des FEV1 im Zeitverlauf in der QUEST-Studie ist in Abbildung 11 dargestellt.
Abbildung 11: Mittlere Veränderung des FEV1 (l) vor Anwendung eines Bronchodilatators gegenüber der Baseline im Zeitverlauf bei Patienten mit einem Eosinophilen-Ausgangswert ≥300 Zellen/µl (QUEST)
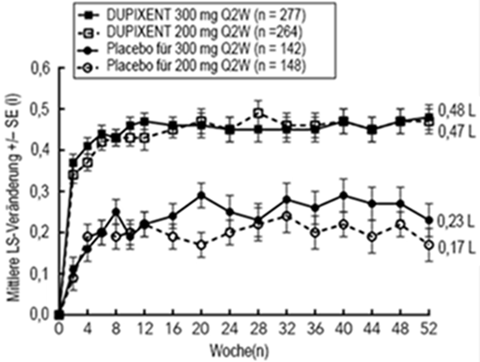
Weitere sekundäre Endpunkte:
Ergebnisse zur Lebensqualität / Patienten-berichtete Endpunkte bei Asthma
Endpunkte bezüglich ACQ-5 und AQLQ (S) wurden in der QUEST-Studie nach 52 Wochen analysiert. Die Responderrate war definiert als eine Verbesserung des Wertes um mindestens 0,5 Punkte (Skalenbereich 0–6 für ACQ-5 und 1–7 für AQLQ (S)).
·Die ACQ-5-Responderrate für Dupilumab 200 mg und 300 mg Q2W in der Gesamtpopulation betrug 69 % gegenüber 62 % unter Placebo (Odds Ratio 1,37; 95 %-KI: 1,01, 1,86) bzw. 69 % gegenüber 63 % unter Placebo (Odds Ratio 1,28; 95 %-KI: 0,94, 1,73). Die AQLQ(S)-Responderrate belief sich auf 62 % gegenüber 54 % unter Placebo (Odds Ratio 1,61; 95 %-KI: 1,17, 2,21) bzw. 62 % gegenüber 57 % unter Placebo (Odds Ratio 1,33; 95 %-KI: 0,98, 1,81).
·Die ACQ-5-Responderrate für Dupilumab 200 mg und 300 mg Q2W bei Patienten mit einem Eosinophilen-Ausgangswert ≥300 Zellen/μl betrug 75 % gegenüber 67 % unter Placebo (Odds Ratio: 1,46; 95 %-KI: 0,90, 2,35) bzw. 71% gegenüber 64 % unter Placebo (Odds Ratio: 1,39; 95 %-KI: 0,88, 2,19). Die AQLQ(S)-Responderrate belief sich auf 71 % gegenüber 55 % unter Placebo (Odds Ratio: 2,02; 95 %-KI: 1,24, 3,32) bzw. 65 % gegenüber 55 % unter Placebo (Odds Ratio: 1,79; 95 %-KI: 1,13, 2,85).
Studie zur Reduktion oraler Kortikosteroide (VENTURE)
In der VENTURE-Studie wurde die Wirkung von Dupilumab in Bezug auf die Reduktion der Anwendung oraler Kortikosteroide für die Erhaltungstherapie untersucht. Bei der Baseline lag die im Mittel angewendete Dosis oraler Kortikosteroide bei 12 mg in der Placebo-Gruppe und 11 mg in der Gruppe, die Dupilumab erhielt. Primärer Endpunkt war die Reduktionsrate der Enddosis oraler Kortikosteroide gegenüber der Baseline in Woche 24, bei der die Asthma-Kontrolle aufrechterhalten wurde.
Patienten, die mit Dupilumab behandelt wurden, erzielten im Vergleich zu Patienten unter Placebo eine stärkere Reduktion der täglichen Dosis oraler Kortikosteroide unter Aufrechterhaltung der Asthma-Kontrolle. Die durchschnittliche Reduktionsrate der täglichen OCS-Dosis gegenüber Baseline lag bei Patienten, die Dupilumab erhielten, bei 70 % (median 100 %) (95 %-KI: 60 %, 80 %) im Vergleich zu 42 % (median 50 %) bei Patienten unter Placebo (95 %-KI: 33 %, 51 %). Bei 82 (80 %) der Patienten unter Dupilumab vs. 57 (53 %) der Patienten unter Placebo wurden Reduktionen der OCS-Dosis von mindestens 50 % beobachtet. Der Anteil der Patienten mit einer durchschnittlichen Enddosis unter 5 mg in Woche 24 lag für Dupilumab bei 72 % und für Placebo bei 37 % (Odds Ratio 4,48; 95 %-KI: 2,39, 8,39). Insgesamt 54 (52 %) Patienten, die Dupilumab erhielten, im Vergleich zu 31 (29 %) Patienten in der Placebo-Gruppe erzielten eine Reduktion ihrer OCS-Dosis von 100 %.
In dieser 24-wöchigen Studie traten bei Patienten, die mit Dupilumab behandelt wurden, weniger Asthmaexazerbationen (definiert als vorübergehende Erhöhung der Dosis oraler Kortikosteroide über mindestens 3 Tage) auf als bei Patienten, die Placebo erhielten (annualisierte Rate 0,65 und 1,60 für die Dupilumab- bzw. Placebo-Gruppe; Odds Ratio 0,41 [95 %-KI 0,26, 0,63]), und die Verbesserung des FEV1 vor Anwendung eines Bronchodilatators zwischen der Baseline und Woche 24 war bei Patienten, die Dupilumab erhielten, grösser als unter Placebo (mittlere LS-Veränderung für Dupilumab versus Placebo von 0,22 l [95 %-KI: 0,09 bis 0,34 l]). Die Auswirkungen auf die Lungenfunktion, die Anwendung oraler Steroide und die Verringerung von Exazerbationen fielen, unabhängig von den Eosinophilen-Ausgangswerten im Blut, ähnlich aus. Die Fragebögen ACQ-5 und AQLQ(S) wurden in der VENTURE-Studie ebenfalls beurteilt und ergaben ähnliche Verbesserungen, wie sie in der QUEST-Studie festgestellt wurden.
Langzeit-Verlängerungsstudie (TRAVERSE)
Die Langzeitsicherheit von Dupilumab wurde in der offenen Verlängerungsstudie (TRAVERSE) bei 2'193 Erwachsenen und 89 Jugendlichen mit mittelschwerem bis schwerem Asthma untersucht; darunter 185 Erwachsene mit oral steroidpflichtigem Asthma, die an früheren klinischen Studien mit Dupilumab (DRI12544, QUEST und VENTURE) teilgenommen hatten (siehe «Unerwünschte Wirkungen»). Die als sekundäres Beurteilungskriterium gemessene Wirksamkeit war mit den in den Zulassungsstudien beobachteten Ergebnissen vergleichbar und hielt bis zu 96 Wochen an. Bei Erwachsenen mit oral steroidpflichtigem Asthma wurde trotz Dosisreduktion bzw. Absetzen des oralen Kortikosteroids eine anhaltendende Verringerung der Exazerbationen sowie eine Verbesserung der Lungenfunktion während bis zu 96 Wochen beobachtet.
Klinische Wirksamkeit und Sicherheit bei Kindern (6 bis 11 Jahre) mit Asthma:
Die Wirksamkeit und Sicherheit von Dupilumab bei pädiatrischen Patienten wurden in einer 52-wöchigen, multizentrischen, randomisierten, doppelblinden, placebokontrollierten Studie (VOYAGE) mit 408 Patienten im Alter von 6 bis 11 Jahren mit mittelschwerem bis schwerem Asthma untersucht, die ein mittel- oder hochdosiertes inhalatives Kortikosteroid (ICS) und ein weiteres Arzneimittel zur Erhaltungstherapie oder hochdosiertes ICS allein erhielten. Die Patienten erhielten randomisiert Dupilumab (n = 273) oder ein entsprechendes Placebo (n = 135) alle zwei Wochen jeweils auf Grundlage ihres Körpergewichts von ≤30 kg oder > 30 kg.
Der primäre Endpunkt war die jährliche Rate schwerer Exazerbationsereignisse während des 52-wöchigen placebokontrollierten Zeitraums, und der sekundäre Endpunkt war die prozentuale Veränderung der vorhergesagten FEV1 in Woche 12 vor Anwendung eines Bronchodilatators im Vergleich zur Baseline. Weitere sekundäre Endpunkte waren die mittleren Veränderungen gegenüber der Baseline und die Responderraten bei ACQ-7-IA und PAQLQ(S)-IA.
Die demografischen Daten und Baseline-Charakteristika der VOYAGE-Studie sind in der nachfolgenden Tabelle 17 dargestellt.
Tabelle 17: Demografische Angaben und Baseline-Charakteristika in der VOYAGE-Studie
|
Parameter
|
ITT
(n = 408)
| |
Mittleres Alter in Jahren (SD)
|
8,9 (1,6)
| |
% weiblich
|
35,8
| |
% weiss
|
88,2
| |
Mittleres Körpergewicht (kg)
|
35,91
| |
Mittlere Anzahl der Exazerbationen im vorherigen Jahr ± SD
|
2,44 (2,18)
| |
ICS-Dosis (%)
|
| |
Mittel
|
55,1
| |
Hoch
|
44,1
| |
FEV1 (l) vor Anwendung bei Baseline (± SD)
|
1,48 (0,41)
| |
Mittlerer Prozentsatz der vorhergesagten FEV1 (%) (± SD)
|
78,07 (14,72)
| |
Mittlere Reversibilität in % (± SD)
|
19,58 (20,76)
| |
Mittlerer ACQ-7-IA-Score (± SD)
|
2,13 (0,73)
| |
Mittlerer PAQLQ(S)-IA-Score (± ET)
|
4,91 (1,13)
| |
Atopische Krankheiten in der Anamnese % insgesamt
(AD %, AR %)
|
92,4
(36,3, 81,9)
| |
Median Gesamt-IgE I.E./ml ± SD)
|
792,28 (1093,46)
| |
Mittelwert FeNO in ppb (± SD)
|
27,71 (23,84)
| |
% Patienten mit FeNO ppb ≥20
|
49,7
| |
Mittlere Eosinophilenzahl bei Baseline (± SD) in Zellen/µl
|
500 (400)
| |
% Patienten mit EOS
| |
≥150 Zellen/µl
|
81,1
| |
≥300 Zellen/µl
|
63,5
|
Exazerbationen waren definiert als eine Verschlechterung des Asthmas, die Anwendung systemischer Kortikosteroide über mindestens 3 Tage, eine Hospitalisierung oder einen Besuch der Notfallstation aufgrund eines Asthmas, das systemische Kortikosteroide erfordert, notwendig macht. In der Population mit Typ-2-Inflammation (Eosinophilenzahl im Blut ≥150 Zellen/µl oder FeNO ≥20 ppb) und in der Population mit einer Eosinophilenzahl im Blut ≥300 Zellen/µl bei Baseline führte Dupilumab zu einer signifikanten Verringerung der jährlichen Rate schwerer Asthmaexazerbationsereignisse während des 52-wöchigen Behandlungszeitraums im Vergleich zu Placebo. Subgruppenanalysen zur Wirksamkeit von Dupilumab, die auf dem Eosinophilen-Ausgangswert oder dem FeNO-Ausgangswert beruhten, zeigten ähnliche Ergebnisse wie die klinischen Studien mit jugendlichen Patienten (12 bis 17 Jahre) und erwachsenen Patienten (siehe oben). Bei Patienten mit einer Eosinophilenzahl im Blut < 150 Zellen/µl bei der Baseline oder einem FeNO-Wert < 20 ppb, war die jährliche Rate der beobachteten schweren Asthmaexazerbationsereignisse bei Dupilumab und Placebo vergleichbar. Die Wirksamkeitsergebnisse der VOYAGE-Studie sind in Tabelle 18 dargestellt.
Tabelle 18: Rate schwerer Exazerbationen, mittlere Veränderung der FEV1 gegenüber Baseline
|
Behandlung
|
EOS ≥150 Zellen/µl oder FeNO ≥20 ppb
|
EOS
≥300 Zellen/µl
| |
Jährliche Rate schwerer Exazerbationen innerhalb von 52 Wochen
| |
|
N
|
Rate
(95 %-KI)
|
Rate
(95 %-KI)
|
N
|
Rate
(95 %-KI)
|
Rate
(95 %-KI)
| |
DUPIXENT
100 mg alle 2 Wochen (< 30 kg)/
200 mg alle 2 Wochen (≥30 kg)
|
236
|
0,305
(0,223, 0,416)
|
0,407
(0,274, 0,605)
|
175
|
0,235
(0,160, 0,345)
|
0,353
(0,222, 0,562)
| |
Placebo
|
114
|
0,748
(0,542, 1,034)
|
|
84
|
0,665
(0,467, 0,949)
|
| |
Mittlere prozentuale Veränderung des vorhergesagten FEV1 in Woche 12 gegenüber Baseline
| |
|
N
|
Mittlere LS-Veränderungen gegenüber Baseline in % der vorhergesagten FEV1
|
N
|
Mittlere LS-Veränderungen gegenüber Baseline in % der vorhergesagten FEV1
| |
DUPIXENT
100 mg alle 2 Wochen (< 30 kg)/
200 mg alle 2 Wochen (≥30 kg)
|
229
|
10,53
|
168
|
10,15
| |
Placebo
|
110
|
5,32
|
80
|
4,83
|
In Woche 12 wurden signifikante prozentuale Verbesserungen der vorhergesagten FEV1 vor Anwendung des Bronchodilatators beobachtet.
Signifikante prozentuale Verbesserungen der vorhergesagten FEV1 wurden bereits in Woche 2 beobachtet und hielten bis Woche 52 der VOYAGE-Studie an.
Die prozentualen Verbesserungen der vorhergesagten FEV1 im Zeitverlauf der VOYAGE-Studie sind in Abbildung 12 dargestellt.
Abbildung 12: Mittlere prozentuale Veränderung der vorhergesagten FEV1 gegenüber Baseline vor Anwendung eines Bronchodilatators (Liter) im Zeitverlauf der VOYAGE-Studie (Ausgangswert Eosinophilenzahl im Blut ≥150 Zellen/µl oder FeNO ≥20 ppb, Ausgangswert Eosinophilenzahl ≥300 Zellen/µl)
|
Ausgangswert Eosinophilenzahl im Blut ≥150 Zellen/µl oder FeNO ≥20 ppb
|
Ausgangswert Eosinophilenzahl im Blut ≥300 Zellen/µl
| |
|
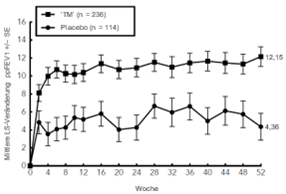
|
|
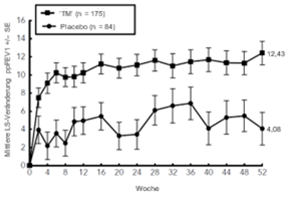
|
Verbesserungen wurden bei ACQ-7-IA und PAQLQ(S)-IA in Woche 24 beobachtet und hielten bis Woche 52 an. Die Responderraten in den Populationen mit einer Eosinophilenzahl im Blut ≥150 Zellen/µl oder einem FeNO ≥20 ppb und mit einer Eosinophilenzahl im Blut ≥150 Zellen/µl waren verglichen mit Placebo in Woche 24 höher bei ACE-7IA und OAQLW(S)-IA. Die Responderrate war definiert als eine Verbesserung des Wertes um mindestens 0,5 in der Skala (Skalenbereich von 0–6 bei ACQ-7-IA und von 1–7 bei PAQLQ(S)-IA). In der Subgruppe der Patienten mit einer Eosinophilenzahl im Blut ≥300 Zellen/µl als Ausgangswert war bei DUPIXENT in Woche 24 der Anteil der Responder bei ACQ-7-IA höher (80,6% gegenüber 64,3% bei Placebo) bei einer Odds Ratio (OR) von 2,79 (95%-KI: 1,43; 5,44), ebenso der Anteil der Responder bei PAQLQ(S)-IA (72,8% gegenüber 63,0% bei Placebo) mit einer OR von 1,84 (95%-KI: 0,92; 3,65).
Langzeit-Verlängerungsstudie (EXCURSION)
Die Wirksamkeit von Dupilumab, die als sekundärer Endpunkt bestimmt wurde, wurde bei 365 Kindern (im Alter von 6 bis 11 Jahren) mit Asthma in der Langzeit-Verlängerungsstudie (EXCURSION) untersucht. Es wurde eine dauerhafte Verringerung der Exazerbationen, die eine Hospitalisierung und/oder einen Besuch der Notfallstation erforderten, sowie eine Verringerung der Exposition gegenüber oralen systemischen Kortikosteroiden beobachtet. Anhaltende Verbesserungen der Lungenfunktion wurden für mehrere Parameter beobachtet, darunter der Prozentsatz der vorhergesagten FEV1, der Prozentsatz der vorhergesagten FVC, das Verhältnis von FEV1 zu FVC und der Prozentsatz des vorhergesagten FEF 25–75 %. Zudem erreichten und/oder behielten 75 % der Patienten eine normale Lungenfunktion mit einer FEV1 vor Anwendung eines Bronchodilatators in Prozent des vorhergesagten Wertes > 80 % am Ende der EXCURSION-Studie. Die Wirksamkeit wurde über eine kumulative Behandlungsdauer von bis zu 104 Wochen aufrechterhalten (VOYAGE und EXCURSION).
3) Klinische Wirksamkeit bei chronischer Rhinosinusitis mit Nasenpolypen (CRSwNP)
Das Entwicklungsprogramm zur chronischen Rhinosinusitis mit Nasenpolypen (CRSwNP) beinhaltete zwei randomisierte, doppelblinde, multizentrische, placebokontrollierte Parallelgruppenstudien (SINUS-24 und SINUS-52) mit 724 Patienten ab 18 Jahren, eingestellt auf intranasale Kortikosteroide (INCS) als Basistherapie. Diese Studien schlossen Patienten ein, die trotz vorherigem operativem Eingriff an den Nasennebenhöhlen oder vorheriger Behandlung mit systemischen Kortikosteroiden in den vergangenen 2 Jahren unter einer schweren CRSwNP litten bzw. die für eine Therapie mit systemischen Kortikosteroiden in den vergangenen 2 Jahren nicht in Frage kamen. Es lag im Ermessen des Prüfarztes, Notfallmedikation mit systemischen Kortikosteroiden oder einen operativen Eingriff während der Studien zu veranlassen.
In der SINUS-24-Studie wurden insgesamt 276 Patienten randomisiert und erhielten für 24 Wochen entweder 300 mg Dupilumab (n = 143) oder Placebo (n = 133) alle zwei Wochen. In der SINUS-52-Studie wurden 448 Patienten randomisiert und erhielten entweder für 52 Wochen 300 mg Dupilumab (n = 150) alle zwei Wochen oder bis Woche 24 300 mg Dupilumab (n = 145) alle zwei Wochen, gefolgt von 300 mg Dupilumab alle 4 Wochen bis Woche 52, oder Placebo (n = 153). Alle Patienten zeigten eine Verschattung der Nasennebenhöhlen im Lund-MacKay-Gesamt-CT-Score (LMK), und 73 % bis 90 % der Patienten wiesen eine Verschattung aller Nasennebenhöhlen auf. Patienten wurden stratifiziert anhand ihrer vorherigen operativen Eingriffe und ihres komorbiden Asthmas / Analgetika-Intoleranz-Syndroms (nonsteroidal anti-inflammatory drug exacerbated respiratory disease, NSAID-ERD).
Die koprimären Wirksamkeitsendpunkte waren die Veränderung des bilateralen endoskopischen Nasenpolypenscores (NPS), bewertet von zentral verblindeten Prüfern, zwischen dem Ausgangswert und dem Wert in Woche 24 sowie die Veränderung des über 28 Tage gemittelten Scores der nasalen Kongestion/Obstruktion (NC), täglich ermittelt durch Patienten anhand von Tagebüchern, zwischen dem Ausgangswert und dem Wert in Woche 24. Bei dem NPS wurden Polypen auf jeder Seite der Nase auf einer kategorialen Skala beurteilt (0 = keine Polypen; 1 = kleine Polypen im mittleren Nasengang, die nicht weiter als bis zur unteren Grenze der mittleren Nasenmuschel reichen; 2 = Polypen, die weiter als bis zur unteren Grenze der mittleren Nasenmuschel reichen; 3 = grosse Polypen, die bis zur unteren Grenze der unteren Nasenmuschel reichen oder Polypen medial der mittleren Nasenmuschel; 4 = grosse Polypen, die die untere Nasenhöhle komplett blockieren). Der Gesamtscore war die Summe der rechten und linken Scores. Die nasale Kongestion wurde von den Teilnehmern täglich anhand einer kategorialen Schweregrad-Skala von 0 bis 3 beurteilt (0 = keine Symptome; 1 = leichte Symptome; 2 = mittelschwere Symptome; 3 = schwere Symptome).
In beiden Studien umfassten die sekundären Hauptendpunkte in Woche 24 Veränderungen gegenüber dem Ausgangwert bei: Lund-MacKay-Gesamt-CT-Score (LMK), Gesamtsymptom-Score (total symptom score, TSS), Riechtest UPSIT (University of Pennsylvania smell identification test), täglicher Verlust des Geruchssinns und dem aus 22 Fragen bestehenden Sino-Nasal-Outcome-Test (22-item Sino-Nasal Outcome Test, SNOT-22). Anhand der gepoolten Daten der zwei Studien wurde die Verringerung des Anteils der Patienten beurteilt, die im Notfall systemische Kortikosteroide anwendeten und/oder sich einem operativen Eingriff an den Nasennebenhöhlen unterzogen, sowie die Verbesserung der FEV1 in der Asthma-Subgruppe. Zu den weiteren sekundären Endpunkten gehörte der aus 6 Fragen bestehende Fragebogen zur Asthmakontrolle (Asthma Control Questionnaire, ACQ-6) in der Subgruppe mit komorbidem Asthma.
Die demografischen Angaben und Baseline-Charakteristika für diese 2 Studien sind in der nachfolgenden Tabelle 19 dargestellt.
Tabelle 19: Demografische Angaben und Baseline-Charakteristika in den CRSwNP-Studien
|
Parameter
|
SINUS-24
(n = 276)
|
SINUS-52
(n = 448)
| |
Mittleres Alter in Jahren (SD)
|
50,49 (13,39)
|
51,95 (12,45)
| |
% Männlich
|
57,2
|
62,3
| |
Mittlere Dauer der CRSwNP (Jahre) (SD)
|
11,11 (9,16)
|
10,94 (9,63)
| |
Patienten mit ≥1 vorherigen operativen Eingriff (%)
|
71,7
|
58,3
| |
Patienten mit Anwendung systemischer Kortikosteroide in den vergangenen 2 Jahren (%)
|
64,9
|
80,1
| |
Mittlerer bilateraler endoskopischer NPSa (SD), Bereich: 0–8
|
5,75 (1,28)
|
6,10 (1,21)
| |
Mittlerer nasaler Kongestion (NC)-Scorea (SD), Bereich: 0–3
|
2,35 (0,57)
|
2,43 (0,59)
| |
Mittlerer Lund-MacKay-Gesamt-CT-Scorea (SD), Bereich: 0–24
|
19,03 (4,44)
|
17,96 (3,76)
| |
Mittlerer Riechtest UPSIT-Scorea (SD), Bereich: 0–40
|
14,56 (2,71)
|
13,61 (8,02)
| |
Mittlerer Verlust des Geruchssinn-Scorea, (SD), Bereich: 0–3
|
2,71 (0,54)
|
2,75 (0,52)
| |
Mittlerer SNOT-22-Gesamtscorea (SD), Bereich: 0–110
|
49,40 (20,20)
|
51,86 (20,90)
| |
Mittelwert Rhinosinusitis-Schweregrad-Skalaa (VAS) (SD), 0–10 cm
|
7,68 (2,05)
|
8,00 (2,08)
| |
Mittlere Eosinophilenzahl im Blut (Zellen/µl) (SD)
|
437 (333)
|
431 (353)
| |
Mittleres Gesamt-IgE I.E./ml (SD)
|
211,97 (275,73)
|
239,84
(341,53)
| |
Atopische Krankheiten in der Anamnese (mit Typ-2- Inflammation)
% Insgesamt
|
75,4 %
|
82,4 %
| |
Asthma (%)
|
58,3
|
59,6
| |
Mittlere FEV1 (l) (SD)
|
2,69
(0,96)
|
2,57
(0,83)
| |
Mittlerer Prozentsatz der vorhergesagten FEV1 (%) (SD)
|
85,30
(20,23)
|
83,39
(17,72)
| |
Mittlerer ACQ-6-Scorea (SD)
|
1,62
(1,14)
|
1,58
(1,09)
| |
NSAID-ERD (%)
|
30,4
|
26,8
|
a Höhere Scores weisen auf eine stärkere Ausprägung der Erkrankung hin, ausser bei UPSIT, bei dem höhere Scores auf eine geringere Ausprägung der Erkrankung hinweisen; SD = Standardabweichung; NPS = Nasenpolypenscore; UPSIT = Riechtest (University of Pennsylvania smell identification test); SNOT-22 = Sino-Nasal-Outcome-Test mit 22 Fragen (22-item Sino-Nasal Outcome Test); VAS = visuelle Analogskala (visual analogue scale); FEV1 = Einsekundenkapazität (forciertes Exspirationsvolumen (1 s)); ACQ-6 = Fragebogen zur Asthmakontrolle (Asthma Control Questionnaire-6); NSAID-ERD = Aspirin/Analgetika-Intoleranz-Syndrom (nonsteroidal anti-inflammatory drug exacerbated respiratory disease).
Klinisches Ansprechen (SINUS-24 und SINUS-52)
Die Ergebnisse der primären und sekundären Endpunkte der CRSwNP-Studien sind in der nachfolgenden Tabelle 20 dargestellt.
Tabelle 20: Ergebnisse der primären und sekundären Endpunkte in den CRSwNP-Studien
|
|
SINUS-24
|
SINUS-52
| |
|
Placebo
(n = 133)
|
Dupilumab
300 mg
Q2W
(n = 143)
|
Mittlerer LS-Unterschied vs. Placebo (95 %-KI)
|
Placebo
(n = 153)
|
Dupilumab
300 mg
Q2W
(n = 295)
|
Mittlerer LS-Unterschied vs. Placebo (95 %-KI)
| |
Primäre Endpunkte in Woche 24
| |
Scores
|
Mittlere Baseline
|
Mittlere
LS-Veränderung
|
Mittlere Baseline
|
Mittlere
LS-Veränderung
|
|
Mittlere Baseline
|
Mittlere
LS-Veränderung
|
Mittlere Baseline
|
Mittlere
LS-Veränderung
|
| |
NPS
|
5,86
|
0,17
|
5,64
|
-1,89
|
-2,06
(-2,43; -1,69)
|
5,96
|
0,10
|
6,18
|
-1,71
|
-1,80
(-2,10; -1,51)
| |
NC
|
2,45
|
-0,45
|
2,26
|
-1,34
|
-0,89
(-1,07; -0,71)
|
2,38
|
-0,38
|
2,46
|
-1,25
|
-0,87
(-1,03; -0,71)
| |
Sekundäre Hauptendpunkte in Woche 24
| |
Scores
|
Mittlere Baseline
|
Mittlere
LS-Veränderung
|
Mittlere Baseline
|
Mittlere
LS-Veränderung
|
|
Mittlere Baseline
|
Mittlere
LS-Veränderung
|
Mittlere Baseline
|
Mittlere
LS-Veränderung
|
| |
LMK-Score
|
19,55
|
-0,74
|
18,55
|
-8,18
|
-7,44
(-8,35; -6,53)
|
17,65
|
-0,09
|
18,12
|
-5,21
|
-5,13
(-5,80; -4,46)
| |
Gesamtsymptom-Score (TSS)
|
7,28
|
-1,17
|
6,82
|
-3,77
|
-2,61
(-3,04; -2,17)
|
7,08
|
-1,00
|
7,30
|
-3,45
|
-2,44
(-2,87; -2,02)
| |
UPSIT
|
14,44
|
0,70
|
14,68
|
11,26
|
10,56
(8,79; 12,34)
|
13,78
|
-0,81
|
13,53
|
9,71
|
10,52
(8,98; 12,07)
| |
Verlust des Geruchssinns
|
2,73
|
-0,29
|
2,70
|
-1,41
|
-1,12
(-1,31; -0,93)
|
2,72
|
-0,23
|
2,77
|
-1,21
|
-0,98
(-1,15; -0,81)
| |
SNOT-22
|
50,87
|
-9,31
|
48,0
|
-30,43
|
-21,12
(-25,17; -17,06)
|
53,48
|
-10,40
|
51,02
|
-27,77
|
-17,36
(-20,87; -13,85)
| |
VAS
|
7,96
|
-1,34
|
7,42
|
-4,54
|
-3,20
(-3,79; -2,60)
|
7,98
|
-1,39
|
8,01
|
-4,32
|
-2,93
(-3,45, -2,40)
|
Eine Verringerung des Scores bedeutet eine Verbesserung, ausser bei UPSIT, bei dem ein Anstieg eine Verbesserung bedeutet.
Der Gesamtsymptom-Score (TSS) ist ein zusammengesetzter Schweregrad-Score, bestehend aus der Summe der täglichen Symptome von NC, Verlust des Geruchssinns und anteriorer/posteriorer Rhinorrhö.
NC = nasale Kongestion; NPS = Nasenpolypenscore; LMK = Lund-MacKay-Gesamt-CT-Score; UPSIT = Riechtest (University of Pennsylvania smell identification test); SNOT-22 = Sino-Nasal-Outcome-Test mit 22 Fragen (22-item Sino-Nasal Outcome Test); TSS = Gesamtsymptom-Score (total symptom score); VAS = visuelle Analogskala für Rhinosinusitis (visual analogue scale) (alle p-Werte < 0,0001, nominal für VAS)
Die Ergebnisse der SINUS-52-Studie in Woche 52 sind in der nachfolgenden Tabelle 21 dargestellt.
Tabelle 21: Ergebnisse zur Wirksamkeit in Woche 52 der SINUS-52-Studie
|
|
Placebo
(n = 153)
|
Dupilumab
300 mg Q2W
(n = 150)
|
Mittlerer LS-Unterschied vs. Placebo (95 %-KI)
|
Dupilumab
300 mg Q2W–Q4W
(n = 145)
|
Mittlerer LS-Unterschied vs. Placebo (95 %-KI)
| |
Mittlere Baseline
|
Mittlere LS-Veränderung
|
Mittlere Baseline
|
Mittlere LS-Veränderung
|
Mittlere Baseline
|
Mittlere LS-Veränderung
| |
NPS
|
5,96
|
0,15
|
6,07
|
-2,24
|
-2,40
(-2,77; -2,02)
|
6,29
|
-2,06
|
-2,21
(-2,59; -1,83)
| |
NC
|
2,38
|
-0,37
|
2,48
|
-1,35
|
-0,98
(-1,17; -0,79)
|
2,44
|
-1,48
|
-1,10
(-1,29; -0,91)
| |
LMK-Score
|
17,65
|
0,11
|
18,42
|
-6,83
|
-6,94
(-7,87; -6,01)
|
17,81
|
-5,60
|
-5,71
(-6,64; -4,77)
| |
Gesamtsymptom-Score (TSS)
|
7,08
|
-0,94
|
7,31
|
-3,79
|
-2,85
(-3,35; -2,35)
|
7,28
|
-4,16
|
-3,22
(-3,73; -2,72)
| |
UPSIT
|
13,78
|
-0,77
|
13,46
|
9,53
|
10,30
(8,50; 12,10)
|
13,60
|
9,99
|
10,76
(8,95; 12,57)
| |
Verlust des Geruchssinns
|
2,72
|
-0,19
|
2,81
|
-1,29
|
-1,10
(-1,31, -0,89)
|
2,73
|
-1,49
|
-1,30
(-1,51; -1,09)
| |
SNOT-22
|
53,48
|
-8,88
|
50,16
|
-29,84
|
-20,96
(-25,03; -16,89)
|
51,89
|
-30,52
|
-21,65
(-25,71; -17,58)
| |
VAS
|
7,98
|
-0,93
|
8,24
|
-4,74
|
-3,81
(-4,46; -3,17)
|
7,78
|
-4,39
|
-3,46
(-4,10, -2,81)
|
Eine Verringerung des Scores bedeutet eine Verbesserung, ausser bei UPSIT, bei dem ein Anstieg eine Verbesserung bedeutet.
Der Gesamtsymptom-Score (TSS) ist ein zusammengesetzter Schweregrad-Score, bestehend aus der Summe der täglichen Symptome von NC, Verlust des Geruchssinns und anteriorer/posteriorer Rhinorrhö.
NC = nasale Kongestion; NPS = Nasenpolypenscore; LMK = Lund-MacKay-Gesamt-CT-Score; UPSIT = Riechtest (University of Pennsylvania smell identification test); SNOT-22 = Sino-Nasal-Outcome-Test mit 22 Fragen (22-item Sino-Nasal Outcome Test); TSS = Gesamtsymptom-Score (total symptom score); VAS = visuelle Analogskala für Rhinosinusitis (visual analogue scale). (alle p-Werte < 0,0001)
Eine statistisch signifikante und klinisch bedeutsame Wirksamkeit wurde in der SINUS-24-Studie hinsichtlich der Verbesserung bei dem bilateralen endoskopischen NPS-Score in Woche 24 beobachtet. Im Zeitraum nach der Behandlung, als Patienten kein Dupilumab erhielten, nahm der Behandlungseffekt mit der Zeit ab (siehe Abbildung 13a). Ähnliche Verbesserungen bei dem bilateralen endoskopischen NPS-Score wurden ebenfalls in der SINUS-52-Studie sowohl in Woche 24 als auch in Woche 52 mit einer progressiven Verbesserung im Laufe der Zeit beobachtet (siehe Abbildung 13b).
Abbildung 13: Mittlere LS-Veränderung gegenüber Baseline bei dem bilateralen Nasenpolypenscore (NPS) in SINUS-24 und SINUS-52 (ITT-Population)
|
Abbildung 13a. SINUS-24
|
Abbildung 13b. SINUS-52
| |
|
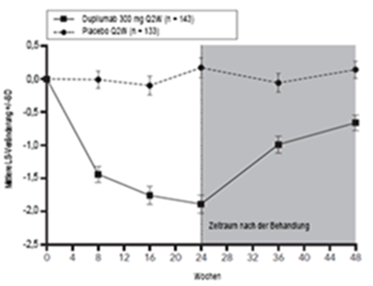
|
|
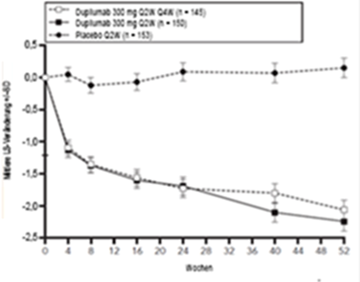
|
In beiden Studien wurden bereits schon bei der ersten Beurteilung in Woche 4 signifikante Verbesserungen bei der NC und bei dem Schweregrad des täglichen Verlusts des Geruchssinns beobachtet. Der mittlere LS-Unterschied bei der NC in Woche 4 lag in der Dupilumab-Gruppe im Vergleich zur Placebo-Gruppe bei -0,41 (95 %-KI: -0,52; -0,30) in SINUS-24 und -0,37 (95 %-KI: -0,46; -0,27) in SINUS-52. Der mittlere LS-Unterschied bei dem Verlust des Geruchssinns in Woche 4 lag in der Dupilumab-Gruppe im Vergleich zur Placebo-Gruppe bei -0,34 (95 %-KI: -0,44; -0,25) in SINUS-24 und -0,31 (95 %-KI: -0,41; -0,22) in SINUS-52.
Eine Verringerung im Anteil der Patienten mit Anosmie wurde in den SINUS-24- und SINUS-52-Studien beobachtet. Zu Beginn litten 74 % bis 79 % der Patienten an Anosmie, was sich in Woche 24 auf 24 % in der SINUS-24-Studie und 30 % in der SINUS-52-Studie verringerte, während es unter Placebo keine Veränderung gab. Eine Verbesserung im nasalen maximalen inspiratorischen Atemstrom (nasal peak inspiratory flow, NPIF) wurde in SINUS-24 und SINUS-52 in Woche 24 beobachtet. Der mittlere LS-Unterschied in der Dupilumab-Gruppe betrug 40,4 l/min (95 %-KI: 30,4; 50,4), während er in der Placebo-Gruppe 36,6 l/min (95 %-KI: 28,0; 45,3) betrug.
Bei den Patienten mit einem Rhinosinusitis-VAS-Score > 7 zu Studienbeginn erreichte in Woche 24 ein grösserer Anteil der Patienten in der Dupilumab-Gruppe einen VAS-Score ≤7 als in der Placebo-Gruppe (83,3 % versus 39,4 % in SINUS-24 und 75,0 % versus 39,3 % in SINUS-52).
In der präspezifizierten, für Multiplizität adjustierten gepoolten Analyse der zwei Studien führte die Behandlung mit Dupilumab im Vergleich mit Placebo zu einer signifikanten Verringerung bei der Anwendung von systemischen Kortikosteroiden und der Notwendigkeit eines operativen Eingriffs an den Nasennebenhöhlen (HR von 0,24; 95 %-KI: 0,17; 0,35) (siehe Abbildung 14). Der Anteil der Patienten, die systemische Kortikosteroide benötigten, wurde um 74 % verringert (HR von 0,26; 95 %-KI: 0,18; 0,38). Die Gesamtzahl der jährlichen Anwendungen systemischer Kortikosteroide wurde um 75 % verringert (RR von 0,25; 95 %-KI: 0,17; 0,37). Die mittlere individuelle jährlich verschriebene Gesamtdosis von systemischen Kortikosteroiden (in mg) während des Behandlungszeitraums war 71 % geringer in der gepoolten Dupilumab-Gruppe als in der gepoolten Placebo-Gruppe (60,5 [531,3] mg versus 209,5 [497,2] mg). Der Anteil der Patienten, die einen operativen Eingriff benötigten, verringerte sich um 83 % (HR von 0,17; 95 %-KI: 0,07; 0,46).
Abbildung 14. Kaplan-Meier-Kurve der Zeit bis zur ersten Anwendung systemischer Kortikosteroide und/oder eines operativen Eingriffs an den Nasennebenhöhlen während des Behandlungszeitraums (ITT-Population) [SINUS-24 und SINUS-52 gepoolt]
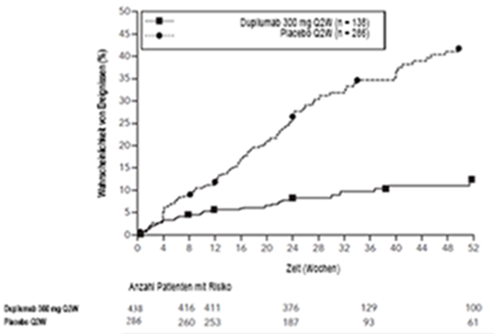
Die Auswirkungen von Dupilumab auf die primären Endpunkte NPS und nasale Kongestion sowie den sekundären Hauptendpunkt Lund-MacKay-Gesamt-CT-Score (LMK) waren vergleichbar bei Patienten mit und ohne vorherigen operativen Eingriff.
Bei Patienten mit komorbidem Asthma wurden in Woche 24, unabhängig vom Eosinophilen-Ausgangswert im Blut, signifikante Verbesserungen bei FEV1 und ACQ-6 beobachtet. Die gepoolte mittlere LS-Veränderung bei der FEV1 im Vergleich zum Ausgangswert lag in Woche 24 für Dupilumab 300 mg alle 2 Wochen (Q2W) bei 0,14 l, während sie bei Placebo bei -0,07 Liter lag, was einem Unterschied von 0,21 Liter entspricht (95 %-KI: 0,13; 0,29). Darüber hinaus wurden im Vergleich zu den Ausgangswerten Verbesserungen bei der FEV1 ab der ersten Beurteilung nach Studienbeginn in Woche 8 in SINUS-24 und in Woche 4 in SINUS-52 beobachtet. Verbesserungen im ACQ-6 bei Patienten mit komorbidem Asthma wurden in beiden Studien beobachtet. Ein Ansprechen war definiert als eine Verbesserung des Scores um 0,5 oder mehr. Der mittlere LS-Unterschied in Woche 24 betrug in der Dupilumab-Gruppe im Vergleich zu Placebo -0,76 (95 %-KI: -1,00 bis -0,51) in SINUS-24 und -0,94 (95 %-KI: -1,19; -0,69) in SINUS-52.
Die Responderrate bei ACQ-6 betrug in Woche 24 bei Dupilumab 300 mg alle 2 Wochen (Q2W) in der SINUS-24-Studie 56 %, bei Placebo 28 % (Odds Ratio 3,17; 95 %-KI: 1,65; 6,09). Die Ansprechrate bei ACQ-6 betrug in Woche 52 bei Dupilumab 300 mg alle 2 Wochen (Q2W) in der SINUS-52-Studie 46 %, bei Placebo 14 % (Odds Ratio 7,02; 95 %-KI: 3,10; 15,90).
Bei Patienten mit NSAID-ERD stimmten die Auswirkungen von Dupilumab auf die primären Endpunkte NPS und NC sowie den sekundären Hauptendpunkt Lund-MacKay-Gesamt-CT-Score (LMK) mit denen überein, die in der CRSwNP-Gesamtpopulation beobachtet wurden.
4) Klinische Wirksamkeit bei Prurigo nodularis (PN)
Das Entwicklungsprogramm zu Prurigo nodularis (PN) beinhaltete zwei 24-wöchige, randomisierte, doppelblinde, placebokontrollierte, multizentrische Parallelgruppenstudien (PRIME und PRIME2) mit 311 Patienten ab 18 Jahren mit mittelschwerer bis schwerer PN, definiert als schwerer Pruritus (WI- NRS ≥7 auf einer Skala von 0 bis 10) und mindestens 20 noduläre Läsionen, deren Erkrankung mit verschreibungspflichtigen topischen Therapien nicht ausreichend kontrolliert werden konnte oder wenn derartige Therapien nicht empfohlen wurden. PRIME und PRIME2 untersuchten neben der Wirkung von Dupilumab auf die Verbesserung des Juckreizes auch dessen Wirkung auf PN-Läsionen, den Dermatologischer-Lebensqualitäts-Index (Dermatology Life Quality Index, DLQI), die Skala zur Erfassung von Angst und Depression (Hospital Anxiety and Depression Scale, HADS) sowie auf Hautschmerzen.
In diesen beiden Studien erhielten Patienten entweder subkutan 600 mg Dupilumab (zwei Injektionen zu je 300 mg) an Tag 1, gefolgt von 300 mg alle 2 Wochen (Q2W) für 24 Wochen oder ein entsprechendes Placebo. Patienten, die eine stabile Behandlung mit schwach oder mittelstark wirksamen TCS oder TCI erhielten, konnten die begleitende Anwendung topischer Steroide fortsetzen. Stark oder sehr stark wirksame TCS oder TCI waren simultan als Rescue-Therapie zugelassen.
In diesen Studien lag das mittlere Alter bei 49,5 Jahren und das mediane Gewicht bei 71,3 kg. 65,3 % der Patienten waren Frauen, 56,6 % Weisse, 6,1 % Schwarze und 34,1 % Asiaten. Zu Studienbeginn lag der mittlere WI-NRS-Wert bei 8,5; 66,3 % hatten 20 bis 100 Knoten (mittelschwer), 33,7 % hatten mehr als 100 Knoten (schwer), 99,7 % waren zuvor topisch behandelt worden, 12,5 % hatten zuvor systemische Kortikosteroide erhalten, 20,6 % hatten zuvor systemische nichtsteroidale Immunsuppressiva erhalten und 4,5 % hatten zuvor Gabapentinoide erhalten. Zu Studienbeginn nahmen 11 % der Patienten stabile Dosen von Antidepressiva ein und wurden angewiesen, diese Arzneimittel während der Studie weiter einzunehmen. 43,4 % wiesen in ihrer Anamnese eine Atopie auf (definiert als atopische Dermatitis in der Anamnese, allergische Rhinitis/Rhinokonjunktivitis, Asthma oder Nahrungsmittelallergie). Der WI-NRS-Wert besteht aus einem Einzelwert, bewertet anhand einer Skala von 0 («kein Juckreiz) bis 10 («schlimmster vorstellbarer Juckreiz»). Teilnehmer wurden gebeten, die Intensität ihres schlimmsten Pruritus-Ereignisses (Juckreiz) innerhalb der letzten 24 Stunden anhand dieser Skala zu bewerten. Der IGA PN-S ist ein Instrument zur Erfassung der ungefähren Anzahl an Knoten, das eine Einteilung in fünf Schweregrade von 0 (frei) bis 4 (schwer) vornimmt.
Der primäre Endpunkt war der Anteil an Patienten mit Verbesserung (Reduktion) auf der WI-NRS um ≥4. Wichtige sekundäre Endpunkte waren unter anderem der Anteil an Studienteilnehmern mit einem IGA PN-S von 0 oder 1 (entspricht 0 bis 5 Knoten).
Die Wirksamkeitsergebnisse für PRIME und PRIME2 sind in Tabelle 22 dargestellt.
Tabelle 22: Ergebnisse der primären und sekundären Endpunkte in den Studien PRIME und PRIME2
|
|
PRIME
|
PRIME2
| |
|
Placebo
(N=76)
|
Dupilumab 300 mg Q2W
(N=75)
|
Unterschied (95 %-KI) Dupilumab vs. Placebo
|
Placebo
(N=82)
|
Dupilumab 300 mg Q2W
(N=78)
|
Unterschied (95 %-KI) Dupilumab vs. Placebo
| |
Anteil Patienten mit Verbesserung (Reduktion) auf WI-NRS um ≥4 Punkte gegenüber der Baseline in Woche 24 (primärer Endpunkt in PRIME)b
|
18,4 %
|
60,0 %
|
42,7 %
(27,76; 57,72)
|
19,5 %
|
57,7 %
|
42,6 %
(29,06; 56,08)
| |
Anteil Patienten mit Verbesserung (Reduktion) auf WI-NRS um ≥4 Punkte gegenüber der Baseline in Woche 12 (primärer Endpunkt in PRIME2)b
|
15,8 %a
|
44,0 %a
|
29,2 %
(14,49; 43,81)a
|
22,0 %
|
37,2 %
|
16,8 %
(2,34; 31,16)
| |
Anteil Patienten mit IGA PN-S von 0 oder 1 in Woche 24b
|
18,4 %
|
48,0 %
|
28,3 %
(13,41; 43,16)
|
15,9 %
|
44,9 %
|
30,8 %
(16,37; 45,22)
| |
Anteil Patienten mit Verbesserung (Reduktion) sowohl auf WI-NRS um ≥4 Punkte gegenüber der Baseline in Woche 24 als auch im IGA PN-S von 0 oder 1 in Woche 24b
|
9,2 %
|
38,7 %
|
29,6 %
(16,42; 42,81)
|
8,5 %
|
32,1 %
|
25,5 %
(13,09; 37,86)
| |
Veränderung in % gegenüber der Baseline auf WI-NRS in Woche 24 (SE)
|
-22,22 (5,74)
|
-48,89 (5,61)
|
-26,67
(-38,44; -14,90)
|
-36,18 (6,21)
|
-59,34 (6,39)
|
-23,16
(-33,81; -12,51)
| |
Veränderung gegenüber der Baseline im DLQI in Woche 24 (SE)
|
-5,77 (1,05)
|
-11,97 (1,02)
|
-6,19
(-8,34; -4,05)
|
-6,77 (1,18)
|
-13,16 (1,21)
|
-6,39
(-8,42; -4,36)
| |
Veränderung gegenüber der Baseline auf Hautschmerz-NRS in Woche 24 (SE)c
|
-2,16 (0,44)
|
-4,33 (0,43)
|
-2,17
(-3,07; -1,28)
|
-2,74 (0,51)
|
-4,35 (0,53)
|
-1,61
(-2,49; -0,73)
| |
Veränderung gegenüber der Baseline auf HADS in Woche 24 (SE)c
|
-2,02 (0,94)
|
-4,62 (0,93)
|
-2,60
(-4,52; -0,67)
|
-2,59 (1,03)
|
-5,55 (1,06)
|
-2,96
(-4,73; -1,19)
|
a Nicht für multiples Testen in PRIME korrigiert.
b Patienten, die zuvor eine Rescue-Therapie erhalten hatten oder bei denen Daten fehlten, wurden als Non-Responder eingestuft.
c Daten von Patienten, die zuvor eine Rescue-Therapie erhalten hatten oder die Studie aufgrund fehlender Wirksamkeit abbrachen, wurden vervollständigt, indem der schlechteste Wert als Ersatzwert verwendet wurde (worst observation carried forward); andere fehlende Daten wurden mittels multipler Imputation vervollständigt.
In den Studien PRIME und PRIME2 stimmten die Behandlungseffekte in den Untergruppen (Gewicht, Alter, Geschlecht, ethnische Herkunft sowie Hintergrundbehandlung einschliesslich Immunsuppressiva) mit den Ergebnissen in der jeweiligen Studienpopulation überein.
5) Eosinophile Ösophagitis (EoE)
Klinische Wirksamkeit bei Erwachsenen und Jugendlichen mit EoE
Das Entwicklungsprogramm zu eosinophiler Ösophagitis beinhaltete einen dreiteiligen Prüfplan über 52 Wochen (TREET), der aus zwei separat randomisierten, doppelblinden, multizentrischen, placebokontrollierten Parallelgruppenstudien von 24-wöchiger Dauer (TREET Teil A und TREET Teil B), gefolgt von einer 28-wöchigen Verlängerungsstudie mit aktiver Behandlung (TREET Teil C) mit erwachsenen und jugendlichen Patienten im Alter von 12 bis 17 Jahren bestand, wobei Patienten mit einem Gewicht unter 40 kg ausgeschlossen waren. Alle Patienten PPI-refraktär, da bei ihnen nach einer mindestens 8-wöchigen Behandlung mit einem hochdosierten Protonenpumpenhemmer (PPI) entweder vor oder während des Screeningzeitraums die Anzahl der intraepithelialen Eosinophilen (eos) ≥15 pro hochauflösendes Gesichtsfeld (high-power field, hpf) betragen musste. Die Patienten mussten zudem einen Score im Dysphagie-Symptom-Fragebogen (Dysphagia Symptom Questionnaire, DSQ) von ≥10 auf einer Skala von 0 bis 84 aufweisen. Die Patienten wurden stratifiziert anhand ihres Alters zum Zeitpunkt des Screenings (12 bis 17 Jahre versus 18 Jahre und älter) und der Anwendung von PPI zum Zeitpunkt der Randomisierung. TREET Teil A wurde zuerst durchgeführt. Mit TREET Teil B wurde begonnen, nachdem die Aufnahme in TREET Teil A abgeschlossen war. Patienten, welche den 24-wöchigen, doppelblinden Behandlungszeitraum in Teil A oder B durchlaufen hatten, erhielten die Möglichkeit, an einer 28-wöchigen Verlängerungsstudie (TREET Teil C) mit aktiver Behandlung teilzunehmen.
In Teil A wurden insgesamt 81 Patienten, 61 Erwachsene und 20 Jugendliche im Alter von 12 bis 17 Jahren, randomisiert und erhielten entweder 300 mg Dupilumab einmal wöchentlich (n = 42) oder Placebo (n = 39). In Teil B wurden insgesamt 240 Patienten, 161 Erwachsene und 79 Jugendliche im Alter von 12 bis 17 Jahren, randomisiert und erhielten entweder 300 mg Dupilumab einmal wöchentlich (n = 80) oder 300 mg Dupilumab alle zwei Wochen (n = 81; das Dosierungsschema mit 300 mg alle zwei Wochen ist nicht für eosinophile Ösophagitis zugelassen) oder Placebo (n = 79). In Teil C erhielten alle Patienten, die zuvor an Teil A teilgenommen hatten, 300 mg Dupilumab (n = 77) wöchentlich. Von den Patienten, die zuvor an Teil B teilgenommen hatten, erhielten diejenigen, die in Teil B Dupilumab erhalten hatten, in Teil C weiter ihr Dosierungsschema und diejenigen, die Placebo erhalten hatten, wurden randomisiert und erhielten entweder das eine oder das andere Dosierungsschema. Es lag im Ermessen des Prüfarztes, die Anwendung von systemischen und/oder oralen topischen Kortikosteroiden oder eine Notfall-Ösophagusdilatation während der Studie zu veranlassen.
In Teil A hatten insgesamt 74,1 % der Patienten vor Studieneinschluss zur Behandlung der eosinophilen Ösophagitis bereits orale topische Kortikosteroide angewendet und bei 43,2 % war vor Studieneinschluss eine Ösophagusdilatation durchgeführt worden. In Teil B hatten insgesamt 73,3 % der Patienten vor Studieneinschluss zur Behandlung der eosinophilen Ösophagitis bereits orale topische Kortikosteroide angewendet und bei 35,4 % war vor Studieneinschluss eine Ösophagusdilatation durchgeführt worden.
Die koprimären Wirksamkeitsendpunkte in beiden Studien waren der Anteil der Patienten mit erreichter histologischer Remission, definiert als maximaler ösophagealer, intraepithelialer Eosinophilen-Wert von ≤6 eos/hpf in Woche 24, sowie die absolute Veränderung des patientenberichteten DSQ-Scores zwischen Baseline und Woche 24. Die sekundären Endpunkte waren unter anderem folgende Veränderungen gegenüber dem Ausgangswert bei Studieneinschluss: prozentuale Veränderung des maximalen ösophagealen, intraepithelialen Eosinophilen-Werts (eos/hpf), absolute Veränderung des mittleren Schweregrad-Scores (Grade) des histologischen EoE-Bewertungssystems (Eosinophilic Esophagitis Histology Scoring System, EoEHSS), absolute Veränderung des mittleren Ausmass-Scores (Stage) für EoEHSS, absolute Veränderung des für EoE (EoE-Endoscopic Reference Score, EoE-EREFS) sowie Anteil der Patienten, die einen maximalen ösophagealen, intraepithelialen Eosinophilen-Wert von ≤15 eos/hpf erreichen. Die demografischen Angaben und Baseline-Charakteristika für TREET Teil A und Teil B sind in Tabelle 23 unten dargestellt.
Tabelle 23: Demografische Daten und Baseline-Charakteristika (TREET, Teil A und Teil B)
|
Parameter
|
TREET Teil A
(n = 81)
|
TREET Teil B
(n = 240)
| |
Mittleres Alter in Jahren (SE)
|
31,5 (14,3)
|
28,1 (13,1)
| |
% männlich
|
60,5
|
63,8
| |
% weiss
|
96,3
|
90,4
| |
Gewicht (kg), Mittelwert (SE)
|
77,8 (21,0)
|
76,2 (20,6)
| |
BMI (kg/m2), Mittelwert (SE)
|
26,1 (6,3)
|
25,7 (6,2)
| |
Dauer der EoE (Jahre), Mittelwert (SE)
|
5,01 (4,3)
|
5,57 (4,8)
| |
Vorherige Einnahme oraler Kortikosteroide (%)
|
74,1
|
73,3
| |
Vorherige Ösophagusdilatation (%)
|
43,2
|
35,4
| |
PPI-Anwendung bei Randomisierung (%)
|
67,9
|
72,5
| |
Eliminationsdiät bei Screening (%)
|
40,7
|
37,1
| |
DSQ (0-84a), Mittelwert (SE)
|
33,6 (12,4)
|
36,7 (11,2)
| |
Maximaler ösophagealer, intraepithelialer EOS-Wert aus 3 Bereichen, Mittelwert (SE)
|
89,3 (48,3)
|
87,1 (45,8)
| |
Mittlerer ösophagealer, intraepithelialer EOS-Wert aus 3 Bereichen, Mittelwert (SE)
|
64,3 (37,6)
|
60,5 (32,9)
| |
Schweregrad (Grade Score) (EoEHSS) [0-3a], Mittelwert (SE)
|
1,3 (0,4)
|
1,3 (0,4)
| |
Ausmass (Stage Score) (EoEHSS) [0-3a], Mittelwert (SE)
|
1,3 (0,4)
|
1,3 (0,3)
| |
Gesamtscore (EREFS) [0-18a], Mittelwert (SE)
|
6,3 (2,8)
|
7,2 (3,2)
|
a Höhere Scores weisen auf einen höheren Schweregrad der Erkrankung hin.
SE = Standard Error [Standardfehler]
Die Ergebnisse der TREET.Studien Teil A und Teil B sind in Tabelle 24 unten dargestellt.
Tabelle 24: Wirksamkeitsergebnisse von Dupilumab in Woche 24 bei Patienten ab 12 Jahren mit eosinophiler Ösophagitis (TREET Teil A und Teil B)
|
|
TREET Teil A
|
TREET Teil B
| |
Dupilumab
300 mg QW
n = 42
|
Placebo
n = 39
|
Unterschied vs. Placebo
(95 %-KI)d
|
Dupilumab
300 mg QW
n = 80
|
Placebo
n = 79
|
Unterschied vs. Placebo
(95 %-KI)d
| |
Koprimäre Endpunkte
| |
Anteil Patienten mit erreichter histologischer Remission (maximaler ösophagealer, intraepithelialer EOS-Wert ≤6 eos/hpf), n (%)
|
25
(59,5)
|
2
(5,1)
|
55,3
(39,58; 71,04)
|
47
(58,8)
|
5
(6,3)
|
53,5
(41,20; 65,79)
| |
Absolute Veränderung gegenüber Ausgangswert im DSQ-Score (Dysphagie-Symptom-Fragebogen) (0-84a), mittlerer LS-Unterschied (SE)
|
-21,92
(2,53)
|
-9,60 (2,79)
|
-12,32
(-19,11; -5,54)
|
-23,78
(1,86)
|
-13,86
(1,91)
|
-9,92
(-14,81; -5,02)
| |
Sekundäre Endpunkte
| |
Prozentuale Veränderung des maximalen ösophagealen, intraepithelialen EOS-Werts gegenüber Ausgangswert, mittlerer LS-Unterschied (SE)
|
-71,24
(6,95)
|
-2,98
(7,60)
|
-68,26
(-86,90; -49,62)
|
-80,24
(8,34)
|
8,38
(10,09)
|
-88,62
(-112,19; 65,05)
| |
Absolute Veränderung des Grade-Scores des EoEHSS (0-3b) gegenüber Ausgangswert, mittlerer LS-Unterschied (SE)
|
-0,76
(0,06)
|
-0,00 (0,06)
|
-0,76
(-0,91; -0,61)
|
-0,83
(0,04)
|
-0,15
(0,05)
|
-0,682
(-0,79; -0,57)
| |
Absolute Veränderung des Stage-Scores des EoEHSS (0-3b) gegenüber Ausgangswert, mittlerer LS-Unterschied (SE)
|
-0,75
(0,06)
|
-0,01 (0,06)
|
-0,74
(-0,88, -0,60)
|
-0,80
(0,04)
|
-0,13
(0,04)
|
-0,672
(-0,78; -0,57)
| |
Absolute Veränderung des EoE-EREFS (0-18c) gegenüber Ausgangswert, mittlerer LS-Unterschied (SE)
|
-3,2
(0,41)
|
-0,3
(0,41)
|
-2,9
(-3,91; -1,84)
|
-4,5
(0,36)
|
-0,6
(0,38)
|
-3,8
(-4,77; -2,93)
| |
Anteil der Patienten, die einen maximalen ösophagealen, intraepithelialen EOS-Wert von <15 eos/hpf, erreichen, n (%)
|
27
(64,3)
|
3
(7,7)
|
57
(41,69; 73,33)
|
66
(82,5)
|
6
(7,6)
|
74,9
(64,25; 85,5)
|
a Über zwei Wochen erhobene DSQ-Gesamtscores reichen von 0 bis 84; höhere Scores weisen auf erhöhte Häufigkeit und höheren Schweregrad von Dysphagie hin.
b EoEHSS-Scores reichen von 0 bis 3; höhere Scores weisen auf einen höheren Schweregrad und ein grösseres Ausmass der histologischen Anomalien hin.
c EoE-EREFS-Gesamtscores reichen von 0 bis 18; höhere Scores weisen auf mehr endoskopische Beobachtungen von schwererwiegenden entzündlichen Vorgängen und Remodeling hin.
d Mittlerer LS-Unterschied für kontinuierliche Endpunkte und absoluter Unterschied im Ausmass der kategoriespezifischen Endpunkte.
Die Wirksamkeitsergebnisse der koprimären und wichtigsten sekundären Endpunkte in der Subgruppe, die zuvor orale topische Kortikosteroide eingenommen hatten, und bei Patienten, bei denen orale topische Kortikosteroide zu einer unzureichenden Kontrolle oder Unverträglichkeit führten oder kontraindiziert waren, waren konsistent mit der Gesamtpopulation.
Obwohl alle Patienten PPI-refraktär waren, wie dies vor Randomisierung der Studie gezeigt wurde, nahmen bestimmte Patienten während der Studie weiterhin PPI ein. Es gab keine bedeutsamen Unterschiede bei den erreichten koprimären und wichtigsten Wirksamkeitsendpunkten von TREET Teil A und Teil B zwischen den Untergruppen von Patienten, welche die Anwendung von PPI gleichzeitig fortsetzten, und der Untergruppe, die keine PPI anwendeten.
In den Teilen A und B erreichte im Vergleich zu Placebo ein grösserer Anteil an Patienten in der Gruppe, denen randomisiert Dupilumab zugewiesen worden war, eine histologische Remission (maximaler ösophagealer, intraepithelialer Eosinophilen-Wert von ≤6 eos/hpf). Der Anteil an Patienten mit histologischer Remission nach 24-wöchiger Behandlung in den Teilen A und B blieb in Teil C über 52 Wochen erhalten.
Die Behandlung mit Dupilumab führte im Vergleich zu Placebo bereits ab Woche 4 auch zu einer signifikanten Verbesserung der mittleren LS-Veränderung des DSQ-Scores, die bis Woche 24 erhalten blieb. Die Wirksamkeit in Teil C war vergleichbar mit den in den Teilen A und B beobachteten Ergebnissen mit kontinuierlicher Verbesserung im DSQ bis Woche 52 (siehe Abbildung 15 zu Teil A und Teil C der TREET-Studie und Abbildung 16 zu Teil B und Teil C der TREET-Studie).
Abbildung 15: Mittlere Veränderung gegenüber Ausgangswert des DSQ-Scores bei Patienten ab 12 Jahren mit eosinophiler Ösophagitis (TREET, Teil A und Teil C)

Abbildung 16: Mittlere Veränderung gegenüber Ausgangswert des DSQ-Scores bei Patienten ab 12 Jahren mit eosinophiler Ösophagitis (TREET, Teil B und Teil C)
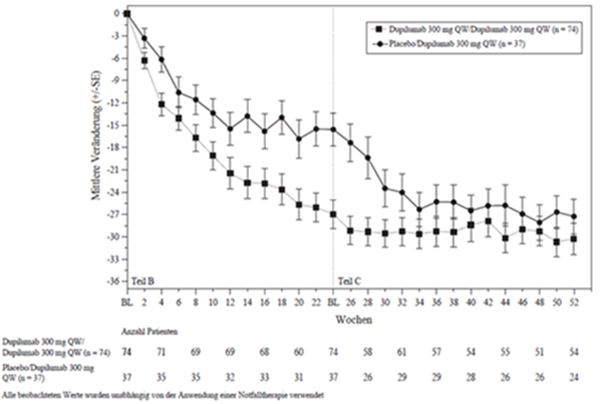
Klinische Wirksamkeit bei Kindern im Alter von 1 bis 11 Jahren mit EoE und einem Körpergewicht von mindestens 15 kg
Die Wirksamkeit und Sicherheit von Dupilumab wurden in einer zweiteiligen Studie (EoE KIDS Teil A und Teil B) bei pädiatrischen Patienten im Alter von 1 bis 11 Jahren mit EoE untersucht. Alle in die Studie aufgenommenen Patienten hatten zuvor auf eine konventionelle medikamentöse Therapie (Protonenpumpenhemmer) nicht angesprochen, bei 77 % der Patienten wurde ein anderes herkömmliches Medikament (orale topische Kortikosteroide) vor Studieneinschluss angewendet und 54 % der Patienten waren unzureichend mit oralen topischen Kortikosteroiden kontrolliert oder vertrugen diese nicht oder für sie kam eine solche Therapie nicht in Betracht. Bei den Patienten, die für die Studie geeignet waren, betrug die Anzahl der intraepithelialen Eosinophilen (eos) ≥15 pro hochauflösendes Gesichtsfeld (high-power field, hpf) trotz Behandlung mit hochdosierten Protonenpumpenhemmer (PPI) vor oder während des Screeningzeitraums und zeigten vorher Anzeichen und Symptome von EoE. Teil A war eine randomisierte, doppelblinde, multizentrische, placebokontrollierte Parallelgruppenstudievon 16-wöchiger Dauer. Teil B war eine Verlängerungsstudie mit aktiver Behandlung, bei der die Dosierungsschemata von Dupilumab zusätzlich über 36 Wochen untersucht wurden.
Bei Teil A wurde Dupilumab im Vergleich zu einem Placebo entsprechend den Dosierungsschemata nach dem Körpergewicht ≥15 bis < 30 kg (200 mg alle zwei Wochen) und ≥30 bis < 60 kg (300 mg alle zwei Wochen) untersucht. Das Dosierungsschema von Dupilumab wurde für pädiatrische Patienten im Alter von 1 bis 11 Jahren und einem Körpergewicht von ≥40 kg (300 mg wöchentlich) auf der Grundlage von Simulationen mit einem populationspharmakokinetischen Modell festgelegt, um die Expositionen für Erwachsene und pädiatrischen Patienten im Alter von 12 bis 17 Jahren mit EoE einzuhalten, die 300 mg wöchentlich erhielten und bei denen eine histologische symptomatische Wirksamkeit beobachtet worden war (siehe «Klinische Wirksamkeit → Pädiatrische Population» und «Pharmakokinetik»).
Insgesamt wurden 61 Patienten in Teil A aufgenommen. Das mittlere Alter lag bei 8 Jahren (1 bis 11 Jahren), das mittlere Gewicht bei 27,9 kg, 75,4 % der Patienten waren Männer, 85,2 % Weisse, 11,5 % Schwarze 1,6 % Asiaten. Insgesamt 59 Patienten von Teil A nahmen an Teil B teil. Die meisten Patienten erhielten zuvor orale topische Kortikosteroide (OTK) zur Behandlung von EoE (51 Patienten von 61; 83,6 %) und 34,4 % berichteten, dass OTK zuvor bei EoE wirksam gewesen waren. Zu Studienbeginn lag der mittlere maximale ösophageale, intraepitheliale Eosinophilen-Wert bei 97,7 (48,24) bzw. 82,2 (36,14) in den Dupilumab- und Placebo-Gruppen.
Primärer Endpunkt der Wirksamkeit in Teil A war der Anteil der Patienten mit erreichter histologischer Remission, die anhand eines maximalen ösophagealen, intraepithelialen Eosinophilen-Werts von ≤6 eos/hpf in der Woche 16 angeben wurde. Sekundäre Beurteilungskriterien waren der Anteil der Patienten mit erreichtem ösophagealen, intraepithelialen Eosinophilen-Wert von < 15 eos/hpf und die Veränderungen gegenüber dem Ausgangswert: ösophagealer, intraepithelialer Eosinophilen-Wert (eos/hpf), absolute Veränderung der mittleren Veränderung des mittleren Schweregrad-Scores (Grade) des EoE-Bewertungssystems des histologischen EoE (Eosinophilic Esophagitis Histology Scoring System, EoEHSS), absolute Veränderung des mittleren Ausmass-Scores (Stade) des EoEHSS und absolute Veränderung des endoskopischen Referenzscores für EoE (EoE-Endoscopic Reference Score, EoE-EREFS). Die Auswirkung auf Anzeichen von EoE wurde mit Hilfe der beobachterberichteten Ergebnisse gemessen; anhand des von den Pflegepersonen ausgefüllten pädiatrischen Fragebogens zu Anzeichen/Symptomen von EoE (Pediatric EoE Sign/Symptom Questionnaire-Caregiver, PESQ-C) wurde der Anteil an Tagen mit einer oder mehreren Anzeichen von EoE und anhand des pädiatrischen Scores der Symptome von eosinophiler Ösophagitis (Pediatric Eosinophilic Esophagitis Symptom Score, PEESS) wurde die Häufigkeit und Schwere der Anzeichen von EoE bewertet.
Die Wirksamkeitsergebnisse in Teil A sind unten und in Tabelle 25 aufgeführt.
Tabelle 25: Ergebnisse der Wirksamkeit von Dupilumab in Woche 16 bei Patienten im Alter von 1 bis 11 Jahren mit eosinophiler Ösophagitis und einem Gewicht von mindestens 15 kg (EoE KIDS, Teil A)
|
|
Dupilumaba
N=32
|
Placebo
N=29
|
Unterschied zu Placebo
(95 % IC)
| |
Primärer Endpunkt
| |
Anteil der Patienten mit erreichter histologischen Remission (maximalem ösophagealen, intraepithelialen Eosinophilen-Wert von ≤6 eos/hpf), n (%)b
|
21
(65,6)
|
1
(3,4)
|
62,0
(44,00; 79,95)
| |
Sekundärer Endpunkt
| |
Anteil der Patienten mit erreichtem maximalen ösophagealen, intraepithelialen Eosinophilen-Wert von < 15 eos/hpf), n (%)b
|
26 (81,3)
|
1
(3,4)
|
78,0
(63,10; 92,86)
| |
Prozentuale Veränderung des maximalen ösophagealen, intraepithelialen Eosinophilen-Werts gegenüber Baseline (eos/hpf), mittlere LS-Veränderung (SE)c
|
-83,99
(13,25)
|
20,42
(13,67)
|
-104,41
(-142,06; -66,75)
| |
Absolute Veränderung des Schweregrad-Scores (0-3d) bei EoEHSS gegenüber Baseline, mittlere LS-Veränderung (SE)
|
-0,907
(0,05)
|
-0,010
(0,05)
|
-0,897
(-1,04; -0,75)
| |
Absolute Veränderung des Ausmass-Scores (0-3d) bei EoEHSS gegenüber Baseline, mittlere LS-Veränderung (SE)
|
-0,874
(0,05)
|
-0,002
(0,05)
|
-0,871
(-1,01; -0,73)
| |
Absolute Veränderung des EoE-EREFS (0-18e) gegenüber Baseline, mittlere LS-Veränderung (SE)
|
-3,6
(0,42)
|
0,0
(0,46)
|
-3,6
(-4,89; -2,40)
|
a Dupixent wurde gemäss den progressiven Dosierungsschemata nach Körpergewicht bewertet: ≥15 bis < 30 kg (200 mg alle zwei Wochen) und ≥30 à < 60 kg (300 mg alle zwei Wochen).
b Für die histologische Remission wurde der prozentuale Unterschied mit Hilfe der Mantel-Haenszel-Methode unter Berücksichtigung der Gewichtsgruppe bei Studieneinschluss (≥15 bis < 30 kg und ≥30 bis < 60 kg) geschätzt.
c Der Unterschied bei der absoluten oder prozentualen Veränderung wurde mit Hilfe des ANCOVA-Modells unter Verwendung der Messung zu Studienbeginn als Kovariate und der Behandlung und der Gewichtsgruppe zu Studienbeginn (≥15 bis < 30 kg und ≥30 bis < 60 kg) als feste Faktoren geschätzt.
d Die EoEHSS-Scores reichen von 0 bis 3; höhere Scores weisen auf höheren Schweregrad und grösseres Ausmass der histologischen Veränderungen hin. Die mittleren EoEHSS-Schweregrad-Scores bei Studienbeginn betrugen 1,35 (0,42) und 1,30 (0,37) in den Dupilumab- bzw. Placebo-Gruppen und die mittleren EoEHSS-Ausmass-Scores zu Studienbeginn betrugen 1,31 (0,32) und 1,33 (0,37) in den Dupilumab- bzw. Placebo-Gruppen.
e Die EoE-EREFS-Gesamtscores reichen von 0 bis 18; höhere Scores weisen auf endoskopische Beobachtungen von schwererwiegenden entzündlichen Vorgängen und Remodeling hin.
Im Teil B erreichten 17 der 32 Patienten, die mit Dupilumab in Teil A und B behandelt wurden, und 8 der 15 Patienten, die mit Placebo in Teil A und mit Dupilumab in Teil B behandelt wurden, die histologische Remission in Woche 52.
Eine Verbesserung des Anteils der Tage mit einem oder mehreren Anzeichen von EoE (nach PESQ-C) wurde bei den Studienteilnehmernbeobachtet, die mit Dupilumab behandelt wurden, im Vergleich zu Placebo nach 16-wöchiger Behandlung in Teil A.
6) Klinische Wirksamkeit bei chronisch obstruktiver Lungenerkrankung (COPD)
Das Entwicklungsprogramm zur chronisch obstruktiven Lungenerkrankung (COPD) umfasste zwei randomisierte, doppelblinde, multizentrische, placebokontrollierte Parallelgruppenstudien (BOREAS und NOTUS) mit einer Behandlungsdauer von 52 Wochen, die insgesamt 1874 erwachsene COPD-Patienten umfassten, um Dupilumab als Add-on-Erhaltungstherapie zu untersuchen. Die beiden Studien schlossen Patienten ein, die eine COPD-Diagnose mit mittelschwerer bis schwerer Einschränkung des Luftstroms aufwiesen (FEV1/FVC-Verhältnis nach Gabe eines Bronchodilatators < 0,7 und FEV1 nach Gabe eines Bronchodilatators von 30 % bis 70 % des vorhergesagten Wertes), chronisch produktivem Husten über mindestens 3 Monate im Vorjahr sowie eine minimale Blut-Eosinophilenzahl von 300 Zellen/µL bei Aufnahme in die Studie aufwiesen. Die Patienten waren nicht kontrolliert bei einem Dyspnoe-Score des Medical Research Council (MRC) ≥2 (Skala 0–4) und hatten mindestens zwei mittelschwere oder eine schwere Exazerbation im Vorjahr trotz einer Dreifach-Erhaltungstherapie, bestehend aus einem langwirksamen Muskarin-Antagonisten (long-acting muscarinic antagonist, LAMA), einem langwirksamen Beta-Agonisten (long-acting beta agonist, LABA) und einem inhalativen Kortikosteroid (ICS). Die Patienten durften eine Erhaltungstherapie bestehend aus LAMA und LABA erhalten, wenn ICS kontraindiziert war. Exazerbationen wurden als mittelschwer definiert, wenn eine Behandlung mit systemischen Kortikosteroiden und/oder Antibiotika erforderlich war; oder als schwer, wenn sie eine Krankenhausbehandlung oder eine Beobachtung von mehr als 24 Stunden in einer Notfallstation oder Akutpflegeeinrichtung erforderten.
In beiden Studien wurden die Patienten randomisiert und erhielten über einen Zeitraum von 52 Wochen zusätzlich zur bestehenden Erhaltungstherapie entweder Dupilumab 300 mg alle zwei Wochen (Q2W) oder Placebo. In beiden Studien war der primäre Endpunkt die annualisierte Rate mittelschwerer oder schwerer COPD-Exazerbationen während des 52-wöchigen Behandlungszeitraums. Die sekundären Endpunkte umfassten Veränderungen des FEV1 vor Bronchodilatation zwischen Baseline und Woche 12 und 52, sowohl in der Gesamtpopulation als auch in der Subgruppe der Patienten mit einem initialen FeNO ≥20 ppb, Veränderungen des St. Georges-Gesamtscores (St. George's Respiratory Questionnaire, SGRQ) in Woche 52 gegenüber Baseline und die annualisierte Rate mittelschwerer oder schwerer COPD-Exazerbationen in der Subgruppe der Patienten mit einem initialen FeNO ≥20 ppb während des 52-wöchigen Behandlungszeitraums.
Die demografischen Daten und Baseline-Charakteristika der Studien BOREAS und NOTUS sind in Tabelle 26 dargestellt.
Tabelle 26: Demografische Daten und Baseline-Charakteristika (BOREAS und NOTUS)
|
Parameter
|
BOREAS
(n = 939)
|
NOTUS
(n = 935)
| |
Mittleres Alter (Jahre) (± SD)
|
65,1 (8,1)
|
65,0 (8,3)
| |
Männlich (%)
|
66,0
|
67,6
| |
Kaukasische Patienten (%)
|
84,1
|
89,6
| |
·Mittlere Raucheranamnese (Packungsjahre) (± SD)
|
40,5 (23,4)
|
40,3 (27,2)
| |
Aktive Raucher (%)
|
30
|
29,5
| |
Emphysem (%)
|
32,6
|
30,4
| |
Mittlere COPD-Dauer (Jahre) (± SD)
|
8,8 (6,0)
|
9,3 (6,4)
| |
Mittlere Anzahl mittelschwerera oder schwererb Exazerbationen im Vorjahr (± SD)
|
2,3 (1,0)
|
2,1 (0,9)
| |
Mittlere Anzahl schwerer Exazerbationenb im Vorjahr (± SD)
|
0,3 (0,7)
|
0,3 (0,6)
| |
COPD-Erhaltungstherapie bei Baseline: ICS/LAMA/LABA (%)
|
97,6
|
98,8
| |
Mittleres FEV1/FVC-Verhältnis nach Bronchodilatation (± SD)
|
0,49 (0,12)
|
0,50 (0,12)
| |
Mittlerer FEV1-Wert (l) vor Bronchodilatation (± SD)
|
1,30 (0,46)
|
1,36 (0,50)
| |
Mittlerer FEV1-Wert (l) nach Bronchodilatation (± SD)
|
1,40 (0,47)
|
1,45 (0,49)
| |
Mittlerer Prozentsatz des vorhergesagten FEV1 nach Bronchodilatation (%) (± SD)
|
50,6 (13,1)
|
50,1 (12,6)
| |
Mittlerer SGRQ-Gesamtscore (± SD)
|
48,4 (17,4)
|
51,5 (17,0)
| |
Mittlerer E-RS:COPD-Gesamtscore (± SD)
|
12,9 (7,1)
|
13,3 (7,0)
| |
Mittlerer BODE-Index-Score (± SD)
|
4,1 (1,7)
|
4,0 (1,6)
| |
Mittlerer FeNO-Wert ppb (± SD)
|
24,3 (22,4)
|
24,6 (26,0)
| |
Mittlere Eosinophilenzahl im Blut bei Baseline (Zellen/µl) (± SD)
|
401 (298)
|
407 (336)
|
ICS = inhalatives Kortikosteroid; LAMA = langwirksamer Muskarin-Antagonist; LABA = langwirksamer Beta-Agonist, FEV1 = forciertes exspiratorisches Volumen pro Sekunde; FVC = forcierte Vitalkapazität; FeNO = fraktioniertes exhaliertes Stickstoffmonoxid; BODE = Körpermassenindex, Atemwegsobstruktion, Dyspnoe, Kapazität bei Belastung (body-mass index, airflow obstruction, dyspnea, exercise capacity, BODE) a Exazerbationen, die mit systemischen Kortikosteroiden und/oder Antibiotika behandelt wurden
b Exazerbationen, die einen Krankenausaufenthalt oder eine Überwachung von mehr als 24 Stunden in einer Notfallstation oder Akutpflegeeinrichtung erforderten
Exazerbationen
In beiden Studien zeigte Dupilumab gegenüber Placebo eine statistisch signifikante Senkung der annualisierten Rate mittelschwerer oder schwerer COPD-Exazerbationen, wenn es mit der Erhaltungstherapie kombiniert wurde (siehe Tabelle 27).
Tabelle 27: Annualisierte Rate mittelschwerera oder schwererb COPD-Exazerbationen in den Studien BOREAS und NOTUS
|
Studie
|
Behandlung
(n)
|
Rate
(Exazerbationen/Jahr)
|
Relatives Risiko vs. Placebo
(95-%-KI)
|
Senkung der Exazerbationsrate vs. Placebo (%)
| |
Primärer Endpunkt: Mittelschwerea oder schwereb COPD-Exazerbationen
| |
BOREAS
|
DUPIXENT 300 mg alle 2 Wochen
(n = 468)
|
0,78
|
0,705
(0.581, 0.857)c
|
30 %
| |
Placebo
(n = 471)
|
1,10
|
|
| |
NOTUS
|
DUPIXENT 300 mg alle 2 Wochen
(n= 470)
|
0,86
|
0,664
(0.535, 0.823)d
|
34 %
| |
Placebo
(n = 465)
|
1,30
|
|
| |
Gepoolte Komponente des primären Endpunktese: Schwere COPD-Exazerbationen
| |
BOREAS und NOTUS
|
DUPIXENT 300 mg alle 2 Wochen
(n = 938)
|
0,08
|
0,674
(0,438 - 1,037)
|
33 %
| |
Placebo
(n = 936)
|
0,12
|
|
|
a Exazerbationen, die mit systemischen Kortikosteroiden und/oder Antibiotika behandelt wurden
b Exazerbationen, die einen Krankenhausaufenthalt oder eine Beobachtung für > 24 Stunden in einer Notfallstation/Akutpflegeeinrichtung erforderten oder zum Tod führten
c p-Wert = 0,0005
d p-Wert = 0,0002
e Die Analyse des Komponenten des primären Endpunktes wurde nicht an die Multiplizität angepasst
In beiden Studien war die über 52 Wochen beobachtete kumulierte mittlere Anzahl mittelschwerer oder schwerer Exazerbationen bei mit Dupilumab behandelten Patienten niedriger im Vergleich zu Placebo (siehe Abbildungen 17 und 18).
Abbildung 17: Kumulierte mittlere Anzahl mittelschwerer oder schwerer COPD-Exazerbationen über 52 Wochen in der BOREAS-Studie
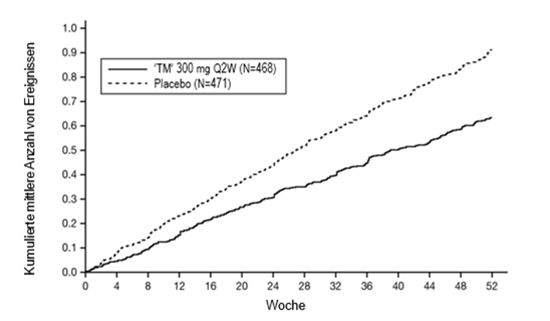
Abbildung 18: Kumulierte mittlere Anzahl mittelschwerer oder schwerer COPD-Exazerbationen über 52 Wochen in der NOTUS-Studie
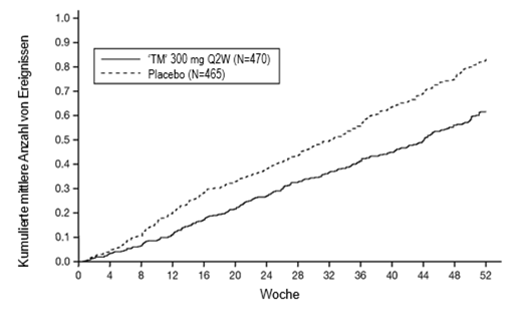
Die Zeitspanne bis zum Auftreten der ersten mittelschweren oder schweren COPD-Exazerbation war bei Patienten unter Dupilumab gegenüber Patienten, die in der BOREAS-Studie Placebo erhielten, verlängert (RR: 0,80; 95-%- KI: 0,66; 0,98) und NOTUS (RR: 0,71; 95-%-KI: 0,57; 0,889).
In der Subgruppenanalyse von Patienten mit einem erhöhten initialen FeNO bei Baseline (≥20 ppb) in BOREAS (n=383) reduzierte die Behandlung mit Dupilumab die annualisierte Rate mittelschwerer oder schwerer COPD-Exazerbationen im Vergleich zu Placebo statistisch signifikant (RR: 0,625; 95-%-KI: 0,45, 0,869; p = 0,005). In der NOTUS-Studie zeigte die Behandlung mit Dupilumab eine nominal signifikante Reduktion der annualisierten Rate mittelschwerer oder schwerer COPD-Exazerbationen in der Subgruppe der Patienten mit einem erhöhten FeNO (≥20 ppb) bei Baseline (n = 355) im Vergleich zu Placebo (RR: 0,47; 95-%-KI: 0,33, 0,68).
Eine Senkung der annualisierten Rate mittelschwerer oder schwerer COPD-Exazerbationen wurde in allen vordefinierten Subgruppen beobachtet, einschliesslich Alter, Geschlecht, ethnischer Herkunft, Raucherstatus, Eosinophilenzahl im Blut, Anzahl der Exazerbationen im Vorjahr (≤2, 3 und ≥4), hochdosiertem ICS bei Baseline und prozentualem Anteil des vorhergesagten FEV1 nach Bronchodilatation bei Baseline (< 50 %, ≥50 %). Bei Patienten mit Emphysem stimmte die Senkung der Rate mittelschwerer oder schwerer Exazerbationen mit der Gesamtpopulation überein.
Lungenfunktion
In beiden Studien zeigte Dupilumab in Kombination mit einer Erhaltungstherapie eine statistisch signifikante Verbesserung des FEV1 vor Bronchodilatation in Wochen 12 und 52 im Vergleich zu Placebo (siehe Tabelle 28). Bei mit Dupilumab behandelten Patienten wurden gegenüber Placebo bereits ab Woche 2 (BOREAS) (erste Beurteilung) und ab Woche 4 (NOTUS) grössere Verbesserungen der Lungenfunktion beobachtet (mittlere LS-Veränderung des FEV1 vor Bronchodilatation gegenüber Baseline) und blieben bis Woche 52 erhalten.
In der BOREAS-Studie wurden bei Behandlung mit Dupilumab gegenüber Placebo schnelle Verbesserungen des FEV1 nach Bronchodilatation, des FEV1/FVC-Verhältnisses nach Bronchodilatation und der FVC vor Bronchodilatation bereits in Woche 2 (erste Beurteilung) beobachtet und bis Woche 52 beibehalten. In der NOTUS-Studie wurden bei Behandlung mit Dupilumab gegenüber Placebo schnelle Verbesserungen des FEV1 nach Bronchodilatation und des FEV1/FVC-Verhältnisses nach Bronchodilatation in Woche 8 bzw. Woche 2 beobachtet und blieben bis Woche 52 erhalten.
Tabelle 28: Mittlere Veränderung der Lungenfunktionsendpunkte gegenüber Baseline in BOREAS und NOTUS
|
|
|
BOREAS
|
|
|
NOTUS
|
| |
|
Dupilumab
(n = 468)
|
Placebo
(n = 471)
|
Differenz (95-%-KI) Dupilumab vs. Placebo
|
Dupilumab
(n = 470)
|
Placebo
(n = 465)
|
Differenz (95-%-KI) Dupilumab vs. Placebo
| |
Mittlere LS-Veränderung des FEV1 vor Bronchodilatation in Woche 12 gegenüber Baseline (SE)
|
0,160 (0,018)
|
0,077
(0,018)
|
0,083
(0,042 - 0,125)a
|
0,139 (0,017)
|
0,057 (0,017)
|
0,082 (0,040 - 0,124)f
| |
Mittlere LS-Veränderung des FEV1 vor Bronchodilatation in Woche 52 gegenüber Baseline (SE)k
|
0,153 (0,019)
|
0,070
(0,019)
|
0,083
(0,038 - 0,128)b
|
0,115 (0,021)
|
0,054 (0,020)
|
0,062
(0,011 - 0,113)g
| |
Mittlere LS-Veränderung des FEV1 nach Bronchodilatation in Woche 12 gegenüber Baseline (SE)
|
0,156 (0,018)
|
0,084
(0,018)
|
0,072
(0,030 - 0,115)c
|
0,136 (0,020)
|
0,064 (0,020)
|
0,072 (0,023 - 0,121)h
| |
Mittlere LS-Veränderung des FEV1/FVC-Verhältnisses nach Bronchodilatation in Woche 12 gegenüber Baseline (SE)
|
0,037 (0,004)
|
0,023
(0,004)
|
0,014
(0,005 - 0,023)d
|
0,030 (0,004)
|
0,013 (0,004)
|
0,017 (0,006 - 0,028)i
| |
Mittlere LS-Veränderung des FVC vor Bronchodilatation in Woche 12 gegenüber Baseline (SE)
|
0,098 (0,022)
|
0,029
(0,022)
|
0,069
(0,016 - 0,121)e
|
0,083 (0,024)
|
0,018 (0,024)
|
0,066 (0,005 - 0,126)j
|
LS = kleinste Quadrate, SE = Standardfehler, FEV1 = forciertes exspiratorisches Volumen, CVF = forcierte Vitalkapazität
ap-Wert < 0,0001; bp-Wert = 0,0003 (alle statistisch signifikant gegenüber Placebo mit Anpassung an die Multiplizität);
cnominaler p-Wert = 0,0010; dnominaler p-Wert= 0,0016; enominaler p-Wert = 0,0103;
fnominaler p-Wert = 0,0001; gnominaler p-Wert = 0,0182 (alle statistisch signifikant gegenüber Placebo mit Anpassung an die Multiplizität);
hnominaler p-Wert = 0,0042; inominaler p-Wert = 0,0020; jnominaler p-Wert = 0,0327;
kWirksamkeitsergebnisse für die mittlere Veränderung des FEV1 vor Bronchodilatation in Woche 52 gegenüber Baseline für 721 von 935 Patienten, die den 52-wöchigen Behandlungszeitraum abgeschlossen haben oder die Studie zum Zeitpunkt der Datenanalyse abgebrochen hatten.
In der Subgruppenanalyse der Patienten mit erhöhtem FeNO (≥20 ppb) bei Baseline verbesserte die Behandlung mit Dupilumab in der BOREAS-Studie (n = 383) den FEV1-Wert vor Bronchodilatation gegenüber Baseline in Woche 12 statistisch signifikant (mittlere LS-Veränderung: 0,232 Dupilumab vs. 0,108 Placebo; mittlere LS-Differenz: 0,124 [95-%-KI: 0,045, 0,203]; p = 0,002) und Woche 52 (mittlere LS-Veränderung: 0,247 Dupilumab vs. 0,120 Placebo; mittlere LS-Differenz: 0,127 [95-%-KI: 0,042, 0,212]; p = 0,003) gegenüber Placebo. In der NOTUS-Studie wurde eine statistisch signifikante Verbesserung gegenüber Baseline in der Subgruppe der Patienten unter Dupilumab mit erhöhtem FeNO (≥20 ppb) bei Baseline in Woche 12 beobachtet (n = 355; mittlere LS-Veränderung: 0,221 Dupilumab vs. 0,081 Placebo; mittlere LS-Differenz: 0,141 [95-%-KI: 0,058–0,223]; p = 0,001).
Die Behandlung mit Dupilumab verbesserte in der NOTUS-Studie den FEV1-Wert vor Bronchodilatation in Woche 52 in der Subgruppe der Patienten mit erhöhtem FeNO (≥20 ppb) bei Baseline gegenüber Placebo (n = 264; mittlere LS-Veränderung: 0,176 Dupilumab vs. 0,095 Placebo; mittlere LS-Differenz: 0,081 [95-%-KI: -0,019; 0,181]), erreichte jedoch keine statistische Signifikanz.
Verbesserungen der Lungenfunktion, gemessen anhand des FEV1 vor Bronchodilatation, wurden in allen vordefinierten Subgruppen beobachtet, einschliesslich Alter, Geschlecht, ethnischer Herkunft, Raucherstatus, Eosinophilenzahl im Blut, Anzahl der Exazerbationen im Vorjahr (≤2, 3 und ≥4), hochdosiertem ICS bei Baseline und prozentualem Anteil des vorhergesagten FEV1 nach Bronchodilatation bei Baseline (< 50 %, ≥50 %). Bei Patienten mit Emphysem stimmte die Verbesserung der Lungenfunktion, gemessen anhand des FEV1 vor Bronchodilatation, mit der Gesamtpopulation überein.
Patientenberichtete Ergebnisse
In beiden Studien wurde die gesundheitsbezogene Lebensqualität anhand der mittleren LS-Veränderung des St. George's Respiratory Questionnaire (SGRQ)-Gesamtscores in Woche 52 gemessen. In der BOREAS-Studie wurde eine statistisch signifikante Verbesserung des SGRQ-Gesamtscores bei mit Dupilumab behandelten Patienten im Vergleich zu Placebo beobachtet (mittlere LS-Veränderung: -9,73 Dupilumab vs. -6,37 Placebo; mittlere LS-Differenz: -3,36 [95-%-KI: -5,46, -1,27]; p = 0,002). In der NOTUS-Studie verbesserte Dupilumab den SGRQ-Gesamtscore in Woche 52 im Vergleich zu Placebo nominal (mittlere LS-Veränderung: -9,82 bei Dupilumab vs. -6,44 Placebo; mittlere LS-Differenz: -3,37; [95-%-KI: -5,81, -0,93]; p = 0,007).
Pädiatrische Population:
Atopische Dermatitis:
Die Sicherheit und Wirksamkeit von Dupilumab bei pädiatrischen Patienten ab 6 Monaten mit mittelschwerer bis schwerer atopischer Dermatitis wurden nachgewiesen.
Unterstützende Daten zur Anwendung von Dupilumab bei dieser Altersgruppe liefern die Studie AD-1526, in die 251 Jugendliche von 12 bis 17 Jahren mit mittelschwerer bis schwerer atopischer Dermatitis eingeschlossen wurden, die Studie AD-1652, an der 367 Kinder von 6 bis 11 Jahren mit schwerer atopischer Dermatitis teilnahmen, und die Studie AD-1539, in die 162 Kinder im Alter von 6 Monaten bis 5 Jahren mit mittelschwerer bis schwerer atopischer Dermatitis eingeschlossen waren. Unterstützende Daten zur Langzeitanwendung von Dupilumab liefert die Studie AD-1434, in die 823 pädiatrische Patienten zwischen 6 Monaten und 17 Jahren eingeschlossen waren, darunter 275 Jugendliche, 368 Kinder im Alter von 6 bis 11 Jahren und 180 Kinder im Alter von 6 Monaten bis 5 Jahren. Unterstützende Daten zur Anwendung von Dupilumab liefert die Studie AD-1924, in die 27 Jugendliche im Alter von 12 bis 17 Jahren mit mittelschwerer bis schwerer atopischer Dermatitis der Hände und Füsse eingeschlossen wurden. Die Sicherheit und Wirksamkeit bei pädiatrischen und erwachsenen Patienten waren insgesamt konsistent.
In der Studie AD-1434 wurden keine neuen Sicherheitserkenntnisse gefunden (siehe «Unerwünschte Wirkungen»).
Die Sicherheit und Wirksamkeit bei pädiatrischen Patienten unter 6 Monaten mit atopischer Dermatitis ist nicht erwiesen.
Asthma:
Patienten von 12 bis 17 Jahren
Insgesamt 107 Jugendliche im Alter von 12 bis 17 Jahren mit mittelschwerem bis schwerem Asthma wurden in die QUEST-Studie eingeschlossen und erhielten alle zwei Wochen entweder 200 mg (n = 21) oder 300 mg (n = 18) Dupilumab (oder entweder 200 mg [n = 34] oder 300 mg [n = 34] entsprechendes Placebo). Eine Wirksamkeit hinsichtlich schwerer Asthmaexazerbationen und der Lungenfunktion wurde sowohl bei Jugendlichen als auch bei Erwachsenen beobachtet. Für beide Dosierungen (200 mg und 300 mg alle 2 Wochen) wurden signifikante Verbesserungen des FEV1 (mittlere LS-Veränderung gegenüber der Baseline in Woche 12) beobachtet (0,36 l bzw. 0,27 l). Für die Dosis von 200 mg alle 2 Wochen wurde ebenso wie bei Erwachsenen eine Reduktion der Rate von schweren Exazerbationen beobachtet. Im Allgemeinen war das Nebenwirkungsprofil bei Jugendlichen mit dem von Erwachsenen vergleichbar.
Kinder (6 bis 11 Jahre)
Insgesamt 408 Kinder von 6 bis 11 Jahren mit mittelschwerem bis schwerem Asthma wurden in die VOYAGE-Studie eingeschlossen, in der Dosierungen von 100 mg und 200 mg alle zwei Wochen untersucht wurden. Die Wirksamkeit von Dupilumab 300 mg alle vier Wochen bei Kindern von 6 bis 11 Jahren wurde anhand der VOYAGE-Daten zur Wirksamkeit von 100 mg und 200 mg alle zwei Wochen und der QUEST-Daten zu 200 mg und 300 mg alle zwei Wochen bei Erwachsenen und Jugendlichen extrapoliert. Patienten, welche die Behandlungsphase der VOYAGE-Studie vollendet hatten, konnten an der unverblindeten Verlängerungsstudie (EXCURSION) teilnehmen. In dieser Studie erhielten vierzehn Patienten (≥15 kg bis < 30 kg) von 365 Patienten alle vier Wochen 300 mg, das Sicherheitsprofil war mit dem der VOYAGE-Studie vergleichbar.
Eosinophile Ösophagitis (EoE)
Insgesamt 71 pädiatrische Patienten im Alter von 1 bis 11 Jahren erhielten Dupilumab 100 mg alle zwei Wochen, 200 mg alle zwei Wochen, 300 mg alle zwei Wochen bzw. ein Placebo über 16 Wochen (EoE KIDS Teil A). Davon erhielten 37 Patienten, die mit Dupilumab inTeil A behandelt wurden, eine zusätzliche 36-wöchige Behandlung nach den Dosierungsschemata für Dupilumab (EoE KIDS Teil B). Die Verwendung von Dupilumab bei pädiatrischen Patienten im Alter von 1 bis 11 Jahren mit EoE, die 300 mg wöchentlich (≥40 kg) erhielten, sowie bei pädiatrischen Patienten im Alter von 12 bis 17 Jahren mit einem Körpergewicht von < 40 kg, die die gleiche Dosis nach Gewicht wie die pädiatrischen Patienten im Alter von 1 bis 11 Jahren erhielten, stützt sich ebenfalls auf eine Analyse populationspharmakokinetischer Daten (siehe «Pharmakokinetik»). Die Sicherheit der Anwendung und Wirksamkeit von Dupilumab bei Erwachsenen und pädiatrischen Patienten war vergleichbar.
PharmakokinetikDie Pharmakokinetik von Dupilumab ist bei Patienten mit atopischer Dermatitis, Asthma, CRSwNP, PN, eosinophiler Ösophagitis und COPD vergleichbar.
Absorption
Nach einer subkutan (s. c.) verabreichten Anfangsdosis von 600 mg oder 300 mg Dupilumab betrug die Dauer bis zur maximalen Plasmakonzentration ± Standardabweichung (Cmax) von 70,1 ± 24,1 μg/ml beziehungsweise 30,5 ± 9,39 μg/ml etwa eine Woche.
Basierend auf einer populationsbezogenen pharmakokinetischen Analyse lag die geschätzte absolute Bioverfügbarkeit von Dupilumab nach einer s. c. Dosis bei 64 %.
Nach der Anwendung einer Anfangsdosis von 600 mg, gefolgt von einer Dosis von 300 mg alle zwei Wochen oder 300 mg entweder einmal wöchentlich oder alle zwei Wochen ohne Initialdosis wurden die Steady-State-Konzentrationen bis Woche 16 erreicht.
In den klinischen Studien lagen die mittleren minimalen Serumkonzentrationen im Steady State (± SD) bei einer Dosis von 300 mg alle zwei Wochen zwischen 55,3 ± 34,3 µg/ml und 81,5 ± 43,9 μg/ml, bei einer Dosis von 300 mg einmal wöchentlich zwischen 172 ± 76,6 µg/ml und 195 ± 71,7 µg/ml und bei einer Dosis von 200 mg alle zwei Wochen zwischen 29,2 ± 18,7 und 36,5 ± 22,2 µg/ml.
Distribution
Basierend auf der populationsbezogenen pharmakokinetischen Analyse wurde das Verteilungsvolumen von Dupilumab auf etwa 4,6 l geschätzt.
Metabolismus
Spezifische Stoffwechselstudien wurden nicht durchgeführt, da Dupilumab ein Protein ist. Es wird erwartet, dass Dupilumab zu kleinen Peptiden und einzelnen Aminosäuren abgebaut wird.
Elimination
Dupilumab wird sowohl auf linearen als auch auf nichtlinearen Wegen parallel eliminiert. Bei höheren Konzentrationen wird Dupilumab vorwiegend über eine nicht sättigbare Proteolyse eliminiert, während bei geringeren Konzentrationen die nichtlineare sättigbare zielvermittelte IL-4R-α-Elimination überwiegt.
Gemäss einer populationsbezogenen pharmakokinetischen Analyse lagen nach der letzten Steady-State-Dosis von 300 mg QW, 300 mg Q2W, 200 mg Q2W, 300 mg Q4W oder 200 mg Q4W Dupilumab die medianen Zeiträume bis zum Absinken unter die untere Nachweisgrenze bei Erwachsenen und Jugendlichen zwischen 9 und 13 Wochen, bei pädiatrischen Patienten im Alter von 6 bis 11 Jahren waren sie etwa 1,5-mal länger (bis zu 19 Wochen) und bei pädiatrischen Patienten im Alter von 6 Monaten bis unter 6 Jahren 2,5-mal länger (bis zu 32 Wochen).
Linearität/Nicht-Linearität
Aufgrund der nichtlinearen Clearance erhöht sich die Dupilumab-Exposition, gemessen an der Fläche unter der Kurve, nach s. c. Einzeldosen von 75–600 mg mit steigender Dosis überproportional.
Kinetik spezieller Patientengruppen
Geschlecht, ethnische Herkunft und Gewicht:
Im Rahmen einer populationsbezogenen pharmakokinetischen Analyse wurden keine klinisch bedeutsamen Auswirkungen des Geschlechts und der ethnischen Herkunft auf die systemische Exposition von Dupilumab festgestellt.
Die Talspiegel von Dupilumab waren bei Patienten mit einem höheren Körpergewicht niedriger. Dabei wurden keine signifikanten Auswirkungen auf die Wirksamkeit von Dupilumab festgestellt.
Leberfunktionsstörungen
Da Dupilumab ein monoklonaler Antikörper ist, dürfte die Elimination über die Leber nicht signifikant sein. Es wurden keine klinischen Studien zu den Auswirkungen einer Leberfunktionsstörung auf die Pharmakokinetik von Dupilumab durchgeführt.
Nierenfunktionsstörungen
Da Dupilumab ein monoklonaler Antikörper ist, dürfte die Elimination über die Nieren nicht signifikant sein. Es wurden keine klinischen Studien zu den Auswirkungen einer Nierenfunktionsstörung auf die Pharmakokinetik von Dupilumab durchgeführt. Im Rahmen der populationsbezogenen pharmakokinetischen Analyse wurden keine klinisch bedeutsamen Auswirkungen einer leichten bis mittelschweren Nierenfunktionsstörung auf die systemische Exposition von Dupilumab festgestellt. Es liegen nur sehr begrenzte Daten für Patienten mit einer schweren Nierenfunktionsstörung vor.
Ältere Patienten
In populationspharmakokinetischen Analysen wurden bei Erwachsenen keine klinisch bedeutsamen Auswirkungen des Alters auf die systemische Exposition von Dupilumab festgestellt.
Kinder und Jugendliche
Atopische Dermatitis:
Gemäss der populationspharmakokinetischen Analyse stieg die Clearance mit zunehmendem Körpergewicht bei Erwachsenen und pädiatrischen Patienten im Alter von 6 Monaten bis 17 Jahren an. Bei Erwachsenen und pädiatrischen Patienten im Alter von 6 bis 17 Jahren hatte das Alter keinen Einfluss auf die Clearance von Dupilumab. Bei pädiatrischen Patienten im Alter von 6 Monaten bis 5 Jahren stieg die Clearance mit dem Alter an. Die empfohlenen Dosierungsschemata berücksichtigen das Alter und das Körpergewicht.
Die Pharmakokinetik von Dupilumab bei Kindern und Jugendlichen (< 6 Monate) und von Patienten mit einem Körpergewicht von < 7,4 kg mit atopischer Dermatitis wurde nicht untersucht.
Bei Jugendlichen von 12 bis 17 Jahren mit atopischer Dermatitis, die alle zwei Wochen (Q2W) 200 mg (< 60 kg) oder 300 mg (≥60 kg) erhielten, betrug die mittlere Steady-State-Minimalkonzentration (±SD) von Dupilumab 54,5 ± 27,0 μg/ml.
Bei Kindern von 6 bis 11 Jahren mit atopischer Dermatitis, die eine Dosis von 200 mg alle zwei Wochen (Q2W) (≥30 kg) oder eine Dosis von 300 mg alle vier Wochen (Q4W) (< 30 kg) erhielten, betrugen die mittleren Steady-State-Minimalkonzentrationen ± SD von Dupilumab 86,0 ± 34,6 µg/ml bzw. 98,7 ± 33,2 µg/ml.
Bei Kindern von 6 Monaten bis 5 Jahren mit atopischer Dermatitis, die eine Dosis von 300 mg alle vier Wochen (Q4W) (≥15 bis < 30 kg) oder 200 mg (≥7,4 bis < 15 kg) erhielten, betrugen die mittleren Steady-State-Minimalkonzentrationen 110 ± 42,8 µg/ml bzw. 109 ± 50,8 µg/ml.
Asthma:
Jugendliche (12 bis 17 Jahre)
Insgesamt 107 Jugendliche im Alter von 12 bis 17 Jahren mit mittelschwerem bis schwerem Asthma wurden in die QUEST-Studie eingeschlossen. Die mittleren Steady-State-Minimalkonzentrationen (± SD) von Dupilumab betrugen 107 ± 51,6 μg/ml bzw. 46,7 ± 26,9 μg/ml für die Behandlungsschemata mit 300 mg bzw. 200 mg alle zwei Wochen. Nach einer Anpassung an das Körpergewicht wurde bei jugendlichen Patienten kein altersbedingter Unterschied bezüglich der Pharmakokinetik festgestellt.
Kinder (6 bis 11 Jahre)
In der VOYAGE-Studie wurde die Pharmakokinetik von Dupilumab bei 270 Patienten mit mittelschwerem bis schwerem Asthma nach subkutaner Anwendung von entweder 100 mg alle zwei Wochen (bei 91 Kindern mit einem Gewicht von < 30 kg) oder 200 mg alle zwei Wochen (bei 179 Kindern mit einem Gewicht von ≥30 kg) untersucht. Die mittlere Steady-State-Konzentration (± SD) betrug 58,4 ± 28,0 µg/ml bzw. 85,1 ± 44,9 µg/ml. Die Simulation einer subkutan verabreichten Dosis von 300 mg alle vier Wochen bei Kindern von 6 bis 11 Jahren mit einem Körpergewicht von ≥15 kg bis < 30 kg und von ≥30 kg bis < 60 kg führte zu vorhergesagten Steady-State-Minimalkonzentrationen, die vergleichbar waren mit den beobachteten Minimalkonzentrationen bei 200 mg alle zwei Wochen (≥30 kg) bzw. 100 mg jede Woche (< 30 kg). Darüber hinaus ermöglichte die Simulation einer subkutan verabreichten Dosis von 300 mg alle vier Wochen bei Kindern von 6 bis 11 Jahren mit einem Körpergewicht von ≥15 kg bis < 60 kg eine Vorhersage der minimalen Steady-State-Konzentrationen, die vergleichbar waren mit denen, die sich bei Erwachsenen und Jugendlichen als wirksam erwiesen hatten.
Sicherheit, Wirksamkeit und Pharmakokinetik wurden bei pädiatrischen Asthma-Patienten unter 6 Jahren nicht untersucht.
CRSwNP:
CRSwNP tritt normalerweise nicht bei Kindern auf. Die Pharmakokinetik von Dupilumab wurde bei pädiatrischen Patienten (< 18 Jahren) mit CRSwNP nicht untersucht.
Prurigo nodularis
Die Pharmakokinetik von Dupilumab bei pädiatrischen Patienten (<18 Jahre) mit Prurigo nodularis wurde nicht untersucht.
Eosinophile Ösophagitis
Insgesamt 35 Jugendliche im Alter von 12 bis 17 Jahren mit eosinophiler Ösophagitis und einem Körpergewicht von ≥40 kg wurden in die TREET-Studien Teil A und Teil B aufgenommen und erhielten eine wöchentliche Dosis (QW) von 300 mg. Die mittleren Steady-State-Restkonzentrationen ± SE von Dupilumab betrug 227 ± 95,3 µg/ml.
In einer klinischen Studie (EoE KIDS Teil A) wurde die Pharmakokinetik von Dupilumab an 36 pädiatrischen Patienten im Alter von 1 bis 11 Jahren mit EoE untersucht. Der mittlere ± ET der Restkonzentrationen von Dupilumab bei gut eingestellten Patienten, die Dupilumab 200 mg alle zwei Wochen (≥15 bis < 30 kg) bzw. 300 mg alle zwei Wochen (≥30 bis < 60 kg) erhielten, betrug 164 ± 73,9 µg/ml bzw. 157 ± 44,9 µg/ml.
Folgende Simulationen wurden bei pädiatrischen Patienten im Alter von 1 bis 11 Jahren mit einem populationspharmakokinetischen Modell durchgeführt, um die Restkonzentrationen von Dupilumab im gut eingestellten Zustand vorauszuberechnen: ≥15 bis < 30 kg (200 mg alle zwei Wochen) (170 ± 76 µg/ml); ≥30 bis < 40 kg (300 mg alle zwei Wochen) (157 ± 61 µg/ml); oder ≥40 kg (300 mg wöchentlich) (275 ± 99 µg/ml). Die Restkonzentrationen im gut eingestellten Zustand wurden ebenfalls bei Erwachsenen und pädiatrischen Patienten im Alter von 12 bis 17 Jahren mit einem Gewicht von ≥30 bis < 40 kg, die 300 mg alle zwei Wochen (159 ± 61 μg/ml) erhielten, simuliert.
Chronisch obstruktive Lungenerkrankung
COPD tritt bei Kindern normalerweise nicht auf. Die Pharmakokinetik von Dupilumab bei Kindern (< 18 Jahre) mit COPD wurde nicht untersucht.
Präklinische DatenBasierend auf den konventionellen Studien zur Toxizität bei wiederholter Gabe (einschliesslich der Sicherheitspharmakologie) lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
Das mutagene Potenzial von Dupilumab wurde nicht untersucht, es wird jedoch nicht erwartet, dass monoklonale Antikörper die DNA oder Chromosomen verändern.
Es wurden keine Karzinogenitätsstudien mit Dupilumab durchgeführt. Sowohl die Bewertung der vorliegenden Informationen zur Inhibition der IL-4Rα-Rezeptoren als auch die tierexperimentellen Toxikologiedaten mit Surrogat-Antikörpern lieferten keine Hinweise auf ein erhöhtes Krebspotenzial von Dupilumab.
Während einer Reproduktionsstudie, die an Affen durchgeführt wurde, wurde ein affenspezifischer Surrogat-Antikörper des IL-4Rα-Rezeptors verwendet. Bei Dosierungen, die den IL-4Rα-Rezeptor saturierten, wurden hierbei keine fetalen Fehlbildungen beobachtet.
Eine erweiterte prä- und postnatale Entwicklungsstudie zeigte, dass das Arzneimittel bis sechs Monate nach der Geburt keine unerwünschten Wirkungen bei graviden Weibchen oder deren Jungen aufwies.
Fertilitätsstudien an männlichen und weiblichen Mäusen, in denen ein Surrogat-Antikörper gegen den IL-4Rα-Rezeptor verwendet wurde, zeigten keine Veränderung der Fertilität.
Sonstige HinweiseDie folgenden Hinweise gelten für alle erhältlichen Darreichungsformen.
Inkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Ausser Sicht- und Reichweite von Kindern aufbewahren.
Fertigspritze oder Pen in der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Im Kühlschrank (2–8 °C) lagern. Arzneimittel nicht einfrieren oder erhitzen.
Nach Entnahme aus dem Kühlschrank kann Dupixent bei Bedarf bis zu 14 Tage lang bei Raumtemperatur (nicht über 25 °C) gelagert werden. Nach diesem Zeitraum muss die Spritze oder der Pen unbedingt entsorgt werden.
Hinweise für die Handhabung
Dupixent wird als Fertigspritze mit Sicherheitssystem oder als Fertigpen angeboten. Die Hinweise zur Anwendung befinden sich am Ende der Patienteninformation.
Klare bis leicht schimmernde, farblose bis blassgelbe Injektionslösung ohne sichtbare Partikel.
Fertigspritze oder Pen aus dem Kühlschrank entnehmen und Raumtemperatur annehmen lassen (ca. 30 Min. bei den 200-mg-Fertigspritzen und 200-mg-Fertigpens und 45 Min. bei den 300-mg-Fertigspritzen und 300-mg-Fertigpens), bevor die Dupixent-Injektion vorgenommen wird.
Fertigspritze oder Pen vor Wärme und direktem Sonnenlicht schützen und nicht schütteln.
Vor Gebrauch eine Sichtprüfung der Fertigspritze oder des Pens vornehmen. Wenn die Lösung trübe oder verfärbt ist oder Partikel erkennbar sind oder ein Teil der Vorrichtung beschädigt zu sein scheint, darf das Arzneimittel nicht verwendet werden.
Nicht aufgebrauchte Arzneimittel oder Abfälle müssen gemäss den vor Ort geltenden Bestimmungen entsorgt werden. Nach Gebrauch die Fertigspritze oder den Pen in einen durchstichsicheren Behälter geben und gemäss den vor Ort geltenden Bestimmungen entsorgen. Behälter nicht wiederverwenden.
Zulassungsnummer66649, 67661 (Swissmedic).
PackungenDer Fertigpen kann entweder eine runde Schutzkappe und ein ovales, von einem Pfeil umrandetes Sichtfenster oder eine geriffelte, quadratische Schutzkappe und ein ovales Fenster ohne Pfeil haben. Obwohl die zwei Fertigpens sich in ihrem Aussehen geringfügig unterscheiden, funktionieren beide gleich (siehe die der Packungsbeilage beigefügte Gebrauchsanweisung für Patienten).
Dupixent 300 mg/2 ml, Injektionslösung in einer Fertigspritze mit Sicherheitssystem: Packung mit 2 Fertigspritzen (B).
Dupixent 300 mg/2 ml, Injektionslösung in einem Fertigpen: Packung mit 2 Pens (B).
Dupixent 200 mg/1,14 ml, Injektionslösung in einer Fertigspritze mit Sicherheitssystem: Packung mit 2 Fertigspritzen (B).
Dupixent 200 mg/1,14 ml, Injektionslösung in einem Fertigpen: Packung mit 2 Pens (B).
Zulassungsinhaberinsanofi-aventis (schweiz) ag, 1214 Vernier/GE
Stand der InformationJanuar 2025
|




















