ZusammensetzungWirkstoffe
Exagamglogen autotemcel.
Casgevy (Exagamglogen autotemcel) ist eine genetisch modifizierte, autologe, mit CD34+-Zellen angereicherte Population von hämatopoetischen Stamm- und Vorläuferzellen (HSPC), die ex vivo unter Verwendung von CRISPR/Cas9 in der Erythroid-spezifischen Enhancer-Region des BCL11A-Gens editiert wurden.
Hilfsstoffe
CryoStor CS5 (enthält Dimethylsulfoxid und Dextran 40).
Dieses Arzneimittel enthält 50 mg Dimethylsulfoxid (DMSO) pro ml.
Dieses Arzneimittel enthält 3,5 mg Natrium pro ml.
Darreichungsform und Wirkstoffmenge pro EinheitInfusionsdispersion.
Eine durchscheinende Zelldispersion zur Infusion, die frei von Fremdpartikeln ist.
Jede patientenspezifische Durchstechflasche Casgevy enthält Exagamglogen autotemcel mit einer chargenabhängigen Konzentration einer mit genetisch veränderten autologen CD34+-Zellen angereicherten Population. Das Arzneimittel ist in eine oder mehrere Durchstechflaschen verpackt, die insgesamt eine Infusionsdispersion mit 4 - 13 × 106 Zellen/ml enthalten, die in einer Kryokonservierungslösung suspendiert ist.
Jede Durchstechflasche enthält 1,5 bis 20 ml Infusionsdispersion.
Die quantitativen Angaben zum Arzneimittel, einschliesslich der Anzahl der zu verwendenden Durchstechflaschen (siehe "Packungen" ), sind dem Chargeninformationsblatt (Lot Information Sheet, LIS) im Deckel des für den Transport verwendeten Kryotransportbehälters zu entnehmen.
Indikationen/AnwendungsmöglichkeitenBeta-Thalassämie
Casgevy wird angewendet zur Behandlung von transfusionsabhängiger Beta-Thalassämie (TDT) bei Patienten ab 12 Jahren, die für eine Transplantation von hämatopoetischen Stammzellen (HSZ) geeignet sind und für die kein humaner Leukozyten-Antigen (HLA)-kompatibler, verwandter HSZ-Spender zur Verfügung steht.
Sichelzellkrankheit
Casgevy wird angewendet zur Behandlung von schwerer Sichelzellkrankheit (SCD) bei Patienten ab 12 Jahren mit rezidivierenden vasookklusiven Krisen (VOC), die für eine Transplantation von hämatopoetischen Stammzellen (HSZ) geeignet sind und für die kein humaner Leukozyten-Antigen (HLA)-kompatibler, verwandter HSZ-Spender zur Verfügung steht.
Aufgrund einer zum Zeitpunkt der Begutachtung des Gesuches unvollständigen klinischen Datenlage, werden diese Indikationen befristet zugelassen (Art. 9a Heilmittelgesetz). Die befristete Zulassung ist zwingend an die zeitgerechte Erfüllung von Auflagen gebunden. Nach deren Erfüllung kann die befristete Zulassung in eine ordentliche Zulassung überführt werden.
Dosierung/AnwendungCasgevy muss in einem qualifizierten Behandlungszentrum von einem Arzt angewendet werden, der über Erfahrung in der Transplantation von HSZ und in der Behandlung von Patienten mit Beta-Hämoglobinopathien verfügt und in der Anwendung des Arzneimittels und im Management von mit dem Arzneimittel behandelten Patienten geschult ist.
Bevor die Mobilisierung, Apherese und die myeloablative Konditionierung initiiert werden, ist zu bestätigen, dass der Patient für eine hämatopoetische Stammzelltransplantation in Frage kommt.
Übliche Dosierung
Casgevy ist für die autologe Anwendung bestimmt (siehe "Warnhinweise und Vorsichtsmassnahmen" ).
Die Behandlung besteht aus einer einmaligen Dosis, die eine Infusionsdispersion von lebensfähigen CD34+-Zellen enthält, die in einer oder mehreren Durchstechflaschen verpackt sind.
Die empfohlene Mindestdosis von Casgevy beträgt 3 × 106 CD34+-Zellen/kg Körpergewicht.
Weitere Informationen zur Dosis sind dem beigefügten Chargeninformationsblatt (LIS) zu entnehmen.
Mobilisierung und Apherese
Die Patienten müssen sich einer Mobilisierung von CD34+-HSPC mit anschliessender Apherese unterziehen, damit die CD34+-Zellen für die Herstellung des Arzneimittels isoliert werden können.
Die CD34+-Zellentnahme für die Herstellung des Arzneimittels soll bei jedem Mobilisierungs- und Apheresezyklus maximiert werden. Die Zellentnahmen für die Herstellung des Arzneimittels sollen pro Zyklus an zwei aufeinanderfolgenden Tagen durchgeführt werden, wenn dies klinisch verträglich ist. Für die Herstellung des Arzneimittels wird eine Gesamtentnahme von mindestens 20 × 106 CD34+-Zellen/kg empfohlen. Die entnommenen Zellen sollen auch dann zur Herstellung des Arzneimittels eingeschickt werden, wenn nicht die gesamte angestrebte Zellmenge entnommen werden konnte. Darüber hinaus ist die Entnahme von mindestens 2 × 106 CD34+-Zellen/kg erforderlich, die als unveränderte Reservezellen benötigt werden. Ein dritter Tag kann bei Bedarf für die Entnahme der Reservezellen genutzt werden.
Wird die Mindestdosis von Casgevy bei der ersten Herstellung des Arzneimittels nicht erreicht, muss sich der Patient weiteren Mobilisierungs- und Apheresezyklen unterziehen, um mehr Zellen für die zusätzliche Herstellung des Arzneimittels zu gewinnen. Zwischen jedem Mobilisierungs- und Apheresezyklus müssen mindestens 14 Tage liegen.
Dem Patienten müssen ≥2 × 106 CD34+-Zellen/kg als unveränderte Zellen zur Reserve entnommen werden und vor der myeloablativen Konditionierung und Infusion von Casgevy kryokonserviert werden.
Die unveränderten Zellen werden als Rescue-Therapie benötigt, wenn eine der folgenden Situationen eintritt: Qualitätsbeeinträchtigung von Casgevy nach Beginn der myeloablativen Konditionierung und vor der Infusion von Casgevy; Versagen des Neutrophilen-Engraftments oder Verlust des Engraftments nach der Infusion von Casgevy. Aktuell liegen keine Berichte zu einem Versagen des Engraftments in klinischen Studien mit Casgevy vor. Casgevy ist eine Therapie zur einmaligen Anwendung. Es liegen keine Daten über eine wiederholte Verabreichung von Casgevy vor, auch nicht dazu, ob es zu einem Verlust des Engraftments kommt.
Siehe "Eigenschaften/Wirkungen" für eine Beschreibung des in der klinischen Studie angewendeten Mobilisierungsschemas. Die Fachinformation(en) des/der Arzneimittel(s) für die Mobilisierung ist/sind vor der Behandlung mit Casgevy zu beachten.
Krankheitsmodifizierende Therapien (z.B. Hydroxyurea/Hydroxycarbamid, Crizanlizumab, Voxelotor) müssen 8 Wochen vor dem geplanten Beginn der Mobilisierung und Konditionierung abgesetzt werden.
Beta-Thalassämie
Es wird empfohlen, dass die Patienten vor dem Apherese-Verfahren eine oder mehrere Erythrozytentransfusionen erhalten, mit dem Ziel, einen Gesamthämoglobin (Hb)-Wert von ≥11 g/dl aufrecht zu erhalten.
Sichelzellkrankheit
Es wird empfohlen, dass die Patienten vor der Apherese einen Erythrozytenaustausch bzw. eine oder mehrere einfache Transfusionen erhalten, mit dem Ziel, einen Hämoglobin S (HbS)-Wert von < 30 % des Gesamt-Hb-Werts und gleichzeitig einen Gesamt-Hb-Wert von ≤11 g/dl aufrecht zu erhalten.
Granulozyten-Kolonie-stimulierender Faktor (G-CSF) darf bei Patienten mit Sichelzellkrankheit nicht für die Mobilisierung verwendet werden.
Vorbehandlung (Konditionierung)
Vor der Infusion von Casgevy muss eine vollständige myeloablative Konditionierung durchgeführt werden. Die Konditionierung darf erst begonnen werden, wenn die Gesamtzahl an Durchstechflaschen, aus denen die komplette Dosis Casgevy besteht, beim autorisierten Behandlungszentrum eingegangen und die Verfügbarkeit von unveränderten CD34+-Reservezellen bestätigt ist. Siehe "Eigenschaften/Wirkungen" für eine Beschreibung des in der klinischen Studie verwendeten Konditionierungsschemas. Die Fachinformation(en) des/der Arzneimittel(s) für die myeloablative Konditionierung ist/sind vor der Behandlung zu beachten.
Beta-Thalassämie
Es wird empfohlen, dass bei den Patienten vor der myeloablativen Konditionierung 60 Tage lang ein Gesamt-Hb-Wert von ≥11 g/dl aufrechterhalten wird.
Sichelzellkrankheit
Es wird empfohlen, dass die Patienten mindestens in den 8 Wochen vor Beginn der myeloablativen Konditionierung einen Erythrozytenaustausch bzw. eine oder mehrere einfache Transfusionen erhalten, um einen HbS-Wert von < 30 % des Gesamt-Hb-Werts und gleichzeitig einen Gesamt-Hb-Wert von ≤11 g/dl aufrecht zu erhalten. Bei Beginn des Erythrozytenaustausches oder der einfachen Transfusionen sind die krankheitsmodifizierenden Therapien (z.B. Hydroxyurea/Hydroxycarbamid, Crizanlizumab, Voxelotor) abzusetzen.
Die Eisenchelat-Therapie muss spätestens 7 Tage vor der myeloablativen Konditionierung abgesetzt werden.
Eine prophylaktische antikonvulsive Behandlung ist ebenfalls in Erwägung zu ziehen. Informationen zu Wechselwirkungen mit anderen Arzneimitteln sind der Fachinformation des verwendeten Arzneimittels für die myeloablative Konditionierung zu entnehmen.
Eine Prophylaxe der hepatischen venookklusiven Erkrankung (VOD)/des hepatischen sinusoidalen Obstruktionssyndroms sollte gemäss den Leitlinien der Behandlungseinrichtung erwogen werden.
Vor dem Beginn des myeloablativen Konditionierungsschemas muss die Verfügbarkeit des vollständigen Sets von Durchstechflaschen, aus denen die Dosis von Casgevy besteht, und der unveränderten Reservezellen bestätigt werden. Zur Bestätigung der Anzahl der Durchstechflaschen und der Gesamtdosis von Casgevy ist das der Arzneimittellieferung beigefügte Chargeninformationsblatt (LIS) zu prüfen.
Prämedikation
Es wird empfohlen, vor der Infusion von Casgevy eine Prämedikation mit Paracetamol und Diphenhydramin oder gleichwertigen Arzneimitteln entsprechend den Leitlinien der Behandlungseinrichtung anzuwenden, um die Möglichkeit einer Infusionsreaktion zu verringern.
Rückverfolgbarkeit
Es müssen die Anforderungen an die Rückverfolgbarkeit zellbasierter Arzneimittel für neuartige Therapien eingehalten werden. Um die Rückverfolgbarkeit sicherzustellen, sind die Bezeichnung des angewendeten Arzneimittels, die Chargenbezeichnung und der Name des behandelten Patienten für einen Zeitraum von 30 Jahren nach dem Verfalldatum des Arzneimittels aufzubewahren.
Spezielle Patientengruppen
Patienten mit Leberfunktionsstörungen
Casgevy wurde nicht bei Patienten mit eingeschränkter Leberfunktion untersucht. Eine Dosisanpassung ist nicht erforderlich.
Patienten mit Nierenfunktionsstörungen
Casgevy wurde nicht bei Patienten mit eingeschränkter Nierenfunktion, definiert als geschätzte glomeruläre Filtrationsrate < 60 ml/min/1,73 m2, untersucht. Eine Dosisanpassung ist nicht erforderlich.
Patienten ab 35 Jahren
Casgevy wurde nicht bei Patienten > 35 Jahren untersucht. Die Sicherheit und Wirksamkeit von Casgevy in dieser Patientengruppe sind nicht erwiesen. Der Nutzen der Behandlung ist bei den einzelnen Patienten gegen die Risiken einer HSZ-Transplantation abzuwägen.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Casgevy bei Patienten < 12 Jahren ist nicht erwiesen. Es liegen keine Daten vor.
Patienten, die seropositiv für das humane Immunschwächevirus (HIV), das Hepatitis-B-Virus (HBV) oder das Hepatitis-C-Virus (HCV) sind
Casgevy wurde nicht bei Patienten mit einer HIV-1-, HIV-2-, HBV- oder HCV-Infektion untersucht. Vor der Entnahme von Zellen für die Herstellung des Arzneimittels ist ein Screeningtest auf HIV-1, HIV-2, HBV und HCV sowie auf andere Infektionserreger gemäss den örtlichen Richtlinien durchzuführen. Casgevy darf nicht bei Patienten mit aktiver HIV-1-, HIV-2-, HBV- oder HCV-Infektion angewendet werden.
Patienten mit vorausgegangener HSZ-Transplantation
Casgevy wurde nicht bei Patienten untersucht, die zuvor ein allogenes oder autologes HSZ-Transplantat erhalten haben. Die Behandlung mit Casgevy wird bei diesen Patienten nicht empfohlen.
Art der Anwendung
Casgevy ist nur zur intravenösen Anwendung.
Nach Abschluss des myeloablativen Konditionierungsschemas müssen mindestens 48 Stunden vergehen, bevor Casgevy infundiert wird. Casgevy muss innerhalb eines Zeitraums von mindestens 48 Stunden bis maximal 7 Tagen nach der letzten Dosis der myeloablativen Konditionierung gegeben werden.
Vor dem Auftauen und der Anwendung ist zu bestätigen, dass die Identität des Patienten mit den eindeutigen Patienteninformationen auf der/den Durchstechflasche(n) mit Casgevy und den Begleitdokumenten übereinstimmt. Ferner ist die Gesamtzahl der zu verwendenden Durchstechflaschen anhand der patientenspezifischen Informationen auf dem Chargeninformationsblatt (LIS) zu bestätigen (siehe "Warnhinweise und Vorsichtsmassnahmen" ).
Casgevy wird als intravenöser Bolus über einen zentralen Venenkatheter gegeben. Die Infusion von Casgevy muss schnellstmöglich und nicht später als 20 Minuten nach dem Auftauen abgeschlossen sein. Falls mehr als eine Durchstechflasche bereitgestellt wird, müssen alle Durchstechflaschen verabreicht werden. Von jeder Durchstechflasche muss das gesamte Volumen infundiert werden.
Ausführliche Anweisungen zu Zubereitung, Anwendung, Massnahmen im Falle einer versehentlichen Exposition und Beseitigung von Casgevy, siehe Abschnitt "Hinweise für die Handhabung" .
Nach der Anwendung von Casgevy
Nach der Infusion von Casgevy sind die Standardverfahren zur Patientenüberwachung und -versorgung nach einer HSZ-Transplantation zu befolgen, wie z.B. die Überwachung des grossen Blutbildes und des Transfusionsbedarfs.
Blutprodukte, die in den ersten 3 Monaten nach der Infusion von Casgevy benötigt werden, müssen bestrahlt werden.
Nach der Infusion von Casgevy kann die Wiederaufnahme der Eisenchelation erforderlich sein. Die Anwendung von nicht myelosuppressiven Eisenchelatoren ist für mindestens 3 Monate nach der Infusion von Casgevy zu vermeiden und die Verwendung von myelosuppressiven Eisenchelatoren für mindestens 6 Monate. Anstelle einer Eisenchelation kann eine Phlebotomie durchgeführt werden, wenn dies angemessen ist (siehe "Interaktionen" ).
KontraindikationenÜberempfindlichkeit gegen den Wirkstoff oder einen der Hilfsstoffe (siehe "Zusammensetzung" ).
Die Gegenanzeigen der zur Mobilisierung und myeloablativen Konditionierung eingesetzten Arzneimittel sind zu beachten.
Warnhinweise und VorsichtsmassnahmenDie Warnhinweise und Vorsichtsmassnahmen für die Arzneimittel zur Mobilisierung und myeloablativen Konditionierung sind zu beachten.
Autologe Anwendung
Casgevy ist ausschliesslich für die autologe Anwendung bestimmt und darf unter keinen Umständen an andere Patienten verabreicht werden. Casgevy darf nicht angewendet werden, wenn die Angaben auf den Produktetiketten und auf dem Chargeninformationsblatt (LIS) nicht mit der Identität des Patienten übereinstimmen.
Übertragung eines Infektionserregers
Obwohl Casgevy auf Sterilität, Mykoplasmen und Endotoxine getestet wurde, besteht ein Risiko für die Übertragung von Infektionserregern. Angehörige von Gesundheitsberufen, die Casgevy anwenden, müssen daher die Patienten nach der Behandlung auf Anzeichen und Symptome von Infektionen überwachen und bei Bedarf entsprechend behandeln.
Überempfindlichkeitsreaktionen
Es besteht die Möglichkeit von Überempfindlichkeitsreaktionen bei Casgevy, einschliesslich durch Cas9. Schwerwiegende Überempfindlichkeitsreaktionen, einschliesslich Anaphylaxie, können durch das in Casgevy enthaltene Dimethylsulfoxid (DMSO) oder Dextran 40 auftreten. Die Patienten sollten während und nach der Infusion engmaschig überwacht werden. Eine Kontrolle der Vitalparameter (Blutdruck, Herzfrequenz und Sauerstoffsättigung) sowie eine Überwachung auf Symptome ist vor Beginn der Infusion, alle 30 Minuten ab der Infusion der ersten Durchstechflasche von Casgevy und bis 2 Stunden nach der Infusion der letzten Durchstechflasche von Casgevy erforderlich.
Mögliches Versagen des Neutrophilen-Engraftments
Das Versagen des Neutrophilen-Engraftments ist ein mögliches Risiko bei der hämatopoetischen Stammzelltransplantation und dadurch definiert, dass nach der Infusion von Casgevy keine Regeneration der Neutrophilen erreicht wird und die Anwendung von unveränderten CD34+-Reservezellen erforderlich ist. Die Patienten müssen im Hinblick auf die absolute Neutrophilenzahl (ANC) überwacht werden und Infektionen sind entsprechend den Standardleitlinien und nach ärztlichem Ermessen zu behandeln. Im Falle eines Versagens des Neutrophilen-Engraftments müssen den Patienten CD34+-Reservezellen infundiert werden (siehe "Unerwünschte Wirkungen" ).
Verzögertes Thrombozyten-Engraftment
Bei der Behandlung mit Casgevy wurden im Vergleich zur allogenen HSZ-Transplantation längere mediane Zeiten für das Thrombozyten-Engraftment beobachtet. Bis das Thrombozyten-Engraftment erreicht ist, besteht ein erhöhtes Blutungsrisiko.
Die Patienten müssen entsprechend den Standardleitlinien und nach ärztlichem Ermessen auf Blutungen überwacht werden. Häufige Messungen der Thrombozytenzahl sind so lange erforderlich, bis ein Thrombozyten-Engraftment und eine Erholung der Thrombozyten erreicht sind. Wenn klinische Symptome auftreten, die auf eine Blutung hindeuten, sind eine Bestimmung des Blutbildes und andere geeignete Untersuchungen durchzuführen (siehe "Unerwünschte Wirkungen" ).
Risiko einer unzureichenden Mobilisierung/Apherese bei Patienten mit SCD
Bei Patienten mit SCD sind gegebenenfalls mehr Mobilisierungs- und Apherese-Zyklen erforderlich als bei Patienten mit TDT und es besteht ein höheres Risiko des Versagens einer ausreichenden Mobilisierung/Apherese. In der klinischen Hauptstudie 121 zu SCD lagen die mediane (min.; max.) und durchschnittliche (SD) Anzahl von Mobilisierungs- und Apherese-Zyklen, die zur Herstellung von Casgevy und für die Entnahme der CD34+-Reservezellen erforderlich waren, bei 2 (1; 6) bzw. 2,21 (1,30). In der Studie 121 erreichten sechs (10,3 %) aller Patienten, bei denen eine Mobilisierung begonnen wurde, die Mindestdosis nicht und wurden aus der Studie genommen.
Siehe "Dosierung/Anwendung" zur empfohlenen Gesamtzielmenge der CD34+-Zellgewinnung.
Onkogenese als Folge der Geneditierung
In klinischen Studien mit Casgevy wurden keine Fälle von Myelodysplasie, Leukämie oder Lymphomen berichtet. Es besteht theoretisch das Risiko einer Onkogenese im Zusammenhang mit der Geneditierung. Die Patienten sind mindestens 15 Jahre lang nach der Behandlung mit Casgevy mindestens einmal jährlich (einschliesslich eines vollständigen Blutbildes) zu überwachen. Wenn hämatologische Malignome wie Myelodysplasie, Leukämie oder Lymphome festgestellt werden, wenden Sie sich an den örtlichen Vertreter des Zulassungsinhabers, um geeignete Proben für die Analyse zu ermitteln.
Immunogenität
In klinischen Studien mit Casgevy wurden keine immunvermittelten Reaktionen beobachtet. Es ist nicht bekannt, ob bereits gebildete Antikörper gegen Cas9, auch nach einer kürzlich erfolgten Infektion mit Streptococcus pyogenes, zu immunvermittelten Reaktionen und/oder zur Eliminierung von Zellen mit restlichem Cas9 führen könnten.
Spende von Blut, Organen, Geweben und Zellen
Patienten, die mit Casgevy behandelt wurden, dürfen kein Blut, keine Organe, kein Gewebe und keine Zellen für eine Transplantation spenden.
Langzeitnachbeobachtung
Bisher liegen nur wenige Daten zur Wirksamkeit und Sicherheit von Casgevy aus der Langzeitnachbeobachtung vor. Die mediane (min.; max.) Nachbeobachtungsdauer nach der Anwendung von Casgevy betrug 22,8 (2,1; 51,1) Monate bei Patienten mit TDT (N = 54) und 17,5 (1,2; 46,2) Monate bei Patienten mit SCD (N = 43). Die Patienten müssen mit jährlichen Kontrolluntersuchungen (einschliesslich Erstellung eines grossen Blutbildes) gemäss den Standardrichtlinien und dem ärztlichen Ermessen überwacht werden. Eine Langzeitnachbeobachtungsstudie (Studie 131), um die langfristige Sicherheit und Wirksamkeit von Casgevy genauer zu beschreiben, ist noch nicht abgeschlossen.
Natriumgehalt
Dieses Arzneimittel enthält 5,3 mg - 70 mg Natrium pro Durchstechflasche, entsprechend 0,3 - 4 % der von der WHO für einen Erwachsenen empfohlenen maximalen täglichen Natriumaufnahme mit der Nahrung von 2 g.
InteraktionenDie Wechselwirkungen mit Arzneimitteln zur Mobilisierung und myeloablativen Konditionierung müssen berücksichtigt werden.
Es wurden keine formellen Wechselwirkungsstudien durchgeführt. Es ist nicht zu erwarten, dass Casgevy mit der hepatischen Cytochrom-P-450-Enzymfamilie oder mit Wirkstofftransportern interagiert.
Die Anwendung von Hydroxyurea/Hydroxycarbamid muss mindestens 8 Wochen vor dem Beginn der Mobilisierung und Konditionierung beendet werden. Es liegen keine Erfahrungen mit der Anwendung von Hydroxyurea/Hydroxycarbamid nach der Infusion von Casgevy vor.
Die Anwendung von Voxelotor und Crizanlizumab ist mindestens 8 Wochen vor Beginn der Mobilisierung und Konditionierung zu beenden, da das Wechselwirkungspotenzial dieser Arzneimittel mit den Arzneimitteln zur Mobilisierung und myeloablativen Konditionierung nicht bekannt ist.
Eisenchelatoren müssen mindestens 7 Tage vor dem Beginn der myeloablativen Konditionierung abgesetzt werden, da es zu Wechselwirkungen mit dem Arzneimittel für die Konditionierung kommen kann. Einige Eisenchelatoren sind myelosuppressiv. Die Anwendung von nicht myelosuppressiven Eisenchelatoren ist für mindestens 3 Monate und die Anwendung von myelosuppressiven Eisenchelatoren für mindestens 6 Monate nach der Infusion von Casgevy zu vermeiden. Anstelle der Eisenchelation kann eine Phlebotomie durchgeführt werden, wenn dies angemessen ist.
Lebendimpfstoffe
Die Sicherheit einer Immunisierung mit viralen Lebendimpfstoffen während oder nach der Behandlung mit Casgevy wurde nicht untersucht. Als Vorsichtsmassnahme wird für mindestens 6 Wochen vor Beginn der Konditionierungsbehandlung, während der Behandlung mit Casgevy und bis zur hämatologischen Wiederherstellung nach der Behandlung eine Impfung mit Lebendimpfstoffen nicht empfohlen.
Schwangerschaft, StillzeitFrauen im gebärfähigen Alter/Empfängnisverhütung bei Männern und Frauen
Ein negativer Schwangerschaftstest im Serum muss vor dem Beginn jedes Mobilisierungszyklus bestätigt und vor der myeloablativen Konditionierung erneut bestätigt werden. Es liegen keine ausreichenden Expositionsdaten vor, um eine genaue Empfehlung für die Dauer der Empfängnisverhütung nach der Behandlung mit Casgevy zu geben. Gebärfähige Frauen und zeugungsfähige Männer müssen vom Beginn der Mobilisierung an bis mindestens 6 Monate nach der Anwendung der myeloablativen Konditionierung eine zuverlässige Verhütungsmethode anwenden. Die Fachinformation für das Arzneimittel zur myeloablativen Konditionierung ist ebenfalls zu beachten.
Schwangerschaft
Es liegen keine klinischen Daten über die Anwendung von Exagamglogen autotemcel bei Schwangeren vor. Es wurden keine tierexperimentellen Studien zur Reproduktions- und Entwicklungstoxizität von Exagamglogen autotemcel durchgeführt, um zu beurteilen, ob es den Fötus schädigen kann, wenn es einer Schwangeren verabreicht wird. Es ist nicht bekannt, ob Exagamglogen autotemcel auf den Fötus übertragen werden kann. Casgevy darf wegen des mit der myeloablativen Konditionierung verbundenen Risikos während der Schwangerschaft nicht angewendet werden. Eine Schwangerschaft nach der Infusion von Casgevy muss mit dem behandelnden Arzt besprochen werden (siehe Hinweise zur Empfängnisverhütung oben).
Stillzeit
Es ist nicht bekannt, ob Exagamglogen autotemcel in die Muttermilch ausgeschieden oder auf das gestillte Kind übertragen wird. Es liegen keine Daten vor.
Hinweise zur Anwendung während der Stillzeit sind in der Fachinformation des/der Arzneimittel(s) zur Mobilisierung und myeloablativen Konditionierung zu finden. Aufgrund der potenziellen Risiken, die mit der myeloablativen Konditionierung verbunden sind, muss während der Konditionierung abgestillt werden.
Die Entscheidung, nach der Behandlung mit Casgevy zu stillen, muss mit dem behandelnden Arzt besprochen werden, wobei der Nutzen des Stillens für das Kind gegen die möglichen Nebenwirkungen durch Casgevy oder durch die Grunderkrankung der Mutter abzuwägen ist.
Fertilität
Es liegen keine Daten über die Auswirkungen von Exagamglogen autotemcel auf die menschliche Fertilität vor. Die Auswirkungen auf die männliche und weibliche Fertilität wurden nicht in tierexperimentellen Studien untersucht. Es liegen Daten über das Risiko von Unfruchtbarkeit nach einer myeloablativen Konditionierung vor. Daher wird empfohlen, vor der Behandlung nach Möglichkeit Optionen zur Erhaltung der Fertilität wie die Kryokonservierung von Spermien oder Eizellen in Betracht zu ziehen.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenDie Wirkungen von Casgevy auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen wurde nicht untersucht.
Die Auswirkungen der Arzneimittel zur Mobilisierung und myeloablativen Konditionierung auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen müssen berücksichtigt werden.
Unerwünschte WirkungenZusammenfassung des Sicherheitsprofils
Die Sicherheit von Casgevy wurde in zwei offenen, einarmigen Studien (Studie 111 und Studie 121) und einer Langzeit-Nachbeobachtungsstudie (Studie 131) untersucht, in denen 97 Jugendliche und Erwachsene mit TDT oder SCD mit Casgevy behandelt wurden.
Der Behandlung mit Casgevy ging eine Mobilisierung des peripheren Blutes mit Granulozyten-Kolonie-stimulierendem Faktor (G-CSF) und Plerixafor bei Patienten mit TDT und nur mit Plerixafor bei Patienten mit SCD voraus. Darauf folgte eine Apherese und eine myeloablative Konditionierung mit Busulfan.
Das Sicherheitsprofil stimmte im Allgemeinen mit dem überein, das bei einer myeloablativen Konditionierung mit Busulfan und einer HSZ-Transplantation nach der Mobilisierung und Apherese zu erwarten war.
Die mediane (min., max.) Dauer der Verlaufskontrolle nach der Gabe von Casgevy betrug 22,8 Monate (2,1; 51,1) bei Patienten mit TDT (N=54) und 17,5 Monate (1,2; 46,2) bei Patienten mit SCD (N=43).
Schwerwiegende Nebenwirkungen, die auf Casgevy zurückgeführt wurden, traten bei 2 Patienten (3,7 %) mit TDT auf: 1 Patient (1,9 %) mit hämophagozytischer Lymphohistiozytose, akutem Atemnotsyndrom, idiopathischem Pneumoniesyndrom und Kopfschmerzen; 1 Patient (1,9 %) mit verzögertem Engraftment und Thrombozytopenie. Kein Patient mit SCD hatte schwerwiegende Nebenwirkungen, die auf Casgevy zurückgeführt wurden.
Eine lebensbedrohliche schwerwiegende Nebenwirkung in Form einer Kleinhirnblutung trat bei 1 Patient (1,9 %) mit TDT auf und wurde auf die myeloablative Konditionierung mit Busulfan zurückgeführt.
Ein Patient (2,3 %) mit SCD verstarb an einer COVID-19-Infektion und anschliessendem Atemversagen. Das Ereignis stand nicht in Zusammenhang mit Casgevy.
Liste der unerwünschten Wirkungen
Die unerwünschten Wirkungen sind nach Systemorganklassen gemäss MedDRA und nach Häufigkeit aufgeführt. Die Häufigkeiten sind definiert als: sehr häufig (≥1/10) und häufig (≥1/100, < 1/10). Innerhalb jeder Häufigkeitsgruppierung sind die Nebenwirkungen nach abnehmendem Schweregrad aufgeführt.
Die Tabellen 1, 2, 3 und 4 enthalten Auflistungen von Nebenwirkungen, die auf die Mobilisierung/Apherese mit G-CSF und Plerixafor, auf die Mobilisierung/Apherese nur mit Plerixafor, auf die myeloablative Konditionierung mit Busulfan bzw. auf Casgevy zurückgeführt werden und bei Patienten mit TDT und SCD in klinischen Studien mit Casgevy aufgetreten sind.
Tabelle 1: Auf die Mobilisierung/Apherese zurückgeführte Nebenwirkungen bei Patienten mit TDT, die G-CSF und Plerixafor erhielten (N = 59)
Systemorganklasse (SOC) Sehr häufig Häufig
Erkrankungen des Blutes und des Leukozytose, Thrombozytopenie
Lymphsystems
Stoffwechsel- und Ernährungsstörun Hypokaliämie
gen
Erkrankungen des Nervensystems Kopfschmerzen (18,6 %)
Erkrankungen der Atemwege, des Schmerzen im Oropharynx
Brustraums und Mediastinums
Erkrankungen des Gastrointestinalt Übelkeit (11,9 %) Abdominalschmerz, Erbrechen,
rakts Diarrhoe, orale Hypästhesie
Skelettmuskulatur-, Bindegewebs- Schmerzen des Muskel- und
und Knochenerkrankungen Skelettsystems (45,8 %) *
Allgemeine Erkrankungen und Schmerzen, Fieber
Beschwerden am Verabreichungsort
* Schmerzen des Muskel- und Skelettsystems umfassten Rückenschmerzen, Knochenschmerzen, muskuloskelettale Brustkorbschmerzen, Nackenschmerzen, nicht kardiale Brustkorbschmerzen und Schmerzen in einer Extremität.
Table 2: Auf die Mobilisierung/Apherese zurückgeführte Nebenwirkungen bei Patienten mit SCD, die Plerixafor erhielten (N = 58)
Systemorganklasse (SOC) Sehr häufig Häufig
Erkrankungen des Blutes und des Sichelzellanämie
Lymphsystems mit Krise
Stoffwechsel- und Ernährungsstörunge Hyperphosphatämie,
n Hypomagnesiämie
Erkrankungen des Nervensystems Kopfschmerzen (12,1 %)
Erkrankungen der Atemwege, des Akutes Thoraxsyndrom
Brustraums und Mediastinums
Erkrankungen des Gastrointestinaltra Abdominalschmerz (15,5 %) *, Übelkeit Diarrhoe
kts (44,8 %), Erbrechen (12,1 %)
Skelettmuskulatur-, Bindegewebs- Schmerzen des Muskel- und Arthralgie
und Knochenerkrankungen Skelettsystems (15,5 %) †
Allgemeine Erkrankungen und Schmerzen, Ermüdung
Beschwerden am Verabreichungsort
* Abdominalschmerz umfasste Oberbauchschmerzen.
† Schmerzen des Muskel- und Skelettsystems umfasste Rückenschmerzen, Knochenschmerzen, Brustkorbschmerzen, Nackenschmerzen, nicht kardiale Brustschmerzen und Schmerzen in einer Extremität.
Tabelle 3: Auf die myeloablative Konditionierung mit Busulfan zurückgeführte Nebenwirkungen bei Patienten mit TDT und SCD (N = 97) *
Systemorganklasse Sehr häufig Häufig
(SOC)
Infektionen und Pneumonie, Sepsis, Klebsiella-Sepsis,
parasitäre Erkrankun orale Candidiasis, Follikulitis
gen
Erkrankungen des Thrombozytopenie (67,4 %), febrile Panzytopenie, Retikulozytopenie,
Blutes und des Neutropenie (51,2 %), Neutropenie Splenomegalie
Lymphsystems (60,5 %), Anämie (34,9 %),
Lymphopenie (23,3 %) †, Leukopenie
(18,6 %)
Stoffwechsel- und Appetit vermindert (48,8 %), Hypoalbuminämie, Hypokalzämie
Ernährungsstörungen Hypokaliämie (18,5 %), Hyperphosphatäm
ie (11,6 %), Hypomagnesiämie (11,6
%), Flüssigkeitsretention (11,1 %),
Hypophosphatämie (11,1 %)
Erkrankungen des Kopfschmerzen (18,6 %) Kleinhirnblutung, Hydrozephalus,
Nervensystems periphere sensorische Neuropathie,
periphere Neuropathie, Neuralgie,
Dysgeusie
Augenerkrankungen Verschwommenes Sehen, trockenes Auge
Herzerkrankungen Tachykardie
Gefässerkrankungen Hypotonie, Hitzewallung
Erkrankungen der Epistaxis (25,9 %), Schmerzen im Ateminsuffizienz, idiopathisches
Atemwege, des Oropharynx (20,9 %) Pneumoniesyndrom, Hypoxie, Dyspnoe,
Brustraums und Husten
Mediastinums
Erkrankungen des Mukositis (93,0 %) ‡, Übelkeit (79,1 Kolitis, Dyspepsie, Zahnfleischbluten,
Gastrointestinaltrak %), Erbrechen (46,5 %), gastroösophageale Refluxkrankheit,
ts Abdominalschmerz (39,5 %) §, Diarrhoe Hämatemesis, Ösophagitis, Dysphagie,
(20,9 %), Obstipation (16,3 %), Magen-Darm-Entzündung, Hämatochezie,
Gastritis (11,6 %) Mundulzeration
Leber- und Gallenerk Venookklusive Lebererkrankung (13,0 Aspartat-Aminotransferase erhöht,
rankungen %), Hyperbilirubinämie (18,6 %), Hepatomegalie, Gamma-Glutamyltransfera
Alanin-Aminotransferase erhöht (14,8 se erhöht
%)
Erkrankungen der Pigmentierungsstörung (30,2 %) #, Pruritus, Erythem
Haut und des Unterha Exfoliation der Haut (20,9 %),
utgewebes Alopezie (18,5 %), Petechien (18,5
%), trockene Haut (14,0 %),
Hautausschlag (11,6 %) **
Skelettmuskulatur-, Schmerzen des Muskel- und Arthralgie
Bindegewebs- und Skelettsystems (14,8 %) ††
Knochenerkrankungen
Erkrankungen der Dysurie, Hämaturie
Nieren und Harnwege
Erkrankungen der Amenorrhoe, intermenstruelle
Geschlechtsorgane Blutungen, vulvovaginale Schmerzen,
und der Brustdrüse Dysmenorrhoe, unregelmässige
Menstruation, vorzeitige Menopause
Allgemeine Erkrankun Fieber (27,9 %), Ermüdung (18,6 %) Schmerzen
gen und Beschwerden
am Verabreichungsort
Untersuchungen Gewicht vermindert (14,0 %) International Normalised Ratio (INR)
erhöht, C-reaktives Protein erhöht,
Gewicht erhöht
Verletzung, Vergiftu Verzögertes Engraftment, subkutanes
ng und durch Eingrif Hämatom, Hautabschürfung,
fe bedingte Komplika Hautlazeration
tionen
* Die Häufigkeit beruht auf der höchsten Inzidenz in Studie 111 bei Patienten mit TDT bzw. in Studie 121 bei Patienten mit SCD.
† Lymphopenie umfasste CD4-Lymphozyten erniedrigt und Lymphozytenzahl erniedrigt.
‡ Mukositis umfasste Analentzündung, Schleimhautentzündung, Rachenentzündung und Stomatitis.
§ Abdominalschmerz umfasste abdominale Beschwerden, Schmerzen im Unterbauch, Schmerzen im Oberbauch, abdominaler Druckschmerz und epigastrische Beschwerden.
# Pigmentierungsstörung umfasste Nagelpigmentierung, Hauthyperpigmentierung und Hauthypopigmentierung.
**Ausschlag umfasste Dermatitis, erythematöser Ausschlag, makulöser Ausschlag, makulopapulöser Ausschlag und papulöser Ausschlag.
†† Schmerzen des Muskel- und Skelettsystems umfasste Rückenschmerzen, Knochenschmerzen, Brustkorbschmerzen und Schmerzen in einer Extremität.
Tabelle 4: Auf Casgevy zurückgeführte Nebenwirkungen bei Patienten mit TDT und SCD (N = 97) *
Systemorganklasse (SOC) Sehr häufig Häufig
Erkrankungen des Blutes und des Lymphopenie (18,6 Thrombozytopenie †, Neutropenie †,
Lymphsystems %) †, ‡ Anämie †, Leukopenie †
Erkrankungen des Immunsystems Hämophagozytische Lymphohistiozytose
Stoffwechsel- und Ernährungsstörungen Hypokalzämie †
Erkrankungen des Nervensystems Kopfschmerzen †, Parästhesie
Herzerkrankungen Tachykardie †
Erkrankungen der Atemwege, des Akutes Atemnotsyndrom, idiopathisches
Brustraums und Mediastinums Pneumonie-Syndrom †, Epistaxis †
Erkankungen der Haut und des Ausschlag †, §, Petechien †
Unterhautgewebes
Allgemeine Erkrankungen und Schüttelfrost †, Fieber †
Beschwerden am Verabreichungsort
Verletzung, Vergiftung und durch Verzögertes Engraftment †,
Eingriffe bedingte Komplikationen infusionsbedingte Reaktionen #
* Die Häufigkeit beruht auf der höchsten Inzidenz in Studie 111 bei Patienten mit TDT bzw. in Studie 121 bei Patienten mit SCD.
† Mindestens ein Ereignis wurde auch auf die myeloablative Konditionierung mit Busulfan zurückgeführt.
‡ Lymphopenie umfasste CD4-Lymphozyten erniedrigt und Lymphozytenzahl erniedrigt.
§ Ausschlag umfasste Dermatitis.
# Infusionsbedingte Reaktionen umfasste Schüttelfrost, Sinustachykardie und Tachykardie.
Beschreibung spezifischer unerwünschter Wirkungen und Zusatzinformationen
Thrombozyten-Engraftment
Ein Thrombozyten-Engraftment war definiert als 3 aufeinanderfolgende Messungen einer Thrombozytenzahl von ≥20 × 109/l bei Patienten mit TDT und 3 aufeinanderfolgende Messungen einer Thrombozytenzahl von ≥50 × 109/l bei Patienten mit SCD, die an 3 verschiedenen Tagen nach der Infusion von Casgevy ohne Gabe von Thrombozytentransfusionen über 7 Tage gewonnen wurden. Alle Patienten erreichten ein Thrombozyten-Engraftment.
In Studie 111 lag die mediane (min., max.) Zeit bis zum Thrombozyten-Engraftment bei Patienten mit TDT bei 44 Tagen (20, 200; n=53). Bei einem verbleibenden Patienten wurde das Thrombozyten-Engraftment nach der Zwischenanalyse erreicht. Die mediane (min., max.) Zeit bis zum Thrombozyten-Engraftment betrug bei Jugendlichen 45 Tage (20, 199) und bei Erwachsenen 40 Tage (24, 200). Bei Patienten ohne Milz war die mediane Zeit bis zum Thrombozyten-Engraftment kürzer als bei Patienten mit intakter Milz. Die mediane (min., max.) Zeit bis zum Thrombozyten-Engraftment lag bei Patienten ohne Milz bei 34,5 Tagen (20, 78) und bei Patienten mit intakter Milz bei 46 Tagen (27, 200).
In Studie 121 betrug die mediane (min., max.) Zeit bis zum Thrombozyten-Engraftment bei Patienten mit SCD 35 Tage (23, 126; n=43). Die mediane (min., max.) Zeit bis zum Thrombozyten-Engraftment betrug bei Jugendlichen 44,5 Tage (23, 81) und bei Erwachsenen 32 Tage (23, 126).
Es wurde kein Zusammenhang zwischen Blutungsereignissen und der Zeit bis zum Thrombozyten-Engraftment nach einer Casgevy-Behandlung festgestellt.
Neutrophilen-Engraftment
Das Neutrophilen-Engraftment war definiert als 3 aufeinanderfolgende Messungen einer absoluten Neutrophilenzahl (ANC) von ≥500 Zellen/µl an 3 verschiedenen Tagen nach der Infusion von Casgevy, ohne Anwendung der unveränderten CD34+-Reservezellen. Alle Patienten erreichten ein Neutrophilen-Engraftment und kein Patient erhielt CD34+-Reservezellen.
In Studie 111 betrug die mediane (min., max.) Zeit bis zum Neutrophilen-Engraftment bei Patienten mit TDT 29 Tage (12, 56; n=54). Die mediane (min., max.) Zeit bis zum Neutrophilen-Engraftment betrug bei Jugendlichen 31 Tage (19, 56) und bei Erwachsenen 29 Tage (12, 40).
In Studie 121 betrug die mediane (min., max.) Zeit bis zum Neutrophilen-Engraftment bei Patienten mit SCD 27 Tage (15, 40; n=43). Die mediane (min., max.) Zeit bis zum Neutrophilen-Engraftment betrug bei Jugendlichen 28 Tage (24, 40) und bei Erwachsenen 26 Tage (15, 38).
Es wurde kein Zusammenhang zwischen Infektionen und der Zeit bis zum Neutrophilen-Engraftment festgestellt.
Kinder und Jugendliche
Die Sicherheit von Casgevy wurde bei 31 Jugendlichen im Alter von 12 bis unter 18 Jahren mit TDT oder SCD bewertet. Das mediane (min., max.) Alter der Jugendlichen mit TDT war 14 Jahre (12, 17) und bei den SCD-Patienten 15 Jahre (12, 17). Die mediane (min., max.) Nachbeobachtungsdauer betrug bei Jugendlichen mit TDT 19,6 Monate (2,1; 26,6) und bei Jugendlichen mit SCD 14,7 Monate (2,5; 18,7). Das Sicherheitsprofil war bei Jugendlichen und Erwachsenen im Allgemeinen gleich. Die Zeiten bis zum Engraftment waren bei Jugendlichen und Erwachsenen vergleichbar.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungNicht zutreffend.
Eigenschaften/WirkungenATC-Code
B06AX05
Wirkungsmechanismus
Casgevy ist eine Zelltherapie, bestehend aus autologen CD34+-HSPC, die mithilfe der CRISPR/Cas9-Technologie ex vivo editiert wurden. Die hochspezifische Leit-RNA ermöglicht es, mittels CRISPR/Cas9 einen präzisen DNA-Doppelstrangbruch an der kritischen Transkriptionsfaktor-Bindungsstelle (GATA1) in der Erythroid-spezifischen Enhancer-Region des BCL11A-Gens zu erzielen. Durch die Editierung wird die GATA1-Bindung irreversibel unterbrochen und die BCL11A-Expression reduziert. Die reduzierte BCL11A-Expression führt zu einem Anstieg der γ-Globin-Expression und zur Bildung des Proteins fetales Hämoglobin (HbF) in den erythroiden Zellen, wodurch das fehlende Globin bei der transfusionsabhängigen Beta-Thalassämie (TDT) und das abweichende Globin bei der Sichelzellkrankheit (SCD), die die zugrundeliegenden Krankheitsursachen sind, ersetzt werden. Bei Patienten mit TDT wird durch die Bildung von γ-Globin die Korrektur des Ungleichgewichts zwischen dem α-Globin und dem Nicht-α-Globin erwartet, wodurch die ineffektive Erythropoese und Hämolyse verringert wird, und der Gesamthämoglobinspiegel ansteigt. Bei Patienten mit schwerer SCD wird durch die Expression von HbF die Verringerung der intrazellulären HbS-Konzentration erwartet, was die Sichelbildung der roten Blutzellen verhindert.
Klinische Wirksamkeit
Die Wirksamkeit von Casgevy wurde bei Jugendlichen und Erwachsenen im Alter von 12 bis 35 Jahren mit transfusionsabhängiger Beta-Thalassämie (TDT) oder Sichelzellkrankheit (SCD) in zwei offenen, einarmigen Studien (Studie 111 und Studie 121) und einer Langzeit-Nachbeobachtungsstudie (Studie 131) untersucht.
Transfusionsabhängige Beta-Thalassämie
Studie 111 ist eine noch laufende offene, multizentrische, einarmige Studie zur Bewertung der Sicherheit und Wirksamkeit von Casgevy bei Erwachsenen und Jugendlichen mit transfusionsabhängiger Beta-Thalassämie. Nach Abschluss der 24-monatigen Nachbeobachtung in Studie 111 wurden die Patienten eingeladen, an Studie 131 teilzunehmen, einer noch laufenden Langzeitstudie zur Sicherheit und Wirksamkeit.
Die Patienten kamen für die Studie in Frage, wenn sie in den 2 Jahren vor der Aufnahme in die Studie mindestens 100 ml/kg/Jahr oder 10 Einheiten/Jahr an Erythrozytentransfusionen benötigten. Die Patienten benötigten ausserdem einen Lansky- oder Karnofsky-Performance-Score von ≥80 %.
Ausgeschlossen von der Studie waren Patienten, für die ein HLA-kompatibler, verwandter HSZ-Spender zur Verfügung stand. Patienten mit stark erhöhtem Eisengehalt im Herzen (d.h. Patienten mit einer kardialen T2* von weniger als 10 ms in der Magnetresonanztomographie [MRT]) oder einer fortgeschrittenen Lebererkrankung wurden von der Studie ausgeschlossen. Bei allen Patienten wurde eine MRT der Leber durchgeführt. Bei Patienten mit MRT-Ergebnissen, die einen Eisengehalt in der Leber von ≥15 mg/g zeigten, wurde zur weiteren Abklärung eine Leberbiopsie durchgeführt. Patienten mit einer Leberbiopsie, die eine Brückenfibrose oder Zirrhose zeigten, wurden ausgeschlossen.
Von den 59 Patienten, die in Studie 111 mit der Mobilisierung begannen, brachen 3 Patienten (5,1 %) die Behandlung vor der Casgevy-Infusion ab, alle wegen Widerrufs der Einwilligungserklärung.
Die wichtigsten demographischen Daten und Baseline-Charakteristika sind in Tabelle 5 gezeigt, und zwar (1) von allen Patienten, die in Studie 111 aufgenommen wurden, und (2) von allen Patienten, die in Studie 111 eine Infusion von Casgevy erhielten.
Tabelle 5: Demographische Daten und Baseline-Charakteristika in Study 111
Demographische Daten und Krankheitsmerkmale Casgevy aufgenommene Casgevy Patienten mit
Patienten (N=59) § Infusion † (N=54)
Alter, n (%)
Erwachsene (≥18 und ≤35 Jahre) Jugendliche 39 (66,1 %) 20 (33,9 %) 35 (64,8 %) 19 (35,2 %)
(≥12 und < 18 Jahre)
Alle Altersgruppen (≥12 und ≤35 Jahre)
Median (min., max.) 19 (12; 35) 20 (12; 35)
Geschlecht, n (%)
Weiblich 28 (47,5 %) 25 (46,3 %)
Männlich 31 (52,5 %) 29 (53,7 %)
Ethnie, n (%)
Asiatisch 25 (42,4 %) 23 (42,6 %)
Weisshäutig 19 (32,2 %) 18 (33,3 %)
Sonstige# 6 (10,2 %) 5 (9,3 %)
Nicht erfasst 9 (15,3 %) 8 (14,8 %)
Genotyp, n (%)
β0/β0-artig ‡ 38 (64,4 %) 33 (61,1 %)
Nicht-β0/β0-artig 21 (35,6 %) 21 (38,9 %)
Annualisiertes Erythrozytentransfusionsvolume
n zu Studienbeginn (ml/kg)
Median (min., max.) 211,2 (48,3; 330,9) 205,7 (48,3; 330,9)
Annualisierte Erythrozytentransfusionsepisode
n zu Studienbeginn
Median (min., max.) 16,5 (5,0; 34,5) 16,5 (5,0; 34,5)
Intakte Milz, n (%) 43 (72,9 %) 38 (70,4 %)
Eisenkonzentration in der Leber zu
Studienbeginn (mg/g)
Median (min., max.) 3,5 (1,2; 14,8) 3,5 (1,2; 14,0)
Kardiales Eisen T2* (msec) zu Studienbeginn
Median (min., max.) 34,1 (12,4; 61,1) 34,4 (12,4; 61,1)
Serumferritin (pmol/l) zu Studienbeginn
Median (min., max.) 3'100,9 (584,2; 10 837,3) 3'115,5 (584,2; 10 837,3)
§ N steht für die Gesamtzahl der aufgenommenen Patienten, die eine Einwilligungserklärung unterzeichneten.
† Die Zwischenanalyse wurde auf Basis des Datenschnitts April 2023, mit 54 Patienten durchgeführt, die Casgevy erhalten hatten, und 2 Patienten, denen eine Casgevy-Infusion bevorstand.
‡ Niedrige bis keine endogene Beta-Globinbildung (β0/β0, β0/IVS-I-110 und IVS-I-110/IVS-I-110).
# Einschliesslich "gemischtrassig" .
Mobilisierung und Apherese
Zur Aufrechterhaltung eines Gesamt-Hb-Werts von ≥11 g/dl mussten die Patienten vor der Mobilisierung und Apherese Erythrozytentransfusionen erhalten und weitere Transfusionen bis zum Beginn der myeloablativen Konditionierung.
Zur Mobilisierung von Stammzellen für die Apherese wurde den Patienten in Studie 111 Granulozyten-Kolonie-stimulierender Faktor (G-CSF) verabreicht. Patienten mit Milz wurde eine geplante Dosis von 5 μg/kg G-CSF etwa alle 12 Stunden als intravenöse oder subkutane Injektion über 5 bis 6 Tage gegeben. Splenektomierte Patienten erhielten eine geplante Dosis von 5 μg/kg G-CSF einmal täglich für 5 bis 6 Tage. Die Dosis wurde bei splenektomierten Patienten auf alle 12 Stunden erhöht, wenn kein Anstieg der weissen Blutzellen oder der CD34+-Zellen im peripheren Blut zu verzeichnen war. Nach viertägiger Anwendung von G-CSF erhielten alle Patienten Plerixafor in einer geplanten Dosis von 0,24 mg/kg, die etwa 4 bis 6 Stunden vor jeder geplanten Apherese subkutan injiziert wurde. Die Apherese wurde an bis zu 3 aufeinanderfolgenden Tagen durchgeführt, um die angestrebte Zellentnahme für die Herstellung des Arzneimittels und für die unveränderten CD34+-Reservezellen zu erreichen. Die mittlere (SD) und mediane (min., max.) Anzahl der Mobilisierungs- und Apheresezyklen, die für die Herstellung von Casgevy und für die Gewinnung von CD34+-Reservezellen erforderlich waren, betrug 1,3 (0,7) bzw. 1 (1, 4).
Konditionierung zur Vorbehandlung
Alle Patienten erhielten vor der Behandlung mit Casgevy eine vollständige myeloablative Konditionierung mit Busulfan. Busulfan wurde an 4 aufeinanderfolgenden Tagen intravenös über einen zentralen Venenkatheter in einer geplanten Anfangsdosis von 3,2 mg/kg/Tag einmal täglich oder 0,8 mg/kg alle 6 Stunden verabreicht. Die Busulfan-Plasmaspiegel wurden durch serielle Blutentnahmen gemessen und die Dosis angepasst, um die Exposition im Zielbereich zu halten. Bei einmal täglicher Anwendung betrug die angestrebte kumulative Busulfan-Exposition über vier Tage 82 mg*h/l (Bereich: 74 bis 90 mg*h/l), entsprechend einer AUC0-24h von 5'000 μM*min (Bereich: 4'500 bis 5'500 μM*min). Bei einer Anwendung alle 6 Stunden betrug die angestrebte viertägige kumulative Busulfan-Exposition 74 mg*h/l (Bereich: 59 bis 89 mg*h/l), was einer AUC0-6h von 1'125 μM*min (Bereich: 900 bis 1'350 μM*min) entspricht.
Alle Patienten erhielten vor Beginn der Konditionierung mit Busulfan eine Prophylaxe gegen Krampfanfälle mit anderen Arzneimitteln als Phenytoin. Phenytoin wurde wegen seiner Induktion von Cytochrom P-450 und der daraus resultierenden erhöhten Clearance von Busulfan nicht zur Prophylaxe von Krampfanfällen eingesetzt.
Eine Prophylaxe gegen die hepatische venookklusive Erkrankung (VOD)/das hepatische sinusoidale Obstruktionssyndrom wurde gemäss den institutionellen Richtlinien durchgeführt.
Anwendung von Casgevy
Die Patienten erhielten Casgevy in einer medianen (min., max.) Dosis von 8,0 (3,0; 19,7) × 106 CD34+-Zellen/kg als intravenöse Infusion. Allen Patienten wurde vor der Infusion von Casgevy ein Antihistaminikum und ein fiebersenkendes Arzneimittel gegeben.
Nach der Anwendung von Casgevy
G-CSF wurde in den ersten 21 Tagen nach der Infusion von Casgevy nicht empfohlen. Da es sich bei Casgevy um eine autologe Therapie handelt, waren nach der ersten myeloablativen Konditionierung keine immunsuppressiven Arzneimittel erforderlich.
Ergebnisse zur Wirksamkeit – Beta-Thalassämie
Mit 42 Patienten, denen Casgevy verabreicht wurde und die für die primäre Wirksamkeitsanalyse geeignet waren, wurde eine Zwischenanalyse durchgeführt. Das primäre Wirksamkeitsset (primary efficacy set, PES) war definiert als alle Studienteilnehmer, die nach der Infusion von Casgevy mindestens 16 Monate lang nachbeobachtet worden waren. Zum Zeitpunkt der Zwischenanalyse waren 59 Patienten in die Studie aufgenommen und 54 Patienten hatten Casgevy erhalten. Die mediane (min., max.) Gesamtdauer der Nachbeobachtung betrug 22,8 Monate (2,1; 51,1) ab dem Zeitpunkt der Infusion von Casgevy.
Die Wirksamkeit von Casgevy wurde anhand der Auswertung von Patienten mit einer Nachbeobachtungsdauer von mindestens 16 Monaten bewertet. Der primäre Endpunkt war der Anteil von Patienten, die 12 Monate in Folge transfusionsunabhängig waren (TI12). Dies war definiert als Aufrechterhaltung eines gewichteten durchschnittlichen Hb-Werts von ≥9 g/dl ohne Erythrozytentransfusionen für mindestens 12 aufeinanderfolgende Monate zu einem beliebigen Zeitpunkt innerhalb der ersten 24 Monate nach der Infusion von Casgevy in Studie 111. Die Bewertung erfolgte ab 60 Tagen nach der letzten Erythrozytentransfusion als Unterstützung nach der Transplantation oder zur Behandlung der TDT.
Die Daten zur Wirksamkeit sind in Tabelle 6 und Tabelle 7 zusammengestellt. Tabelle 6 zeigt den primären Endpunkt für (1) alle Patienten, die in Studie 111 aufgenommen wurden, und (2) alle Patienten, die in Studie 111 eine Infusion von Casgevy erhielten. Tabelle 7 zeigt die sekundären Endpunkte von Patienten, die in Studie 111 eine Infusion von Casgevy erhielten.
Tabelle 6: Primärer Wirksamkeitsendpunkt bei Patienten mit TDT
Primärer Endpunkt Casgevy aufgenommene Patienten Casgevy Patienten mit Infusion
* (N=45) † * (N=42) ‡
Anteil von Patienten, die TI12
erreichten §
n (%) 39 (86,7 %) 39 (92,9 %)
(95 %-KI) (73,2 %; 94,9 %) (80,5 %; 98,5 %)
* Die Zwischenanalyse wurde auf Basis des Datenschnitts April 2023 durchgeführt.
† N steht für die Gesamtzahl der aufgenommenen Patienten, die eine Einwilligungserklärung unterzeichneten, und schliesst Patienten aus, die zum Zeitpunkt der Analyse auf eine Behandlung mit Casgevy warteten, oder Patienten, die für den primären Wirksamkeitsendpunkt noch nicht auswertbar waren.
‡ N steht für die Gesamtzahl der Patienten des primären Wirksamkeitssets (PES), einer Untergruppe des vollständigen Analysesets (full analysis set, FAS). Das PES war definiert als alle Patienten, die eine Infusion von Casgevy erhielten und nach der Casgevy-Infusion mindestens 16 Monate lang beobachtet wurden. Patienten, bei denen die Nachbeobachtungsdauer aufgrund von Tod oder Abbruch der Studie wegen Casgevy-bedingter unerwünschter Ereignisse kürzer als 16 Monate war oder die nach der Infusion von Casgevy länger als 12 Monate kontinuierlich Erythrozytentransfusionen erhielten, wurden ebenfalls in diese Gruppe eingeschlossen.
§ TI12 ist definiert als Aufrechterhaltung eines gewichteten durchschnittlichen Hb-Wertes ≥9 g/dl ohne Erythrozytentransfusionen für mindestens 12 aufeinanderfolgende Monate zu jedem Zeitpunkt nach der Casgevy-Infusion. Die Bewertung von TI12 erfolgt ab 60 Tage nach der letzten Erythrozytentransfusion als Unterstützung nach der Transplantation oder zur Behandlung der TDT.
Table 7: Sekundäre Wirksamkeitsendpunkte bei Patienten mit TDT
Sekundäre Endpunkte Casgevy Patienten mit Infusion *
(N=42) †
Dauer der Transfusionsunabhängigkeit bei Patienten, die TI12
erreichten (Monate)
n 39 22,3 (13,5; 48,1)
Median (min., max.)
Gesamt-Hb (g/dl)
in Monat 6
n 42
Mittelwert (SD) 12,1 (2,0)
in Monat 24
n 23
Mittelwert (SD) 12,9 (2,4)
HbF (g/dl)
in Monat 6
n 42
Mittelwert (SD) 10,8 (2,8)
in Monat 24
n 23
Mittelwert (SD) 11,5 (2,7)
* Die Zwischenanalyse wurde auf Basis des Datenschnitts April 2023 durchgeführt.
† N steht für die Gesamtzahl der Patienten des primären Wirksamkeitssets (PES), einer Untergruppe des vollständigen Analysesets (FAS). Das PES war definiert als alle Patienten, die eine Infusion von Casgevy erhielten und nach der Casgevy-Infusion mindestens 16 Monate lang beobachtet wurden. Studienteilnehmer, bei denen die Nachbeobachtungsdauer aufgrund von Tod oder Abbruch der Studie wegen Casgevy-bedingter unerwünschter Ereignisse kürzer als 16 Monate war oder die nach der Infusion von Casgevy länger als 12 Monate kontinuierlich Erythrozytentransfusionen erhielten, wurden ebenfalls in diese Gruppe eingeschlossen.
SD: Standardabweichung.
Alle Patienten, die TI12 erreichten, blieben transfusionsunabhängig, mit einer medianen (min., max.) Dauer der Transfusionsunabhängigkeit von 22,3 Monaten (13,5; 48,1) und normalen gewichteten durchschnittlichen Gesamt-Hb-Werten (Mittelwert [SD] 13,2 [1,4] g/dl). Die mediane Zeit (min., max.) bis zur letzten Erythrozytentransfusion bei Patienten, die TI12 erreichten, betrug 28 Tage (11, 91) nach der Infusion von Casgevy. Drei Patienten erreichten TI12 nicht. Bei diesen Patienten kam es im Zeitverlauf zu einer Abnahme der Häufigkeit von Erythrozytentransfusionen und sie erhielten zwischen 12,2 und 21,6 Monaten nach der Casgevy-Infusion keine Transfusionen mehr. Dies entspricht einer insgesamt langsameren Erholung der Hämatopoese.
Abbildung 1 zeigt die Gesamt-Hb- (g/dl) und HbF-Werte (g/dl) im Zeitverlauf für alle Patienten, die Casgevy zur Behandlung von Beta-Thalassämie erhielten.
Abbildung 1: Mittlere Gesamt-Hb- (g/dl) und HbF-Werte (g/dl) im Zeitverlauf von Patienten mit TDT
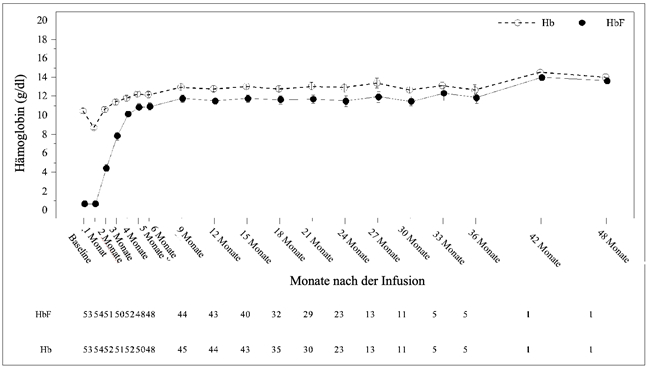
Die Mittelwerte sind in der Linie dargestellt, und die +Standardfehler (standard error, SE)-Werte und -SE-Werte der Mittelwerte sind als Balken bei jedem Besuch dargestellt. Die Anzahl der Patienten mit verfügbaren Werten bei den entsprechenden Besuchen ist unter der Abbildung angegeben.
Bereits im 3. Monat nach der Infusion von Casgevy wurde ein Anstieg der mittleren (SD) Gesamt-Hb- und HbF-Werte beobachtet, und diese Werte stiegen bis zum 6. Monat auf 12,2 (2,0) g/dl bzw. 10,9 (2,7) g/dl weiter an. Nach dem 6. Monat blieben die Gesamt-Hb- und HbF-Werte konstant, wobei HbF ≥88 % des Gesamt-Hb-Werts ausmachte.
Alle Patienten, die in Studie 111 (n = 39) TI12 erreichten, hatten normale (28/39 Patienten, 71,8 %) oder nahezu normal (11/39 Patienten, 28,2 %) gewichtete durchschnittliche Gesamt-Hb-Werte. Die Patienten mit nahezu normal gewichteten durchschnittlichen Gesamt-Hb-Werten umfassten 6 Männer mit gewichteten durchschnittlichen Gesamt-Hb-Werten zwischen < 0,1 und 0,7 g/dl der alters- und geschlechtsabhängigen WHO-Referenzschwelle und 5 Frauen mit gewichteten durchschnittlichen Gesamt-Hb-Werten zwischen < 0,4 und 1,4 g/dl der alters- und geschlechtsabhängigen WHO-Referenzschwelle.
Subgruppenanalysen, in denen die Auswirkungen auf transfusionsbezogene Endpunkte und hämatologische Parameter in den Subgruppen Alter, Geschlecht, Ethnie oder Genotyp untersucht wurden, ergaben keine Unterschiede aufgrund dieser Faktoren.
Sichelzellkrankheit
Studie 121 ist eine noch laufende, offene, multizentrische, einarmige Studie zur Bewertung der Sicherheit und Wirksamkeit von Casgevy bei Erwachsenen und Jugendlichen mit schwerer Sichelzellkrankheit. Nach Abschluss der 24-monatigen Nachbeobachtung in Studie 121 wurden die Patienten eingeladen, an Studie 131 teilzunehmen, einer noch laufenden Langzeitstudie zur Sicherheit und Wirksamkeit.
Die Patienten kamen für die Studie in Frage, wenn sie in den letzten 2 Jahren vor dem Screening mindestens 2 schwere vasookklusive Krisen (VOC) pro Jahr erlitten hatten, die definiert waren als:
akutes Schmerzereignis, das einen Besuch in einer medizinischen Einrichtung und die Anwendung von Schmerzmitteln (Opioide oder intravenöse nichtsteroidale Entzündungshemmer [NSAR]) oder Erythrozytentransfusionen erfordert,
akutes Thoraxsyndrom.
-Priapismus mit einer Dauer von > 2 Stunden, der einen Besuch in einer medizinischen Einrichtung erfordert,
-Sequestrierung der Milz.
Patienten mit den Genotypen HbS/S, HbS/β0 und HbS/β+ kamen für die Aufnahme in Frage. Die Patienten benötigten ausserdem einen Lansky- oder Karnofsky-Leistungsscore von ≥80 %.
Patienten wurden von der Studie ausgeschlossen, wenn für sie ein HLA-kompatibler, verwandter HSZ-Spender zur Verfügung stand. Patienten wurden ausgeschlossen, wenn sie eine fortgeschrittene Lebererkrankung, eine unbehandelte Moyamoya-Krankheit in der Vorgeschichte hatten oder eine Moyamoya-Krankheit vorlag, die nach Ansicht des Prüfarztes ein Blutungsrisiko für den Patienten darstellte. Patienten im Alter von 12 bis 16 Jahren mussten eine transkraniale Doppler-Untersuchung (TCD) mit unauffälligem Befund vorweisen, und Patienten im Alter von 12 bis 18 Jahren wurden ausgeschlossen, wenn sie in der Vergangenheit eine auffällige TCD in der mittleren Hirnarterie und der inneren Carotisarterie hatten.
Von den 58 Patienten, die in Studie 121 mit der Mobilisierung begannen, brachen 11 Patienten (19,0 %) die Behandlung nach Beginn der Mobilisierung und Apherese und vor der Verabreichung von Casgevy ab. Sechs Patienten (10,3 %) erreichten nicht die Mindestdosis. Fünf Patienten (8,6 %) brachen die Studie ab wegen mangelnder Compliance, Widerruf der Einwilligungserklärung oder weil sie die Eignungskriterien nicht mehr erfüllten.
Die wichtigsten demographischen Daten und Baseline-Charakteristika sind in Tabelle 8 unten gezeigt, und zwar für (1) alle Patienten, die in Studie 121 aufgenommen wurden, und (2) alle Patienten, die in Studie 121 eine Infusion von Casgevy erhielten.
Tabelle 8: Demographische Daten und Baseline-Charakteristika in Studie 121
Demographische Daten und Krankheitsmerkmale Casgevy aufgenommene Casgevy Patienten
Patienten (N=63) * mit Infusion (N=43)
†
Alter (Jahre), n (%)
Erwachsene (≥18 und ≤35 Jahre) 50 (79,4 %) 31 (72,1 %)
Jugendliche (≥12 und < 18 Jahre) 13 (20,6 %) 12 (27,9 %)
Alle Altersgruppen (≥12 und ≤35 Jahre)
Median (min., max.) 21 (12, 35) 20 (12, 34)
Geschlecht, n (%)
Männlich 36 (57,1 %) 24 (55,8 %)
Weiblich 27 (42,9 %) 19 (44,2 %)
Ethnie, n (%)
Dunkelhäutig oder afroamerikanisch 55 (87,3 %) 37 (86,0 %)
Weisshäutig 4 (6,3 %) 3 (7,0 %)
Sonstige 4 (6,3 %) 3 (7,0 %)
Genotyp, n (%) ‡
βS/βS 58 (92,1 %) 39 (90,7 %)
βS/β0 3 (4,8 %) 3 (7,0 %)
βS/β+ 2 (3,2 %) 1 (2,3 %)
Annualisierte Rate von schweren VOC in den 2 Jahren vor
Studieneintritt (Ereignisse/Jahr)
Median (min., max.) 3,5 (2,0; 19,0) 3,5 (2,0; 18,5)
Annualisierte Rate der Hospitalisierungen wegen
schwerer VOC in den 2 Jahren vor Studieneintritt
(Ereignisse/Jahr)
Median (min., max.) 2,5 (0,0; 11,0) 2,5 (0,5; 9,5)
Annualisierte Dauer der Krankenhausaufenthalte wegen
schwerer VOC in den 2 Jahren vor Studieneintritt
(Ereignisse/Jahr)
Median (min., max.) 15,5 (0,0; 136,5) 13,5 (2,0; 136,5)
Annualisierte Einheiten von Erythrozytentransfusionen
wegen SCD-bedingter Indikationen in den 2 Jahren vor
Studieneintritt (Ereignisse/Jahr)
Median (min., max.) 5,0 (0,0; 86,1) 5,0 (0,0; 86,1)
* N steht für die Gesamtzahl der aufgenommenen Patienten, die eine Einwilligungserklärung unterzeichneten.
† Die Zwischenanalyse wurde auf Basis des Datenschnitts April 2023 mit 43 Patienten durchgeführt, die Casgevy erhalten hatten, und 4 Patienten, denen eine Casgevy-Infusion bevorstand.
‡ Von Patienten mit anderen Genotypen liegen keine Daten vor.
Mobilisierung und Apherese
Die Patienten erhielten mindestens 8 Wochen vor dem geplanten Beginn der Mobilisierung einen Erythrozytenaustausch oder einfache Transfusionen und bis zum Beginn der myeloablativen Konditionierung weiterhin Transfusionen oder Erythrozytenaustausche. Die HbS-Werte wurden auf < 30 % des Gesamt-Hb-Werts eingestellt, während ein Gesamt-Hb-Wert von ≤11 g/dl aufrechterhalten wurde.
Zur Mobilisierung von Stammzellen für die Apherese wurde den Patienten in Studie 121 Plerixafor in einer geplanten Dosis von 0,24 mg/kg als subkutane Injektion etwa 2 bis 3 Stunden vor jeder geplanten Apherese gegeben. Die Patienten unterzogen sich an bis zu 3 aufeinanderfolgenden Tagen einer Apherese, um die angestrebte Zellentnahme für die Herstellung des Arzneimittels und für die unveränderten CD34+-Reservezellen zu erreichen. Der Median (min., max.) und der Mittelwert (SD) der Mobilisierungs- und Apheresezyklen, die für die Herstellung von Casgevy und für die Gewinnung von CD34+-Reservezellen erforderlich waren, betrugen 2 (1, 6) bzw. 2,21 (1,30).
Konditionierung zur Vorbehandlung
Alle Patienten erhielten vor der Behandlung mit Casgevy eine vollständige myeloablative Konditionierung mit Busulfan. Busulfan wurde an 4 aufeinanderfolgenden Tagen intravenös über einen zentralen Venenkatheter in einer geplanten Anfangsdosis von 3,2 mg/kg/Tag einmal täglich oder 0,8 mg/kg alle 6 Stunden verabreicht. Die Busulfan-Plasmaspiegel wurden durch serielle Blutentnahmen gemessen und die Dosis angepasst, um die Exposition im Zielbereich zu halten. Bei einmal täglicher Anwendung betrug die angestrebte kumulative Busulfan-Exposition über vier Tage 82 mg*h/l (Bereich: 74 bis 90 mg*h/l), entsprechend einer AUC0-24h von 5'000 μM*min (Bereich: 4'500 bis 5'500 μM*min). Bei einer Anwendung alle 6 Stunden betrug die angestrebte viertägige kumulative Busulfan-Exposition 74 mg*h/l (Bereich: 59 bis 89 mg*h/l), was einer AUC0-6h von 1'125 μM*min (Bereich: 900 bis 1'350 μM*min) entspricht.
Alle Patienten erhielten vor Beginn der Konditionierung mit Busulfan eine Prophylaxe gegen Krampfanfälle mit anderen Arzneimitteln als Phenytoin. Phenytoin wurde wegen seiner Induktion von Cytochrom P450 und der daraus resultierenden erhöhten Clearance von Busulfan nicht zur Prophylaxe von Krampfanfällen eingesetzt.
Eine Prophylaxe gegen die hepatische venookklusive Erkrankung (VOD)/das hepatische sinusoidale Obstruktionssyndrom wurde gemäss den regionalen und institutionellen Richtlinien durchgeführt.
Anwendung von Casgevy
Die Patienten erhielten Casgevy in einer medianen (min., max.) Dosis von 4,0 (2,9 - 14,4) × 106 CD34+-Zellen/kg als intravenöse Infusion. Allen Patienten wurde vor der Infusion von Casgevy ein Antihistaminikum und ein fiebersenkendes Arzneimittel gegeben.
Nach der Anwendung von Casgevy
G-CSF wurde in den ersten 21 Tagen nach der Infusion von Casgevy nicht empfohlen. Da es sich bei Casgevy um eine autologe Therapie handelt, waren nach der ersten myeloablativen Konditionierung keine immunsuppressiven Arzneimittel erforderlich.
Ergebnisse zur Wirksamkeit – Sichelzellkrankheit
Mit 29 Patienten, denen Casgevy verabreicht wurde und die für die primäre Wirksamkeitsanalyse geeignet waren, wurde eine Zwischenanalyse durchgeführt. Das primäre Wirksamkeitsset (PES) war definiert als alle Patienten, die nach der Infusion von Casgevy mindestens 16 Monate lang beobachtet worden waren. Zum Zeitpunkt der Zwischenanalyse waren 63 Patienten aufgenommen worden und 43 Patienten hatten Casgevy erhalten. Die mediane (min, max) Gesamtdauer der Nachbeobachtung betrug 17,5 Monate (1,2; 46,2) ab dem Zeitpunkt der Infusion von Casgevy.
Die Wirksamkeit von Casgevy wurde anhand der Auswertung von Patienten mit einer Nachbeobachtungsdauer von mindestens 16 Monaten bewertet. Der primäre Endpunkt war der Anteil von Patienten, die in den ersten 24 Monaten nach der Infusion von Casgevy in Studie 121 mindestens 12 Monate in Folge keine schweren VOC erlitten (VF12, primärer Wirksamkeitsendpunkt). Für diesen Endpunkt war eine schwere VOC definiert als entweder (a) ein akutes Schmerzereignis, das einen Besuch in einer medizinischen Einrichtung und die Verabreichung von Schmerzmitteln (Opioide oder intravenöse nichtsteroidale Entzündungshemmer [NSAR]) oder Erythrozytentransfusionen erforderte, (b) ein akutes Thoraxsyndrom, (c) Priapismus, der mehr als 2 Stunden andauerte und einen Besuch in einer medizinischen Einrichtung erforderte, oder (d) eine Milzsequestration. Der Anteil von Patienten, die in mindestens 12 aufeinanderfolgenden Monaten keinen Krankenhausaufenthalt wegen schwerer VOC benötigten (HF12, wichtiger sekundärer Endpunkt), wurde ebenfalls bewertet. Die Bewertung von VF12 und HF12 begann 60 Tage nach der letzten Erythrozytentransfusion als Unterstützung nach der Transplantation oder zur Behandlung von SCD.
Die Daten zur Wirksamkeit sind in Tabelle 9 und Tabelle 10 zusammengestellt. Tabelle 9 zeigt den primären Endpunkt für (1) alle Patienten, die in Studie 121 aufgenommen wurden, und (2) alle Patienten, die in Studie 121 eine Infusion von Casgevy erhielten. Tabelle 10 zeigt die sekundären Endpunkte von allen Patienten, die in Studie 121 eine Infusion von Casgevy erhielten.
Tabelle 9: Primärer Wirksamkeitsendpunkt bei Patienten mit SCD
Primärer Endpunkt Casgevy aufgenommene Casgevy Patienten mit
Patienten * (N=46) † Infusion * (N=29) ‡
Anteil von Patienten, die VF12
erreichen (%)§
n (%) 28 (60,9 %) 28 (96,6 %)
(95 %-KI) (45,4 %; 74,9 %) (82,2 %; 99,9 %)
* Die Zwischenanalyse wurde auf Basis des Datenschnitts April 2023 durchgeführt.
† N steht für die Gesamtzahl der aufgenommenen Patienten, die eine Einwilligungserklärung unterzeichneten, und schliesst Patienten aus, die zum Zeitpunkt der Analyse auf eine Behandlung mit Casgevy warteten, oder Patienten, die zwar behandelt wurden, aber für den primären Wirksamkeitsendpunkt noch nicht auswertbar waren.
‡ N steht für die Gesamtzahl der Patienten des primären Wirksamkeitssets (PES), einer Untergruppe des vollständigen Analysesets (FAS). Das PES war definiert als alle Patienten, die eine Infusion von Casgevy erhielten und nach der Casgevy-Infusion mindestens 16 Monate lang beobachtet wurden. Patienten, bei denen die Nachbeobachtungsdauer aufgrund von Tod oder Abbruch der Studie wegen Casgevy-bedingter unerwünschter Ereignisse kürzer als 16 Monate war oder die nach der Infusion von Casgevy länger als 12 Monate kontinuierlich Erythrozytentransfusionen erhielten, wurden ebenfalls in diese Gruppe eingeschlossen.
§ VF12 ist definiert als keine schweren VOC während mindestens 12 aufeinanderfolgenden Monaten nach der Casgevy-Infusion. Die Bewertung von VF12 beginnt 60 Tage nach der letzten Erythrozytentransfusion als Unterstützung nach einer Transplantation oder zur Behandlung von SCD.
Tabelle 10: Sekundäre Wirksamkeitsendpunkte bei Patienten mit SCD
Sekundäre Endpunkt Casgevy Patienten mit
Infusion * (N=29) †
Anteil von Patienten ohne Krankenhausaufenthalte wegen schwerer VOC
für mindestens 12 Monate (HF12) (%) ‡
n (%) 29 (100 %)
(95 %-KI) (88,1 %; 100,0 %)
Dauer des Zeitraums ohne schwere VOC bei Patienten, die VF12
erreichten (Monate)
n 28
Median (min., max.) 20,5 (13,5; 43,6)
Anteil von Patienten mit einem HbF-Wert ≥20 %, der mindestens12
Monate lang erhalten blieb (%) §
n 29
% (95 %-KI) 100 % (88,1 %; 100,0 %)
Gesamt-Hb (g/dl)
in Monat 6
n 27
Mittelwert (SD) 12,7 (1,7)
in Monat 24
n 15
Mittelwert (SD) 13,1 (1,9)
Anteil von HbF am Gesamt-Hb (%)
in Monat 6
n 27
Mittelwert (SD) 43,1 (6,0)
in Monat 24
n 15
Mittelwert (SD) 42,2 (5,5)
* Die Zwischenanalyse wurde auf Basis des Datenschnitts April 2023 durchgeführt.
† N steht für die Gesamtzahl von Patienten des primären Wirksamkeitssets (PES), einer Untergruppe des vollständigen Analysesets (FAS). Das PES war definiert als alle Patienten, die eine Infusion von Casgevy erhielten und nach der Casgevy-Infusion mindestens 16 Monate lang beobachtet wurden. Studienteilnehmer, bei denen die Nachbeobachtungsdauer aufgrund von Tod oder Abbruch der Studie wegen Casgevy-bedingter unerwünschter Ereignisse kürzer als 16 Monate war oder die nach der Infusion von Casgevy länger als 12 Monate kontinuierlich Erythrozytentransfusionen erhielten, wurden ebenfalls in diese Gruppe eingeschlossen.
‡ HF12 ist definiert als keine schweren VOC-bedingten stationären Krankenhausaufenthalte während mindestens 12 Monaten nach der Casgevy-Infusion. Die Bewertung von HF12 beginnt 60 Tage nach der letzten Erythrozytentransfusion als Unterstützung nach einer Transplantation oder zur Behandlung von SCD.
§ Der gleiche Anteil von Patienten erreichte einen HbF-Wert ≥ 20 %, der mindestens 3 oder 6 Monate erhalten blieb.
Abbildung 2 zeigt die Gesamt-Hb- (g/dl) und HbF-Werte (g/dl) im Zeitverlauf für alle Patienten, die Casgevy zur Behandlung der Sichelzellkrankheit erhielten.
Abbildung 2: Mittlere Gesamt-Hb- und HbF-Spiegel (g/dl) im Zeitverlauf bei Patienten mit SCD
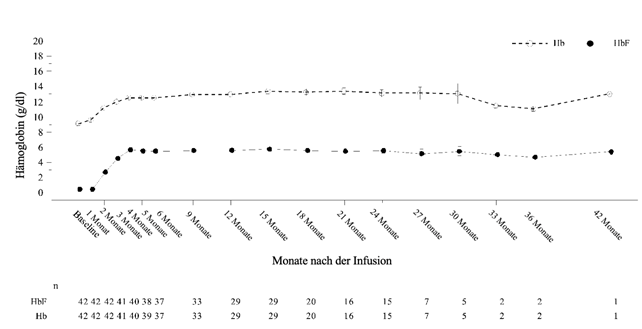
Die Mittelwerte sind in der Linie dargestellt, und die +SE-Werte und -SE-Werte der Mittelwerte sind als Balken bei jedem Besuch dargestellt. Die Anzahl von Patienten mit verfügbaren Werten bei den entsprechenden Besuchen ist unter der Abbildung angegeben.
Bereits im 3. Monat nach der Infusion von Casgevy wurde ein Anstieg des mittleren (SD) Gesamt-Hb-Spiegels beobachtet, der bis zum 6. Monat weiter auf 12,5 (1,8) g/dl anstieg und danach erhalten blieb.
Der mittlere (SD) Anteil von HbF am Hb betrug 43,2 % (7,6 %) im 6. Monat und blieb danach erhalten.
In Übereinstimmung mit dem Anstieg der HbF-Werte lag der mittlere (SD) Anteil der zirkulierenden Erythrozyten, die HbF exprimieren (F-Zellen), bei allen behandelten Patienten im 3. Monat bei 70,4 % (14,0 %) und stieg im Laufe der Zeit bis auf 93,9 % (12,6 %) im 6. Monat an, wobei die Werte danach stabil blieben, was auf eine anhaltende panzelluläre Expression von HbF hinweist.
Subgruppenanalysen, in denen die Auswirkungen auf VOC-bezogene Endpunkte und hämatologische Parameter in den Subgruppen Alter, Geschlecht, Ethnie oder Genotyp untersucht wurden, ergaben keine Unterschiede aufgrund dieser Faktoren.
PharmakokinetikCasgevy ist ein autologes Zelltherapeutikum, das aus CD34+-Zellen besteht, die ex vivo mittels CRISPR/Cas9 editiert wurden. Casgevy ist so beschaffen, dass herkömmliche Studien zur Pharmakokinetik, Resorption, Distribution, Metabolisierung und Elimination nicht anwendbar sind.
Präklinische DatenCasgevy ist ein Produkt aus CD34+-Zellen, das mit der CRISPR/Cas9-Technologie editiert wurde. Daher wurden keine konventionellen Studien zur Mutagenität, Karzinogenität, Fertilität, Reproduktions- und Entwicklungstoxizität durchgeführt.
Die toxikologischen Eigenschaften wurden an subletal bestrahlten, immungeschwächten NSG-Mäusen untersucht, die mit einer Dosis von 3,33 × 107 editierten CD34+-Zellen/kg Körpergewicht behandelt wurden. Es gab keine Hinweise auf Zielorgan-Toxizität oder Tumorigenität in der 20-wöchigen Studie.
Während der präklinischen Entwicklung wurde das Potenzial für Off-Target-Editing an über 5000 Stellen untersucht, darunter auch an solchen, die auf der Grundlage genetischer Variationen beim Menschen ausgewählt wurden. Bei editierten CD34+-Zellen von gesunden Spendern und Patienten wurde kein Off-Target-Editing beobachtet. In einer nicht-klinischen Studie nach der Markteinführung (Studie U270) wurden 33 weitere mögliche Stellen für Off-Target-Editing untersucht, die auf der Grundlage genetischer Variationen ausgewählt wurden. An 32 dieser Stellen wurde in editierten CD34+-Zellen von Patienten kein Off-Target-Editing festgestellt. An einer Stelle kam es zu einem Off-Target-Editing aufgrund einer Minor-Allel-Variante, die in 3 von 91 Patientenproben (3,3 %) vorhanden war. Das Off-Target-Editing wurde bei einem geringen Anteil von Allelen (≤1 %) beobachtet und umfasste eine ausgeglichene Inversion (< 0,25 %). Diese Variante führt zu einem kanonischen TGG-PAM (Protospacer-angrenzenden Motiv) in der intronischen Region des Gens, das für Carbamoylphosphat-Synthetase 1 (CPS1) kodiert. Es ist nicht zu erwarten, dass das Gen-Editing in diesem Minor-Allel negative Auswirkungen bei den Patienten hat, da die Off-Target-Stelle innerhalb eines Introns liegt und CPS1 in blutbildenden Zellen nicht exprimiert wird.
Sonstige HinweiseInkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit "EXP" bezeichneten Datum verwendet werden.
Haltbarkeit nach dem Auftauen
20 Minuten bei Raumtemperatur (20 °C – 25 °C).
Besondere Lagerungshinweise
Casgevy ist in der Dampfphase von flüssigem Stickstoff bei ≤ -135 °C zu lagern und zu transportieren und muss im gefrorenen Zustand bleiben, bis der Patient für die Behandlung bereit ist, um sicherzustellen, dass lebensfähige Zellen für die Gabe an den Patienten zur Verfügung stehen.
Aufgetautes Arzneimittel darf nicht wieder eingefroren werden.
Aufbewahrungsbedingungen nach Auftauen des Arzneimittels, siehe Abschnitt "Haltbarkeit nach dem Auftauen" .
In der Originalverpackung aufbewahren.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Vorsichtsmassnahmen vor der Handhabung bzw. vor der Anwendung des Arzneimittels
Es dürfen dem Arzneimittel keine Proben entnommen werden, das Arzneimittel darf nicht verändert oder bestrahlt werden. Eine Bestrahlung könnte zur Inaktivierung des Arzneimittels führen.
Dieses Arzneimittel enthält menschliche Blutzellen. Angehörige der Gesundheitsberufe müssen daher bei der Handhabung von Casgevy angemessene Vorsichtsmassnahmen treffen (Schutzhandschuhe, Schutzkleidung und Augenschutz tragen), um eine mögliche Übertragung von Infektionskrankheiten zu vermeiden.
Empfang und Lagerung von Casgevy
-Casgevy wird in gefrorenem Zustand in der Dampfphase von flüssigem Stickstoff in das Behandlungszentrum transportiert.
-Die Angaben zum Patienten auf dem/den Produktetikett(en) und auf dem Chargeninformationsblatt (LIS) müssen bestätigt werden.
-Bis zum Auftauen und zur Anwendung in der Dampfphase von flüssigem Stickstoff bei ≤ -135 °C lagern.
Vorbereitungen vor der Anwendung
Vorbereitung der Infusion
-Der Zeitpunkt des Auftauens von Casgevy ist mit der Infusion zu koordinieren. Die Infusionszeit wird im Voraus bestätigt, um den Zeitpunkt des Beginns des Auftauens so anzupassen, dass Casgevy zur Infusion zur Verfügung steht, wenn der Patient bereit ist. Casgevy muss innerhalb von 20 Minuten nach dem Auftauen der Durchstechflasche verabreicht werden. Den Inhalt jeweils einer Durchstechflasche auftauen und infundieren.
-Vor dem Auftauen bestätigen, dass die Identität des Patienten mit den Patientenangaben auf der/den Casgevy-Durchstechflasche(n) übereinstimmt. Nehmen Sie die Durchstechflaschen mit Casgevy nicht aus der Kryokonservierung, wenn die patientenspezifischen Angaben auf dem Etikett nicht mit dem vorgesehenen Patienten übereinstimmen.
-Eine Dosis Casgevy kann in einer oder mehreren kryokonservierten patientenspezifischen Durchstechflaschen enthalten sein. Die Vollständigkeit der Durchstechflaschen ist zu kontrollieren und anhand des beiliegenden Chargeninformationsblatts (LIS) ist zu bestätigen, dass das Verfallsdatum jeder Durchstechflasche noch gültig ist.
-Die Durchstechflasche(n) ist/sind vor dem Auftauen auf Brüche oder Risse zu überprüfen. Wenn eine Durchstechflasche beschädigt ist, darf der Inhalt nicht infundiert werden.
-Das zum Auftauen und Entnehmen des Arzneimittels aus der/den Durchstechflasche(n) benötigte Material zusammenstellen. Mit Ausnahme des Wasserbads handelt es sich dabei um Einwegartikel. Es ist ausreichend Material für jede zu verabreichende Durchstechflasche bereitzustellen:
-Wasserbad
-Alkoholtupfer
-Flaschenadapter (für die nadellose Extraktion)
-18 Mikron-Edelstahlfilter
-30 ml-Luer-Lock-Spritze
-Natriumchlorid-Injektionslösung 9 mg/ml (0,9 %) (für jede Durchstechflasche sind 5 bis 10 ml erforderlich)
-10 ml-Luer-Lock-Spritze für die Spülung mit Natriumchlorid-Injektionslösung 9 mg/ml (0,9 %)
Auftauen der Durchstechflaschen mit Casgevy
-Wenn die Dosis aus mehreren Durchstechflaschen besteht, ist jeweils eine Durchstechflasche aufzutauen und zu verabreichen. Während eine Durchstechflasche aufgetaut wird, müssen die übrigen Durchstechflaschen bei ≤ -135 °C kryokonserviert bleiben.
-Tauen Sie jede Durchstechflasche bei 37 °C in einem Wasserbad auf. Es ist sicherzustellen, dass die Temperatur des Wasserbads 40 °C nicht überschreitet.
-Halten Sie jede Durchstechflasche am Hals fest und schütteln Sie sie zum Auftauen vorsichtig im und gegen den Uhrzeigersinn. Dies kann zwischen 10 und 15 Minuten dauern.
-Lassen Sie die Durchstechflasche während des Auftauens nicht unbeaufsichtigt.
-Das Auftauen ist abgeschlossen, wenn keine Eiskristalle mehr in der Durchstechflasche sichtbar sind.
-Nehmen Sie die Durchstechflasche nach dem Auftauen sofort aus dem Wasserbad.
-Das aufgetaute Arzneimittel sollte eine durchscheinende Zelldispersion sein, die keine Fremdpartikel enthält.
-Infundieren Sie das Arzneimittel innerhalb von 20 Minuten nach dem Auftauen.
-Aufgetautes Arzneimittel darf nicht wieder eingefroren werden.
Anwendung von Casgevy
Casgevy ist ausschliesslich für die autologe Anwendung bestimmt. Die Identität des Patienten muss mit den Patientenangaben auf der/den Casgevy-Durchstechflasche(n) übereinstimmen. Infundieren Sie Casgevy nicht, wenn die Angaben auf dem patientenspezifischen Etikett nicht mit dem vorgesehenen Patienten übereinstimmen.
Die Dosis für einen Patienten kann aus mehreren Durchstechflaschen bestehen. Alle Durchstechflaschen müssen verabreicht werden. Das gesamte Volumen jeder bereitgestellten Durchstechflasche muss infundiert werden. Wenn mehr als eine Durchstechflasche bereitgestellt wird, muss jede Durchstechflasche vollständig verabreicht werden, bevor die nächste Durchstechflasche aufgetaut und infundiert wird.
Befestigen des Adapters und Filters an der Durchstechflasche
-Entfernen Sie die Klapplasche des Verschlusses der Durchstechflasche; reinigen Sie das Septum mit einem Alkoholtupfer.
-Entfernen Sie die Kappe des Adapterstifts.
-Drücken Sie den Adapter mit Daumen und Zeigefinger beider Hände mit gleichmässigem Druck in das Septum der Durchstechflasche, bis Sie ein einzelnes Knacken hören.
-Ziehen Sie den Adapter nach oben, bis Sie spüren, dass er einrastet.
-Befestigen Sie den Filter am Adapter der Durchstechflasche.
Entnahme von Casgevy aus der Durchstechflasche
-Stecken Sie eine leere 30-ml-Spritze auf den Filter.
-Ziehen Sie das gesamte Volumen der Durchstechflasche auf.
-Entfernen Sie die mit dem Arzneimittel gefüllte Spritze vom Filter und legen Sie sie beiseite.
-Ziehen Sie 5 – 10 ml Natriumchlorid-Injektionslösung 9 mg/ml (0,9 %) in die leere 10 ml-Spritze auf.
-Stecken Sie die mit Natriumchloridlösung gefüllte Spritze auf den Filter.
-Spritzen Sie die Natriumchloridlösung in die Durchstechflasche mit Casgevy und entfernen Sie die leere Spritze vom Filter. Entsorgen Sie die leere Spritze.
-Stecken Sie die mit dem Arzneimittel gefüllte Spritze auf den Filter.
-Ziehen Sie den Inhalt der Durchstechflasche in die Arzneimittelspritze auf und entfernen Sie dann die Spritze vom Filter.
-Das optionale Etikett mit den Produkt-/Patientenangaben kann vom Chargeninformationsblatt (LIS) abgezogen und auf die Spritze aufgeklebt werden.
Verabreichung von Casgevy durch einen zentralen Venenkatheter
-Casgevy muss innerhalb von 20 Minuten nach dem Auftauen verabreicht werden.
-Bestätigen und überprüfen Sie die Identität des Patienten am Krankenbett mit zwei Personen vor der Infusion jeder Durchstechflasche.
-Casgevy wird als intravenöser Bolus (intravenöse Druckinjektion) verabreicht.
-Die innerhalb einer Stunde verabreichte Gesamtmenge von Casgevy darf 2,6 ml/kg nicht überschreiten.
-Bei der Infusion von Casgevy darf kein Inline-Filter verwendet werden.
-Nach der Verabreichung jeder Durchstechflasche Casgevy die Hauptleitung mit Natriumchlorid-Injektionslösung 9 mg/ml (0,9 %) spülen.
Wiederholen Sie die oben genannten Schritte für jede verbleibende Durchstechflasche.
Nach der Verabreichung von Casgevy
-Überwachen Sie die Vitalparameter alle 30 Minuten ab der Infusion der ersten Durchstechflasche von Casgevy bis 2 Stunden nach der Infusion der letzten Durchstechflasche von Casgevy.
-Nach der Infusion von Casgevy sind die Standardverfahren für das Patientenmanagement nach einer HSZ-Transplantation zu befolgen.
-Blutprodukte, die in den ersten 3 Monaten nach der Infusion von Casgevy benötigt werden, müssen bestrahlt werden.
-Die Patienten dürfen zukünftig keinesfalls Blut, Organe, Gewebe oder Zellen spenden.
Im Falle einer versehentlichen Exposition zu ergreifende Massnahmen
Im Falle einer versehentlichen Exposition sind die vor Ort geltenden Richtlinien für den Umgang mit Material menschlicher Herkunft zu befolgen. Arbeitsflächen und Materialien, die möglicherweise mit Casgevy in Kontakt gekommen sind, müssen mit einem geeigneten Desinfektionsmittel dekontaminiert werden.
Vorsichtsmassnahmen für die Beseitigung des Arzneimittels
Nicht verwendetes Arzneimittel und sämtliches Material, das mit Casgevy in Kontakt gekommen ist (feste und flüssige Abfälle), sind gemäss den vor Ort geltenden Richtlinien für den Umgang mit Material menschlicher Herkunft als potenziell infektiöser Abfall zu behandeln und zu entsorgen.
Zulassungsnummer68978 (Swissmedic).
PackungenCasgevy wird in kryokonservierten Durchstechflaschen aus zyklischem Olefin-Copolymer geliefert. Jede Durchstechflasche enthält 1,5 ml bis 20 ml Casgevy.
Die Durchstechflaschen sind in einem Pappkarton verpackt. Ein Karton kann bis zu 9 Durchstechflaschen enthalten. Der endgültige Umkarton enthält eine unterschiedliche Anzahl von Durchstechflaschen entsprechend der erforderlichen patientenspezifischen Dosis.
Casgevy wird in einem Kryotransportbehälter vom Ort der Herstellung zum Lager der Behandlungseinrichtung transportiert. Ein Kryotransportbehälter kann mehrere Kartons enthalten, die wiederum mehrere Durchstechflasche enthalten können, die alle für einen einzigen Patienten bestimmt sind.
[A]
ZulassungsinhaberinVertex Pharmaceuticals (CH) GmbH
6300 Zug
Stand der InformationSeptember 2025
|


