CompositionPrincipes actifs
Composant 1: fibrinogène humain.
Composant 2: thrombine humaine.
Les principes actifs sont produits à partir de plasma de donneurs humains.
Excipients
Composant 1: citrate de sodium dihydraté, chlorure de sodium, arginine, isoleucine, glutamate monosodique monohydraté et eau pour préparations injectables.
Composant 2: chlorure de calcium dihydraté, albumine humaine, chlorure de sodium, glycine et eau pour préparations injectables.
Indications/Possibilités d’emploiVeraSeal est indiqué pour le traitement adjuvant chez des patients lorsque les techniques chirurgicales standards sont insuffisantes:
·pour l'amélioration de l'hémostase;
·pour le renforcement de suture en chirurgie vasculaire.
VeraSeal est efficace chez les patients sous héparine.
VeraSeal est indiqué dans toutes les groupes d'âge.
Posologie/Mode d’emploiVeraSeal ne doit être utilisé que par des chirurgiens expérimentés, ayant été formés à l'utilisation de ce médicament.
Posologie
Le volume à utiliser et la fréquence d'utilisation de VeraSeal doivent toujours être adaptés aux besoins cliniques du patient.
La dose à appliquer dépend entre autres de facteurs tels que le type d'intervention chirurgicale, la taille de la surface à traiter, le mode d'utilisation prévu et le nombre d'utilisations.
L'application du produit doit être définie individuellement par le médecin traitant. Au cours des essais cliniques, des doses unitaires comprises entre 0,3 et 12 ml ont généralement été utilisées. De plus grandes quantités peuvent être nécessaires pour d'autres interventions.
Le volume initial de produit à appliquer sur un site anatomique donné ou une surface à traiter doit être suffisant pour couvrir entièrement le site d'application prévu d'une couche mince (de 1 mm d'épaisseur). L'application peut être répétée au besoin.
Enfants et adolescents
La sécurité et l'efficacité de VeraSeal chez les enfants et les adolescents âgés de 0 à 18 ans ont été évaluées dans un essai clinique. Les données actuellement disponibles sont décrites aux rubriques «Propriétés/Effets», «Pédiatrie». L'utilisation du produit doit être adaptée au cas par cas par le chirurgien traitant. Dans l'essai clinique auprès d'enfants et d'adolescents, les doses individuelles varient entre 0,6 ml et 12 ml.
Mode d'administration
Voie épilésionnelle.
Pour les précisions concernant la préparation du médicament avant l'application, voir la rubrique «Remarques concernant la manipulation». Le produit doit être administré conformément aux instructions et ne doit être appliqué qu'avec les dispositifs recommandés pour ce produit.
Avant d'appliquer VeraSeal, il convient d'utiliser les techniques standards pour sécher la surface de la plaie (p.ex. application intermittente de compresses, de tampons, utilisation de dispositifs d'aspiration).
Le tableau 1 présente les surfaces approximatives pouvant être couvertes par les différentes présentations de VeraSeal.
Tableau 1. Surface couverte
|
Présentation de VeraSeal
|
Surface couverte (cm2)
Application en goutte à goutte ou par pulvérisation
(épaisseur de la couche de 1 mm)
| |
2 ml
|
16–22
| |
4 ml
|
32–44
| |
6 ml
|
48–66
| |
10 ml
|
80–110
|
Pour l'application par pulvérisation, des recommandations spécifiques concernant la distance nécessaire par rapport au tissu en fonction du type d'intervention figurent aux rubriques «Mises en garde et précautions» et «Remarques concernant la manipulation».
Contre-indicationsVeraSeal ne doit pas être utilisé par voie intravasculaire.
Hypersensibilité aux principes actifs ou à l'un des excipients mentionnés.
VeraSeal ne doit pas être utilisé pour traiter des hémorragies artérielles massives et importantes.
Mises en garde et précautionsPrécautions d'emploi
Pour application épilésionnelle uniquement. Ne pas utiliser par voie intravasculaire.
L'administration intravasculaire involontaire du produit peut entraîner des complications thromboemboliques engageant le pronostic vital et une coagulation intravasculaire disséminée [CIVD] (voir rubrique «Effets indésirables»).
VeraSeal ne doit être appliqué par pulvérisation que s'il est possible d'évaluer exactement la distance de pulvérisation, en particulier pendant une laparoscopie. La distance de pulvérisation avec le tissu doit se situer dans l'intervalle recommandé par le titulaire de l'autorisation de VeraSeal (voir rubrique «Remarques concernant la manipulation»).
Lors de l'utilisation d'embouts accessoires avec ce produit, le mode d'emploi des embouts doit être suivi.
Avant l'application de VeraSeal, il convient de veiller à ce que les parties du corps situées en dehors de la zone d'application souhaitée soient suffisamment protégées (couvertes) pour prévenir une adhérence de tissus sur des sites non souhaités.
VeraSeal doit être appliqué en couche mince (de 1 mm d'épaisseur). Une couche trop épaisse peut avoir un impact défavorable sur l'efficacité du produit et le processus de cicatrisation.
Il n'existe pas de données suffisantes concernant l'utilisation de ce produit en tant que colle tissulaire, en neurochirurgie, pour l'application à travers un endoscope flexible pour traiter des saignements ou dans les anastomoses gastro-intestinales.
Réactions d'hypersensibilité
Comme avec tout produit protéique, des réactions d'hypersensibilité de type allergique sont possibles. Les signes d'une hypersensibilité peuvent être une urticaire, une urticaire généralisée, une sensation d'oppression thoracique, des sibilances, une hypotension et une anaphylaxie. Aux premiers signes de ces symptômes, l'administration doit être arrêtée immédiatement. En cas de choc, le traitement médical habituel d'un choc doit être mis en œuvre.
Agents pathogènes transmissibles
Les mesures standards pour la prévention des infections causées par l'utilisation de médicaments préparés à partir de sang ou de plasma humain comprennent la sélection des donneurs, le dépistage de marqueurs spécifiques d'infection dans les dons de sang individuels et les pools de plasma et la mise en œuvre d'étapes efficaces d'inactivation/d'élimination virale durant la fabrication. Malgré ces mesures, la possibilité de transmission d'agents infectieux ne peut être totalement exclue lors de l'utilisation de médicaments préparés à partir de sang ou de plasma humain. Cela s'applique également aux virus inconnus ou émergents et autres agents pathogènes.
Les mesures prises sont considérées comme efficaces vis-à-vis des virus enveloppés tels que le virus de l'immunodéficience humaine (VIH), le virus de l'hépatite B, le virus de l'hépatite C et vis-à-vis du virus non enveloppé de l'hépatite A. Les mesures prises peuvent être d'une efficacité limitée vis-à-vis de virus non enveloppés tels que le parvovirus B19. Les infections par le parvovirus B19 peuvent avoir des conséquences sévères chez les femmes enceintes (infection fœtale) et chez les personnes présentant une immunodéficience ou une augmentation de l'érythropoïèse (p.ex. anémie hémolytique).
Traçabilité
Afin d'assurer la traçabilité des médicaments biotechnologiques, il convient de documenter pour chaque traitement le nom commercial et le numéro de lot.
InteractionsAucune étude formelle n'a été effectuée pour évaluer les interactions. Comme les produits similaires ou les solutions de thrombine, ce produit peut être dénaturé au contact de solutions contenant de l'alcool, de l'iode ou des métaux lourds (p.ex. solutions antiseptiques). De telles substances doivent être éliminées autant que possible avant l'application du produit.
Grossesse, allaitementGrossesse
L'innocuité des colles de fibrine/hémostatiques pendant la grossesse n'a pas été étudiée au cours d'études cliniques contrôlées. Les études effectuées chez l'animal sont insuffisantes pour évaluer la sécurité en ce qui concerne la reproduction, le développement embryonnaire et fœtal, le déroulement de la grossesse ainsi que le développement périnatal et postnatal. Par conséquent, ce produit ne doit être administré chez les femmes enceintes qu'en cas de nécessité absolue.
Allaitement
L'innocuité des colles de fibrine/hémostatiques pendant l'allaitement n'a pas été étudiée au cours d'études cliniques contrôlées. Par conséquent, ce produit ne doit être administré chez les femmes qui allaitent qu'en cas de nécessité absolue.
Fertilité
Aucune étude de fertilité n'a été réalisée.
Effet sur l’aptitude à la conduite et l’utilisation de machinesNon pertinent.
Effets indésirablesRésumé du profil de sécurité
Des réactions allergiques ou d'hypersensibilité (p.ex. angio-œdème, sensation de brûlure et picotements au site d'application, bronchospasme, frissons, bouffées congestives, urticaire généralisée, céphalées, urticaire, hypotension, léthargie, nausées, agitation, tachycardie, sensation d'oppression thoracique, fourmillements, vomissements et sibilances) peuvent survenir dans de rares cas chez les patients traités par des colles de fibrine/hémostatiques. Dans des cas isolés, ces réactions ont conduit à un choc anaphylactique. De telles réactions peuvent survenir en particulier en cas d'application répétée ou chez des patients présentant une hypersensibilité connue à l'un des composants du produit.
La formation d'anticorps dirigés contre les composants des colles de fibrine/hémostatiques peut être observée dans de rares cas.
L'injection intravasculaire accidentelle peut entraîner des événements thromboemboliques et une coagulation intravasculaire disséminée. Il existe en outre un risque de réaction anaphylactique (voir rubrique «Mises en garde et précautions»).
Pour la sécurité vis-à-vis des agents pathogènes transmissibles, voir la rubrique «Mises en garde et précautions».
Tableau synoptique des effets indésirables
Dans le tableau ci-dessous, les effets indésirables sont présentés selon les classes de systèmes d'organes et les termes préférentiels de la base de données MedDRA.
Les indications de fréquence des effets indésirables reposent sur les catégories suivantes:
·très fréquent (≥1/10)
·fréquent (≥1/100 à <1/10)
·occasionnel (≥1/1000 à <1/100)
·rare (≥1/10 000 à <1/1000)
·très rare (<1/10 000)
·fréquence inconnue (ne peut être estimée sur la base des données disponibles)
Dans chaque groupe de fréquence, les effets indésirables sont présentés par ordre décroissant de gravité.
Fréquence des effets indésirables (EI) observés dans les études cliniques réalisées avec VeraSeal:
|
Classe de système d'organes MedDRA (SOC)
|
Effets indésirables
|
Fréquence
| |
Infections et infestations
|
Abcès abdominal, cellulite, abcès hépatique, péritonite, infection de plaie postopératoire, infection de plaie, infection au site d'incision, infection postopératoire
|
Occasionnel
| |
Tumeurs bénignes, malignes et non précisées (incl kystes et polypes)
|
Myélome multiple
|
Occasionnel
| |
Affections hématologiques et du système lymphatique
|
Anémie, anémie hémorragique, leucocytose, leucopénie
|
Occasionnel
| |
Affections du système immunitaire
|
Hypersensibilité*
|
Fréquence inconnue
| |
Troubles du métabolisme et de la nutrition
|
Hyperglycémie, hyperkaliémie, hypocalcémie, hypoglycémie, hypokaliémie, hypomagnésémie, hyponatrémie, hypoprotéinémie
|
Occasionnel
| |
Affections psychiatriques
|
Anxiété, insomnie
|
Occasionnel
| |
Affections du système nerveux
|
Céphalées, somnolence
|
Occasionnel
| |
Affections oculaires
|
Irritation conjonctivale
|
Occasionnel
| |
Affections cardiaques
|
Fibrillation auriculaire, tachycardie ventriculaire
|
Occasionnel
| |
Affections vasculaires
|
Thrombose veineuse profonde de la jambe, hypertension, hypotension
|
Occasionnel
| |
Affections respiratoires, thoraciques et médiastinales
|
Embolie pulmonaire, dyspnée, hypoxie, épanchement pleural, pleurésie, œdème pulmonaire, ronchi, sibilances
|
Occasionnel
| |
Affections gastro-intestinales
|
Nausées
|
Fréquent
| |
Constipation, flatulences, iléus, hématome rétropéritonéal, vomissements
|
Occasionnel
| |
Affections de la peau et du tissu sous-cutané
|
Prurit
|
Fréquent
| |
Ecchymose, érythème
|
Occasionnel
| |
Affections musculosquelettiques et du tissu conjonctif
|
Dorsalgies, douleurs des extrémités
|
Occasionnel
| |
Affections du rein et des voies urinaires
|
Spasme vésical, dysurie, rétention urinaire
|
Occasionnel
| |
Troubles généraux et anomalies au site d'administration
|
Frissons, hyperthermie, œdème périphérique, douleur, fièvre, hématome au site de ponction vasculaire
|
Occasionnel
| |
Investigations
|
Test positif du parvovirus B19, allongement du temps de céphaline activée, augmentation de l'alanine aminotransférase, augmentation de l'aspartate aminotransférase, augmentation de la concentration de bilirubine dans le sang, augmentation de la concentration de glucose sanguin, augmentation de l'INR, allongement du temps de Quick, augmentation des transaminases, oligurie
|
Occasionnel
| |
Présence d'anticorps spécifiques au médicament*
|
Fréquence inconnue
| |
Lésions, intoxications et complications d'interventions
|
Douleur peropératoire
|
Fréquent
| |
Déhiscence d'une plaie abdominale, fuite biliaire postopératoire, contusion, érythème au site d'incision, douleur au site d'incision, saignements postopératoires, hypotension peropératoire, complication liée au greffon vasculaire, thrombose du greffon vasculaire, suintement de plaie
|
Occasionnel
| |
*Toutes ces réactions sont des effets de classe. Aucune d'entre elles n'ayant été rapportée dans les études cliniques, les fréquences ne peuvent pas être déterminées.
|
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageN'appliquer que la quantité minimale nécessaire de VeraSeal pour obtenir l'hémostase, pour prévenir la formation excédentaire de tissu de granulation et garantir la résorption progressive de la colle de fibrine solidifiée. Une couche trop épaisse peut avoir un impact défavorable sur le processus de cicatrisation (voir rubrique «Mises en garde et précautions», «Précautions d'emploi»).
Propriétés/EffetsCode ATC
B02BC
Mécanisme d'action/Pharmacodynamique
Le système d'adhésion de la fibrine déclenche la dernière phase de la coagulation sanguine physiologique. La transformation du fibrinogène en fibrine s'effectue par clivage du fibrinogène en monomères de fibrine et en fibrinopeptides. Les monomères de fibrine s'agrègent et forment un caillot de fibrine. Le facteur XIIIa, formé par activation du facteur XIII par la thrombine, provoque la réticulation de la fibrine. Des ions calcium sont nécessaires tant pour la transformation du fibrinogène que pour la réticulation de la fibrine.
Au fur et à mesure de la cicatrisation de la plaie, la plasmine induit une augmentation de l'activité fibrinolytique et la décomposition de la fibrine en ses produits de dégradation.
Efficacité clinique
Trois études cliniques randomisées, en simple aveugle, visant à démontrer l'hémostase et le renforcement de suture en chirurgie vasculaire ont été menées avec VeraSeal chez des patients subissant une intervention de chirurgie vasculaire, ou de chirurgie des tissus parenchymateux ou des tissus mous. Chacune de ces trois études a été menée dans un type de chirurgie spécifique et les patients inclus étaient principalement des adultes.
Dans les trois études, le critère d'évaluation principal de l'efficacité était la proportion de patients obtenant l'hémostase au niveau du site de saignement cible en l'espace de 4 minutes après l'application du médicament (T4), sans nouveau saignement jusqu'à la fin de la fermeture chirurgicale pendant une durée d'observation de 10 minutes. L'application répétée du médicament était autorisée pendant les 4 premières minutes de l'évaluation de l'hémostase. Ultérieurement, la persistance et la réapparition de saignements étaient considérées comme un échec thérapeutique.
L'étude menée en chirurgie vasculaire a inclus 225 patients ayant subi une intervention chirurgicale vasculaire avec pose de greffon en polytétrafluoroéthylène sur une anastomose artérielle latéro-terminale ou sur une anastomose artérielle avec abord vasculaire au niveau d'un membre supérieur. L'âge moyen (écart-type) de la population de l'étude était de 63,2 (9,5) ans. Les types de chirurgie les plus fréquents étaient le pontage fémoro-poplité, la création d'un abord vasculaire d'hémodialyse sur les membres supérieurs et le pontage ilio-fémoral. VeraSeal s'est avéré supérieur au groupe témoin (compression manuelle) pour obtenir l'hémostase en 4 minutes. La proportion de patients ayant obtenu l'hémostase en 4 minutes au niveau du site de saignement cible était de 76,1 % dans le groupe traité par VeraSeal, et de 22,8 % dans le groupe témoin.
L'étude menée en chirurgie vasculaire des tissus parenchymateux a inclus 325 patients ayant subi des résections hépatiques. L'âge moyen (écart-type) de la population de l'étude était de 57,9 (14,5) ans VeraSeal s'est avéré supérieur au groupe témoin (cellulose régénérée oxydée) pour obtenir l'hémostase en 4 minutes. La proportion de patients ayant obtenu l'hémostase en 4 minutes au niveau du site de saignement cible était de 92,8 % dans le groupe traité par VeraSeal, et de 80,5 % dans le groupe témoin.
L'étude menée en chirurgie des tissus mous a inclus 327 patients ayant subi une intervention chirurgicale pelvienne ou rétropéritonéale, une abdominoplastie ou une mastopexie. L'âge moyen (écart-type) de la population de l'étude était de 47,2 (18,4) ans. Les types de chirurgie les plus fréquents étaient l'hystérectomie simple ou radicale, l'abdominoplastie et la cystectomie radicale. VeraSeal s'est avéré non inférieur au groupe témoin (cellulose régénérée oxydée) pour obtenir l'hémostase en 4 minutes. La proportion de patients ayant obtenu une hémostase en 4 minutes au niveau du site de saignement cible était de 82,8 % dans le groupe traité par VeraSeal, et de 77,8 % dans le groupe témoin.
Pédiatrie
Une étude clinique randomisée, en simple aveugle, contrôlée contre comparateur actif, a été menée chez des enfants et des adolescents pour évaluer la sécurité et l'efficacité de VeraSeal en traitement adjuvant de l'hémostase lors d'une chirurgie ouverte de résection hépatique ou d'une chirurgie des tissus mous. Au total, 178 enfants et adolescents (âgés de moins de 18 ans) ont été randomisés et traités par VeraSeal (n = 91) ou par le comparateur actif (n = 87). Sur les 91 patients traités par VeraSeal, 4 étaient âgés de 27 jours ou moins, 19 étaient âgés de 28 jours à 23 mois, 32 de 2 ans à 11 ans, 36 de 12 ans à 17 ans. Chez les enfants et adolescents traités par VeraSeal, le type de chirurgie était une résection hépatique chez 46 patients et une chirurgie des tissus mous chez 45 patients. La non-infériorité de VeraSeal par rapport au comparateur (EVICEL [colle de fibrine]) a été montrée pour ce qui concerne l'obtention d'une hémostase en 4 minutes. La proportion de patients ayant atteint l'hémostase au niveau du site de saignement cible au bout de 4 minutes était de 96,7 % (88 patients sur 91) dans le groupe de traitement par VeraSeal et de 95,4 % (83 patients sur 87) dans le groupe témoin.
De plus, dans les trois études cliniques décrites ci-dessus, au cours desquelles VeraSeal a été utilisé principalement chez des adultes dans des types de chirurgie spécifiques, 11 patients pédiatriques ont aussi été traités. Parmi ces 11 patients, 5 enfants avaient moins de 2 ans, 5 enfants étaient âgés de 2 à 11 ans, et 1 adolescent était âgé de 15 ans. Seul l'adolescent a été pris en compte dans l'évaluation de l'efficacité.
PharmacocinétiqueAbsorption
Non pertinent.
Distribution
Non pertinent.
Métabolisme
Non pertinent.
Élimination
Non pertinent.
VeraSeal est exclusivement destiné à une application épilésionnelle. L'administration intravasculaire est contre-indiquée. Par conséquent, aucune étude pharmacocinétique par voie intravasculaire n'a été réalisée chez l'être humain.
Les colles de fibrine et les hémostatiques sont métabolisés par fibrinolyse et phagocytose, de la même façon que la fibrine endogène.
Données précliniquesAucune étude conventionnelle sur la toxicité et la pharmacologie de sécurité n'a été réalisée avec VeraSeal. Les études de toxicité aiguë réalisées chez les rongeurs avec le fibrinogène administré par voie intraveineuse n'ont pas révélé de risque particulier pour l'être humain.
Remarques particulièresIncompatibilités
En l'absence d'études d'incompatibilité, ce médicament ne doit pas être mélangé à d'autres médicaments.
Stabilité
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Après décongélation, le produit peut être conservé avant utilisation dans l'emballage d'origine fermé pendant 7 jours au maximum à 2 - 8 °C ou pendant 24 heures au maximum à une température ne dépassant pas 25 °C.
Stabilité après ouverture
Après ouverture de l'emballage blister, VeraSeal doit être utilisé immédiatement.
Remarques particulières concernant le stockage
Conserver et transporter congelé (à ≤ -18 °C). La chaîne du froid (≤ -18 °C) ne doit pas être interrompue jusqu'à l'utilisation. Conserver le blister stérilisé dans son carton pour le protéger de la lumière.
Décongeler complètement avant utilisation. Après décongélation, ne pas recongeler. Pour les conditions de conservation après décongélation et après ouverture, voir la rubrique «Stabilité».
Tenir hors de portée des enfants.
Remarques concernant la manipulation
L'emballage contient un applicateur double avec deux embouts pulvérisateurs sans air supplémentaires pour l'application par pulvérisation ou en goutte à goutte. Les embouts pulvérisateurs sans air sont radio-opaques. Voir Figure 1.

Figure 1
Une vue d'ensemble des méthodes de décongélation et des conditions de conservation après la décongélation est présentée dans le tableau 2.
Tableau 2. Décongélation et conservation après la décongélation
|
Méthode de décongélation
|
Durée de décongélation en fonction de la présentation
|
Conservation après la décongélation
| |
Présentations 2 ml et 4 ml
|
Présentations 6 ml et 10 ml
| |
Au réfrigérateur
(2 – 8 °C)
|
7 heures au minimum
|
10 heures au minimum
|
7 jours à 2 – 8 °C (au réfrigérateur), dans l'emballage d'origine
OU
24 heures à une température ne dépassant pas 25 °C, dans l'emballage d'origine
| |
Décongélation à 20 – 25 °C
|
70 minutes au minimum
|
90 minutes au minimum
| |
Au bainmarie stérile (37 °C), dans le champ stérile
|
5 minutes au minimum Ne pas dépasser 10 minutes
|
5 minutes au minimum Ne pas dépasser 10 minutes
|
Utiliser immédiatement pendant l'intervention chirurgicale
|
Méthodes de décongélation à privilégier
Décongélation au réfrigérateur
1. Sortir la boîte du congélateur et la placer au réfrigérateur pour décongélation à 2 – 8 °C
pendant au moins 7 heures pour les présentations 2 ml et 4 ml,
pendant au moins 10 heures pour les présentations 6 ml et 10 ml.
Après décongélation, il n'est pas nécessaire de chauffer le produit pour l'utiliser.
Après décongélation, les solutions doivent être limpides à légèrement opalescentes et incolores à jaune clair. Ne pas utiliser des solutions troubles ou contenant des particules.
Décongélation à 20 – 25 °C
Sortir la boîte du congélateur, l'ouvrir et sortir les deux emballages blister.
Placer l'emballage blister contenant l'applicateur double sur un plan de travail à 20 – 25 °C jusqu'à ce que la colle de fibrine soit prête à être utilisée.
Décongeler l'emballage blister contenant les seringues préremplies VeraSeal à 20 – 25 °C en suivant les étapes ci-dessous:
1. Placer l'emballage blister contenant le porte-seringue et les seringues préremplies sur un plan de travail à 20 – 25 ºC
pendant au moins 70 minutes pour les présentations de 2 ml et 4 ml,
pendant au moins 90 minutes pour les présentations de 6 ml et 10 ml.
Après décongélation, il n'est pas nécessaire de chauffer le produit pour l'utiliser.
Après décongélation, les solutions doivent être limpides à légèrement opalescentes, et incolores à jaune clair. Ne pas utiliser de solutions troubles ou contenant des particules.
Conservation après la décongélation
Après décongélation, le kit contenant le porte-seringue VeraSeal, les seringues préremplies et l'applicateur double peut être conservé avant utilisation dans l'emballage d'origine fermé pendant 7 jours au maximum au réfrigérateur à 2 – 8 °C ou pendant 24 heures au maximum à une température ne dépassant pas 25 °C. Après l'ouverture des emballages blister, VeraSeal doit être utilisé immédiatement; éliminer tout reste non utilisé.
Après décongélation, ne pas recongeler!
Instructions pour le transfert
1. Après décongélation, retirer l'emballage blister du plan de travail à 20 – 25 °C ou du réfrigérateur entre 2 - 8 °C.
2. Ouvrir l'emballage blister et vérifier que les seringues préremplies VeraSeal sont complètement décongelées. Remettre le porte-seringue VeraSeal avec les seringues préremplies à une deuxième personne pour le transfert sur le champ stérile. L'extérieur de l'emballage blister ne doit pas entrer en contact avec le champ stérile. Voir Figure 2.
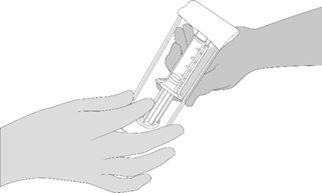
Figure 2
Bain-marie stérile (décongélation rapide)
Sortir la boîte du congélateur, l'ouvrir et sortir les deux emballages blister.
Placer l'emballage blister contenant l'applicateur double sur un plan de travail à 20 - 25 °C jusqu'à ce que la colle de fibrine soit prête à être utilisée.
Décongeler les seringues préremplies VeraSeal sur le champ stérile dans un bain-marie thermostaté stérile à une température de 37 ± 2 °C, en suivant les étapes ci-dessous:
REMARQUE: après ouverture des emballages blister VeraSeal, le produit doit être utilisé immédiatement. Utiliser une technique stérile pour prévenir tout risque de contamination due à une manipulation incorrecte et suivre exactement les étapes ci-dessous. Ne pas retirer les capuchons Luer des seringues avant que la décongélation soit complète et que l'applicateur double puisse être fixé.
1. Ouvrir l'emballage blister et remettre le porte-seringue VeraSeal avec les seringues préremplies à une deuxième personne pour le transfert sur le champ stérile. L'extérieur de l'emballage blister ne doit pas entrer en contact avec le champ stérile. Voir Figure 2.
2. Placer le porte-seringue avec les seringues préremplies directement dans le bain-marie stérile et s'assurer qu'il est complètement recouvert d'eau. Voir Figure 3.
3. À 37 °C, environ 5 minutes sont nécessaires pour les présentations de 2 ml, 4 ml, 6 ml et 10 ml, et leur exposition à cette température ne doit pas excéder 10 minutes.
La température du bain-marie ne doit pas dépasser 39 °C.
4. Après décongélation, sécher le porte-seringue avec les seringues préremplies à l'aide d'une compresse de gaze chirurgicale stérile.

Figure 3
Vérifier que les seringues préremplies VeraSeal sont complètement décongelées.
Après décongélation, les solutions doivent être limpides à légèrement opalescentes, et incolores à jaune clair. Ne pas utiliser de solutions troubles ou contenant des particules.
Utiliser VeraSeal immédiatement et éliminer tout reste non utilisé.
Instructions pour le raccordement
1. Ouvrir l'emballage blister et remettre l'applicateur double VeraSeal et les deux embouts pulvérisateurs sans air supplémentaires à une deuxième personne pour le transfert sur le champ stérile. L'extérieur de l'emballage blister ne doit pas entrer en contact avec le champ stérile.
2. Tenir le porte-seringue VeraSeal avec les capuchons Luer des seringues dirigés vers le haut. Voir Figure 4.
3. Dévisser et éliminer les capuchons Luer des seringues de fibrinogène et de thrombine. Voir Figure 4.
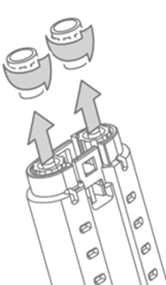
Figure 4
4. Tenir le porte-seringue avec les raccords Luer dirigés vers le haut. Pour éliminer les bulles d'air présentes dans les seringues, tenir le porte-seringue verticalement, le tapoter doucement une ou deux fois et appuyer légèrement sur le piston pour expulser l'air. Voir Figure 5.
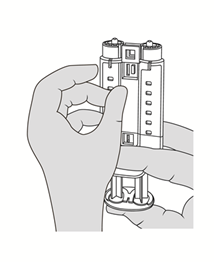
Figure 5
5. Fixer l'applicateur double. Voir Figure 6.
REMARQUE: ne pas appuyer sur le piston en fixant l'applicateur double ou avant l'utilisation prévue, car les deux composants biologiques se mélangeraient prématurément dans l'embout pulvérisateur sans air et formeraient un caillot de fibrine empêchant l'application du produit. Voir Figure 7.
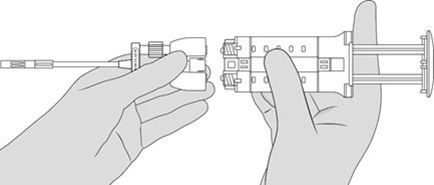
Figure 6
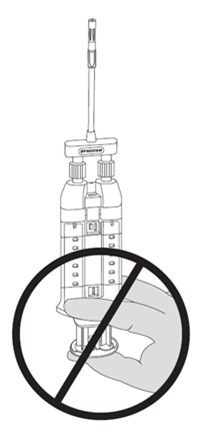
Figure 7
6. Serrer les raccords Luer et s'assurer que l'applicateur double est solidement fixé. Le produit est maintenant prêt à l'emploi.
Application
Appliquer VeraSeal à l'aide du porte-seringue fourni et du piston.
VeraSeal doit être appliqué à l'aide de l'applicateur double fourni avec le produit. D'autres embouts d'applicateur avec marquage CE (incluant les dispositifs pour chirurgie à ciel ouvert ou laparoscopique), destinés spécifiquement à un usage avec VeraSeal, peuvent également être utilisés. En cas d'utilisation de l'applicateur double fourni, suivre les instructions ci-dessus pour le raccordement. En cas d'utilisation d'autres embouts d'applicateur, suivre le mode d'emploi de ces embouts.
Application par pulvérisation
1. Tenir l'applicateur double et le courber dans la position souhaitée. L'embout conserve sa forme.
2. Positionner l'embout pulvérisateur sans air à une distance d'au moins 2 cm du tissu cible. Exercer une pression ferme et régulière sur le piston pour pulvériser la colle de fibrine. Augmenter la distance en conséquence pour obtenir la couverture souhaitée de la zone cible.
3. Si l'application par pulvérisation est interrompue pour une quelconque raison, changer d'embout pulvérisateur sans air avant de reprendre l'application car un caillot peut se former à l'intérieur de l'embout pulvérisateur sans air. Pour changer l'embout pulvérisateur sans air, éloigner le dispositif du patient et dévisser l'embout pulvérisateur sans air usagé. Voir Figure 8. Garder l'embout pulvérisateur sans air usagé séparé des embouts de réserve. Essuyer l'extrémité de l'applicateur avec une compresse de gaze stérile, sèche ou humide. Fixer ensuite un nouvel embout pulvérisateur sans air fourni dans l'emballage et vérifier avant l'utilisation qu'il est solidement fixé.
REMARQUE: l'anneau rouge n'est pas visible si l'embout pulvérisateur sans air est correctement fixé. Voir Figure 9.
REMARQUE: ne pas continuer à appuyer sur le piston pour éliminer le caillot de fibrine dans l'embout pulvérisateur sans air, car l'applicateur pourrait devenir inutilisable.
REMARQUE: ne pas raccourcir l'applicateur double, pour ne pas mettre à nu le câble interne.
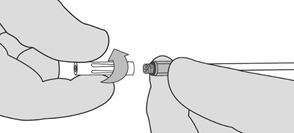
Figure 8
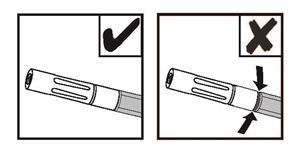
Figure 9
Application en goutte à goutte
1. Retirer l'embout pulvérisateur sans air de l'embout de pulvérisation et de goutte à goutte en le dévissant. Voir Figure 8.
2. Tenir l'embout de goutte à goutte et le courber dans la position souhaitée. L'embout conserve sa forme.
3. Pendant l'application en goutte à goutte, maintenir l'extrémité de l'embout de goutte à goutte le plus près possible de la surface du tissu, sans toucher le tissu pendant l'application.
4. Déposer les gouttes une à une sur la surface à traiter. Pour prévenir une coagulation non contrôlée, veiller à ce que les gouttes se détachent les unes des autres ainsi que de l'extrémité de l'embout de goutte à goutte.
REMARQUE: ne pas reconnecter un embout de goutte à goutte usagé après l'avoir retiré de l'adaptateur, car un caillot pourrait se former à l'intérieur de l'embout de goutte à goutte et l'applicateur pourrait devenir inutilisable.
Élimination
Le médicament non utilisé et/ou les déchets doivent être éliminés conformément aux exigences nationales.
Numéro d’autorisation67975 (Swissmedic).
PrésentationEmballage contenant un kit à usage unique avec deux seringues préremplies (en verre de type I) avec un bouchon en caoutchouc, montées sur un porte-seringue et contenant chacune une solution congelée stérile.
·VeraSeal 2 ml (contient 1 ml de fibrinogène humain et 1 ml de thrombine humaine) [B].
·VeraSeal 4 ml (contient 2 ml de fibrinogène humain et 2 ml de thrombine humaine) [B].
·VeraSeal 6 ml (contient 3 ml de fibrinogène humain et 3 ml de thrombine humaine) [B].
·VeraSeal 10 ml (contient 5 ml de fibrinogène humain et 5 ml de thrombine humaine) [B].
Titulaire de l’autorisationJanssen-Cilag AG, Zug, ZG.
Mise à jour de l’informationAoût 2024
|









