Eigenschaften/WirkungenATC-Code
D11AH11
Wirkungsmechanismus
Delgocitinib ist ein Pan-Janus-Kinase (JAK)-Inhibitor, der konzentrationsabhängig auf die Aktivität aller vier Mitglieder der JAK-Enzymfamilie, bestehend aus JAK1, JAK2, JAK3 und Tyrosinkinase 2 (TYK2), abzielt. Janus-Kinasen sind intrazelluläre Enzyme, die mit Zytokinrezeptorketten assoziiert sind und Signale von Zytokinen übertragen, um ein breites Spektrum physiologischer und pathologischer Prozesse, einschliesslich Entzündungsreaktionen, zu regulieren. Innerhalb des Signalwegs werden JAKs bei der Interaktion zwischen Zytokin und Rezeptor aktiviert. Sie phosphorylieren und aktivieren anschliessend Signalwandler und Transkriptionsaktivatoren (Signal Transducers and Activators of Transcription, STATs). Aktivierte STATs wiederum aktivieren die Expression von Zytokin-responsiven Genen, um spezifische biologische Reaktionen in Zielzellen auszulösen. Die Hemmung der JAK-Aktivität mit Delgocitinib verhindert die Phosphorylierung und Aktivierung von STATs.
Die Ergebnisse zellulärer Studien am Menschen zeigten, dass die Hemmung des JAK-STAT-Signalwegs durch Delgocitinib die Signalübertragung mehrerer proinflammatorischer Zytokine (einschliesslich Interleukin(IL)-2, IL-4, IL-6, IL-13, IL-21, IL-23, Granulozyten-Makrophagen-Kolonie-stimulierender Faktor (Granulocyte-Macrophage-Colony-Stimulating Factor, GM-CSF) und Interferon(IFN)-α) abschwächt, wodurch die Immun- und Entzündungsreaktionen in Zellen, die für die Pathologie des chronischen Handekzems relevant sind, herunterreguliert werden.
Pharmakodynamik
Bei Patienten mit chronischem Handekzem führte die Behandlung mit Delgocitinib zu einer Verringerung der proinflammatorischen Marker des chronischen Handekzems, wie z. B. S100 Calcium-bindendes Protein A9/12 (S100A9/12), und Serpin-Familie B Mitglied 3 (SERPINB3).
Die Behandlung mit topisch aufgetragenem Delgocitinib führte auch zu einer erhöhten Expression von Genen, die an der Haut-Barrierefunktion (z. B. Filaggrin, Loricrin, Claudine) der läsionalen Haut beteiligt sind.
Die Besiedlung der Haut mit Staphylococcus aureus wurde unter Behandlung mit Delgocitinib im Vergleich zur Behandlung mit Vehikel-Creme stark reduziert.
Klinische Wirksamkeit
Die Sicherheit und Wirksamkeit von Anzupgo® wurde in zwei pivotalen, randomisierten, doppelblinden, Vehikel-kontrollierten Studien mit gleichem Design (DELTA 1, DELTA 2) geprüft. An den Studien nahmen 960 Patienten im Alter von mindestens 18 Jahren mit mittelschwerem bis schwerem chronischem Handekzem gemäss der Definition von IGA-CHE (Investigator's Global Assessment for Chronic Hand Eczema) mit einem Score von 3 oder 4 (mittelschwer oder schwer) teil (siehe Tabelle 1), die bei Baseline einen Juckreiz-Score von ≥ 4 Punkten im Handekzem-Symptomtagebuch (Hand Eczema Symptom Diary, HESD) aufweisen mussten. In Frage kamen Patienten, die zuvor unzureichend auf potente bis hochpotente topische Kortikosteroide angesprochen hatten oder bei denen potente bis hochpotente topische Kortikosteroide nicht empfohlen sind.
Tabelle 1: Investigator’s Global Assessment für chronisches Handekzem (IGA-CHE)
|
IGA-CHE- Schweregrad
|
IGA-CHE Score
|
Anzeichen und Intensität
| |
Erscheinungsfrei
|
0
|
Keine Anzeichen von Erythem, Schuppung, Hyperkeratose/Lichenifikation, Vesikelbildung, Ödem oder Fissuren
| |
Fast erscheinungsfrei
|
1
|
Kaum wahrnehmbares Erythem, keine Anzeichen von Schuppung, Hyperkeratose/Lichenifikation, Vesikelbildung, Ödem oder Fissuren
| |
Leicht
|
2
|
Mindestens eines:
·leichtes, aber deutliches Erythem (rosa)
·leichte, aber eindeutige Schuppung (meist feine Schuppen)
·leichte, aber eindeutige Hyperkeratose/Lichenifikation
und mindestens eines:
·verstreute Vesikel, ohne Erosion
·kaum tastbares Ödem
·oberflächliche Fissuren
| |
Mittelschwer
|
3
|
Mindestens eines:
·deutlich wahrnehmbares Erythem (mattes Rot)
·deutlich wahrnehmbare Schuppung (grobe Schuppen)
·deutlich wahrnehmbare Hyperkeratose/Lichenifikation
und mindestens eines:
·Vesikelansammlungen, ohne sichtbare Erosionen
·eindeutiges Ödem
·eindeutige Fissuren
| |
Schwer
|
4
|
Mindestens eines:
·ausgeprägtes Erythem (gering oder hellrot)
·ausgeprägte und dicke Schuppung
·ausgeprägte Hyperkeratose/Lichenifikation
und mindestens eines:
·hohe Dichte von Vesikeln mit Erosionen
·ausgeprägtes Ödem
·eine oder mehrere geringe Fissuren
|
In DELTA 1 und DELTA 2 trugen die Patienten während 16 Wochen 2x täglich entweder Delgocitinib Creme (20 mg/g) oder eine Vehikel-Creme auf die betroffenen Stellen an Händen und Handgelenken auf. Alle Patienten, welche die beiden pivotalen Studien abgeschlossen hatten, konnten an der Langzeitverlängerungsstudie DELTA 3 teilnehmen.
Endpunkte
In DELTA 1 und DELTA 2 war der primäre Endpunkt, das Erreichen eines IGA-CHE-Behandlungserfolgs (IGA-CHE TS (Treatment Success)), definiert als ein IGA-CHE-Score von 0 (frei von Symptomen) oder 1 (fast frei von Symptomen: nur kaum wahrnehmbares Erythem) mit einer mindestens zweistufigen Verbesserung von Baseline bis Woche 16. Der IGA-CHE bewertet den Schweregrad der Erkrankung und basiert auf einer 5-Punkte-Skala, die von 0 (frei von Symptomen) bis 4 (schwer) reicht (siehe Tabelle 1).
Zu den weiteren Ergebnissen zur Wirksamkeit gehörten der Hand Eczema Severity Index (HECSI) und das HESD zu verschiedenen Zeitpunkten. Der HECSI bewertet den Schweregrad von sechs klinischen Anzeichen (Erythem, Infiltration/Papulation, Bläschen, Risse, Schuppung, Ödem) und das Ausmass der Läsionen an jeder der fünf Handregionen (Fingerspitzen, Finger, Handfläche, Handrücken, Handgelenke). Im HESD wurden die von den Patienten berichteten Ergebnisse (Patient Reported Outcome, PRO) täglich mit 6 Punkten erfasst. Es dient dazu, den schlimmsten Schweregrad der Anzeichen und Symptome des chronischen Handekzems (Juckreiz, Schmerzen, Rissbildung, Rötung, Trockenheit, Schuppenbildung) anhand einer 11-stufigen numerischen Bewertungsskala zu beurteilen.
Baseline-Merkmale
In allen Behandlungsgruppen in DELTA 1 und DELTA 2 betrug das Durchschnittsalter 44,1 Jahre. 7,6% der Patienten waren 65 Jahre alt oder älter, 64,4% waren weiblich, 3,5% waren asiatischer Herkunft, 90,4% waren Patienten mit weisser und 0,7% mit schwarzer Hautfarbe. Die Häufigkeit von CHE nach Hauptsubtypen betrug 35,9 % atopisches Handekzem, 21,5 % hyperkeratotisches Ekzem, 19,6 % irritatives Kontaktekzem, 13,9 % allergisches Kontaktekzem, 9,1 % vesikuläres Handekzem (Pompholyx) und 0,1 % Kontakturtikaria/Proteinkontaktdermatitis. In DELTA 1 und DELTA 2 hatten 28,4% der Patienten einen Baseline-IGA-CHE-Score von 4 (schweres chronisches Handekzem). Der mittlere Baseline-Score im Dermatology Life Quality Index (DLQI) lag bei 12,5, der HECSI-Score bei 71,6 und der HESD-Score bei 7,1. Die mittleren HESD-Scores für Juckreiz und Schmerzen betrugen 7,1 bzw. 6,7.
Klinisches Ansprechen
DELTA 1 und DELTA 2
In DELTA 1 und DELTA 2 erreichte ein signifikant grösserer Anteil der Patienten in der Delgocitinib-Gruppe den primären Endpunkt IGA-CHE TS in Woche 16 im Vergleich zur Vehikel-Gruppe. Die Ergebnisse für den primären und ausgewählte andere multiplizitätskontrollierte sekundäre Endpunkte sind in Tabelle 2 aufgeführt. Abbildung 1 zeigt den Anteil derjenigen Patienten, die im Laufe der Zeit in DELTA 1 und DELTA 2 eine Verbesserung bei HECSI-75, HESD-Juckreiz ≥ 4 Punkte und HESD-Schmerz ≥ 4 Punkte erreichten.
Tabelle 2: Ergebnisse zur Wirksamkeit von Delgocitinib in Woche 16 in DELTA 1 und DELTA 2
|
|
DELTA 1
|
DELTA 2
| |
|
Delgocitinib
(N=325)
|
Vehikel
(N=162)
|
Delgocitinib
(N=313)
|
Vehikel
(N=159)
| |
IGA-CHE TS, % der Respondera, b
|
19,7#
|
9,9
|
29,1§
|
6,9
| |
HECSI-90, % der Respondera, c
|
29,5§
|
12,3
|
31,0§
|
8,8
| |
HECSI-75, % der Respondera, d, e
|
49,2§
|
23,5
|
49,5§
|
18,2
| |
HECSI, mittlere prozentuale (%) LS-Veränderung gegenüber Baseline (± SE)f
|
-56,5§
(± 3,4)
|
-21,2
(± 4,8)
|
-58,9§
(± 3,2)
|
-13,4
(± 4,5)
| |
HESD-Juckreiz-Score, mittlere LS-Veränderung gegenüber Baseline (± SE)f
|
-3,6§
(± 0,2)
|
-1,9
(± 0,2)
|
-3,4§
(± 0,2)
|
-1,4
(± 0,2)
| |
HESD-Schmerz-Score, mittlere LS-Veränderung gegenüber Baseline (± SE)f
|
-3,4§
(± 0,2)
|
-1,8
(± 0,2)
|
-3,3§
(± 0,2)
|
-1,3
(± 0,2)
| |
HESD-Score, mittlere LS-Veränderung gegenüber Baseline (± SE)f
|
-3,4§
(± 0,1)
|
-1,7
(± 0,2)
|
-3,2§
(± 0,1)
|
-1,4
(± 0,2)
| |
HESD-Juckreiz ≥ 4-Punkte-Verbesserung, % der Respondera, g, h
|
47,1§
(152/323)
|
23,0
(37/161)
|
47,2§
(146/309)
|
19,9
(31/156)
| |
HESD-Schmerz ≥ 4-Punkte-Verbesserung, % der Respondera, b, g
|
49,1§
(143/291)
|
27,5
(41/149)
|
48,6§
(143/294)
|
22,7
(32/141)
| |
HESD ≥ 4-Punkte-Verbesserung, % der Respondera, b, g
|
47,2§
(146/309)
|
24,4
(38/156)
|
44,5§
(137/308)
|
20,9
(32/153)
|
#p<0,01, §p<0,001
Alle p-Werte waren im Vergleich zum Vehikel statistisch signifikant mit Anpassung für Multiplizität.
Abkürzungen: LS = kleinste Quadrate (least squares); N = Anzahl der Patienten im vollständigen Analysesatz (alle Patienten, die randomisiert und dosiert wurden); SE = Standardfehler (standard error)
a.Daten nach Einleitung einer Notfallbehandlung, nach dauerhaftem Abbruch der Behandlung oder deren Daten fehlten, wurden als Non-Response betrachtet.
b.Statistisch signifikant im Vergleich zum Vehikel mit Anpassung für Multiplizität in Woche 4 und 8 in DELTA 1 und DELTA 2.
c.HECSI-90-Responder waren Patienten mit einer Verbesserung des HECSI um ≥ 90 % gegenüber Baseline.
d.HECSI-75-Responder waren Patienten mit einer Verbesserung des HECSI um ≥ 75 % gegenüber Baseline.
e.Statistisch signifikant im Vergleich zum Vehikel mit Anpassung für Multiplizität in Woche 8 in DELTA 1 und DELTA 2.
f.Daten nach Einleitung einer Notfallbehandlung oder nach dauerhaftem Abbruch der Behandlung oder deren Daten wurden als Non-Response betrachtet, indem die schlechteste Beobachtung übertragen wurde.
g.Basierend auf der Anzahl der Patienten, deren Baseline-Score ≥ 4 war (Skala von 0 bis 10).
h.Statistisch signifikant im Vergleich zum Vehikel mit Anpassung für Multiplizität in Woche 2, 4 und 8 in DELTA 1 und DELTA 2.
Im Vergleich zur Behandlung mit Vehikel-Creme wurden 1 Tag bzw. 3 Tage nach Beginn der Delgocitinib-Behandlung stärkere Verbesserungen, gemessen an der mittleren Veränderung der HESD-Scores für Juckreiz und Schmerzen, beobachtet. In Woche 2 wurden bei allen HESD-Punkten (Juckreiz, Schmerzen, Rissbildung, Rötung, Trockenheit, Schuppenbildung) stärkere Verbesserungen gegenüber der Behandlung mit Vehikel-Creme beobachtet.
Abbildung 1: Anteil der Patienten, die im Laufe der Zeit in DELTA 1 und DELTA 2 eine Verbesserung bei HECSI-75, HESD-Juckreiz ≥ 4 Punkte und HESD-Schmerz ≥ 4 Punkte erreichten – gepoolte Daten aus DELTA 1 und DELTA 2
|
HECSI-75a
|
HESD-Juckreiz ≥ 4-Punkte-Verbesserungb
|
HESD-Schmerz ≥ 4-Punkte-Verbesserungb
|
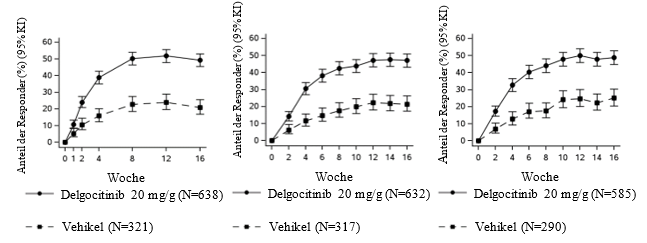
KI = Konfidenzintervall.
a.HECSI-75-Responder waren Patienten mit einer Verbesserung des HECSI um ≥ 75 % gegenüber Baseline.
b.Basierend auf der Anzahl der Patienten, deren Baseline-Score ≥ 4 war (Skala von 0 bis 10).
In DELTA 1 und DELTA 2 waren die Behandlungseffekte in den Untergruppen (Gewicht, Alter, Geschlecht, Schweregrad der Erkrankung, Dauer des chronischen Handekzems und vorherige Behandlung) mit den Ergebnissen in der gesamten Studienpopulation vergleichbar.
Die Punktschätzungen des Behandlungseffekts für den primären und die wichtigsten sekundären Endpunkte in Woche 16 fielen bei allen CHE-Subtypen durchweg zugunsten von Delgocitinib aus. Beim hyperkeratotischen Handekzem betrug der geschätzte Behandlungsunterschied für IGA-CHE TS jedoch 2,1%, 95% CI (-6,8:11,0). Bei allen CHE-Subtypen kam es in Woche 16 zu einer statistisch signifikant stärkeren Verbesserung des Juckreizes und der Schmerzen bei HESD (≥ 4 Punkte) im Vergleich zur Vehikel-Creme.
Zusätzliche Lebensqualität - Ergebnisberichte von Patienten
Sowohl in DELTA 1 als auch in DELTA 2 zeigten Patienten, die mit Delgocitinib-Creme behandelt wurden, eine signifikante Verbesserung gegenüber der Baseline bis zur 16. Woche im Vergleich zu mit Vehikel in der Hand Eczema Impact Scale (HEIS)(proximale Einschränkungen bei täglichen Aktivitäten, Scham, Frustration, Schlaf, Arbeit und körperliche Funktion [Fähigkeit, Gegenstände zu halten oder zu greifen]) (siehe Tabelle 3).
In DELTA 1 und DELTA 2 wurden bei mit Delgocitinib behandelten Patienten im Vergleich zu mit Vehikel-Creme behandelten Patienten in Woche 16 signifikant bedeutende Verbesserungen der gesundheitsbezogenen Lebensqualität, erfasst mittels DLQI, beobachtet (siehe Tabelle 3). Von den vier Bereichen «Arbeitsproduktivität und Aktivitätsbeeinträchtigung: Chronisches Handekzem» (Abwesenheit, Anwesenheit, Verlust der Arbeitsproduktivität, Beeinträchtigung der Aktivität) zeigten Patienten, die Delgocitinib erhielten, in Woche 16 bedeutendere Verbesserungen in allen Bereichen ausser bei der Abwesenheit, gegenüber der Behandlung mit Vehikel-Creme.
Tabelle 3: Zusätzliche Lebensqualität - Ergebnisberichte von Patienten unter Behandlung mit Delgocitinib in Woche 16 in DELTA 1 und DELTA 2
|
|
DELTA 1
|
DELTA 2
| |
|
Delgocitinib
(N=325)
|
Vehikel
(N=162)
|
Delgocitinib
(N=313)
|
Vehikel
(N=159)
| |
DLQI, mittlere LS-Veränderung gegenüber Baseline (± SE)a
|
-7,6§
(± 0,3)
|
-3,9
(± 0,4)
|
-7,0§
(± 0,3)
|
-3,1
(± 0,5)
| |
HEIS, mittlere LS-Veränderung gegenüber Baseline (± SE)a
|
-1,46§
(± 0,05)
|
-0,82
(± 0,08)
|
-1,45§
(± 0,06)
|
-0,64
(± 0,08)
| |
HEIS PDAL, mittlere LS-Veränderung gegenüber Baseline (± SE)a, b
|
-1,46§
(± 0,06)
|
-0,86
(± 0,08)
|
-1,48§
(± 0,06)
|
-0,66
(± 0,08)
| |
DLQI ≥ 4-Punkte-Verbesserung,
% der Responderc, d
|
74,4§
(227/305)
|
50,0
(74/148)
|
72,2§
(216/299)
|
45,8
(70/153)
|
§p<0,001
Alle p-Werte waren im Vergleich zum Vehikel statistisch signifikant mit Anpassung für Multiplizität.
Abkürzungen: LS = kleinste Quadrate (least squares); N = Anzahl der Patienten im vollständigen Analysesatz (alle Patienten, die randomisiert und dosiert wurden); PDAL = proximale tägliche Aktivitätseinschränkungen (proximal daily activity limitations); SE = Standardfehler (standard error)
a.Daten nach Einleitung einer Notfallbehandlung, nach dauerhaftem Abbruch der Behandlung, oder deren Daten wurden als Non-Response betrachtet, indem die schlechteste Beobachtung übertragen wurde.
b.HEIS PDAL beurteilt die Fähigkeit des Patienten, Seifen/Reinigungsmittel zu benutzen, den Haushalt zu führen und sich zu waschen.
c.Daten nach Einleitung einer Notfallbehandlung, nach dauerhaftem Abbruch der Behandlung, oder deren Daten fehlten, wurden als Non-Response betrachtet.
d.Basierend auf der Anzahl der Patienten, deren Baseline-Score ≥ 4 war.
Verlängerungsstudie (DELTA 3)
Patienten, die entweder die Studie DELTA 1 oder DELTA 2 abgeschlossen hatten, konnten an einer 36-wöchigen offenen Verlängerungsstudie (DELTA 3) teilnehmen. In DELTA 3 wurde die langfristige Sicherheit und Wirksamkeit einer bedarfsgerechten Delgocitinib-Behandlung bei 801 Patienten untersucht. Die Patienten begannen mit der Anwendung von Delgocitinib 2x täglich auf die betroffenen Stellen, wenn der IGA-CHE-Score ≥ 2 (leicht oder schlechter) war, und beendeten die Behandlung, wenn ein IGA-CHE-Score von 0 oder 1 (frei von Symptomen oder fast frei von Symptomen) erreicht wurde. Patienten, die mit einem IGA-CHE-Score von 0 oder 1 in DELTA 3 eintraten, wurden nicht mehr behandelt bis zum Verlust des Ansprechens (IGA-CHE-Score ≥ 2).
Patienten, die nach der anfänglichen 16-wöchigen Behandlung mit Delgocitinib eine Verbesserung beim IGA-CHE 0 oder 1, beim HECSI-75, beim HECSI-90, beim HESD-Juckreiz ≥ 4 Punkte und beim HESD-Schmerz ≥ 4 Punkte erreichten, wurden bis zur Woche 52 mit einer Behandlung nach Bedarf weiterbehandelt. Bei den 560 Patienten, die in den pivotalen Studien (DELTA 1 und DELTA 2) in die Delgocitinib-Gruppe randomisiert wurden und anschliessend an der DELTA 3 Studie teilnahmen, betrug die durchschnittliche Anzahl der Behandlungsperioden 1,5 (Spanne 0 bis 6), die durchschnittliche Dauer der Behandlungsperiode 123 Tage und die durchschnittliche kumulative Anzahl der Tage des Ansprechens (Tage mit einem IGA-CHE-Score von 0 oder 1 innerhalb des 36-wöchigen Behandlungszeitraums) 46. Bei denjenigen Patienten, die in den pivotalen Studien in Woche 16 einen IGA-CHE TS erreichten, lag die mittlere kumulative Anzahl der Tage des Ansprechens bei 111.
Von denjenigen Patienten, die in den pivotalen Studien in die Delgocitinib-Gruppe randomisiert wurden und in Woche 16 einen IGA-CHE TS erreichten, lag die mediane Dauer des Ansprechens während des Absetzens der Behandlung bei 4 Wochen, wobei 28% das Ansprechen für mindestens 8 Wochen beibehielten. Die mediane Dauer bis zum Wiedererreichen eines IGA-CHE-Scores von 0 oder 1 nach Wiederaufnahme der Behandlung betrug 8 Wochen. Von denjenigen Patienten, die in den pivotalen Studien in Woche 16 unter Delgocitinib-Behandlung keinen IGA-CHE TS erreicht hatten, erreichten 48,1% unter fortgesetzter Delgocitinib-Behandlung in DELTA 3 einen IGA-CHE von 0 oder 1.
Direkte Vergleichsstudie der Phase 3 mit Alitretinoin (DELTA Force)
Die Wirksamkeit und Sicherheit von Delgocitinib-Creme 20 mg/g, die 2x täglich aufgetragen wird, wurde in einer randomisierten, Gutachter-verblindeten Studie im Vergleich zu Alitretinoin-Kapseln 30 mg (mit der Option, während der Studie auf 10 mg zu reduzieren), die einmal täglich verabreicht werden, bei erwachsenen Patienten mit schwerem CHE untersucht. Die Behandlungsdauer betrug bis zu 24 Wochen.
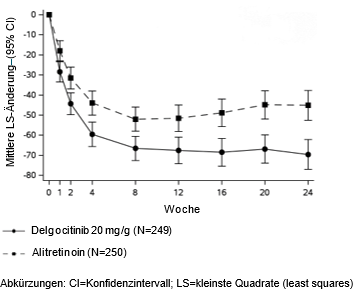
Für Delgocitinib-Creme wurde im Vergleich zu Alitretinoin eine statistisch signifikant grössere Verbesserung für den primären Endpunkt, die Veränderung des HECSI-Scores vom Ausgangswert bis zur 12. Woche, erzielt. Statistisch signifikant grössere Verbesserungen wurden für Delgocitinib auch bei den wichtigsten sekundären Endpunkten erzielt, darunter HESD-Juckreiz und HESD-Schmerz. Die Ergebnisse für die primären und ausgewählten multiplizitätskontrollierten sekundären Endpunkte sind in Tabelle 4 dargestellt.
Tabelle 4: Ergebnisse zur Wirksamkeit in Woche 12 aus DELTA Force - Delgocitinib im Vergleich zu Alitretinoin
|
|
DELTA Force
| |
|
Delgocitinib
(N=250)
|
Alitretinoin
(N=253)
| |
HECSI, mittlere LS-Veränderung gegenüber Baseline (± SE)a
|
-67.6§
(±3,37)
|
-51,5
(±3,36)
| |
HECSI-90, % der Responderb
|
38,6#
|
26,0
| |
IGA-CHE TS, % der Responderb
|
27,2#
|
16,6
| |
HESD Juckreiz-Score, mittlere LS Veräderung gegenüber Baseline (± SE)a
|
-3,0#
(± 0,22)
|
-2,4
(± 0,21)
| |
HESD Schmerz-Score, mittlere LS Veränderung gegenüber Baseline (± SE)a
|
-2,9*
(± 0,23)
|
-2,3
(± 0,23)
|
*p=0.018, #p<0,01, §p<0,001
Alle p-Werte waren im Vergleich zu Alitretinoin statistisch signifikant mit Anpassung für Multiplizität.
Abkürzungen: LS = kleinste Quadrate (least squares); N = Anzahl der Patienten im vollständigen Analysesatz; SE = Standardfehler (standard error)
a.Daten nach Einleitung einer NotfallBehandlung, nach dauerhaftem Abbruch der Behandlung, oder fehlende Daten wurden als Non-Response gewertet, indem die schlechteste Beobachtung übertragen wurde.
b.Daten nach Einleitung einer Notfallbehandlung, nach dauerhaftem Abbruch der Behandlung, oder denen Daten fehlten, galten als Non-Response
Grössere Verbesserungen bei Delgocitinib-Creme, gemessen an der mittleren Änderung des HECSI-Scores im Vergleich zu Alitretinoin-Kapseln, wurden bereits in Woche 1 beobachtet und verbesserten sich bis Woche 24 weiter. Die Veränderung der HECSI-Scores vom Ausgangswert bis Woche 24 für Delgocitinib und Alitretinoin sind in Abbildung 2 dargestellt.
Abbildung 2: Mittlere LS-Änderung des HECSI-Scores gegenüber dem Ausgangswert im Laufe der Zeit aus DELTA Force
|


