ZusammensetzungWirkstoff
Dronedaronum hydrochloridum.
Hilfsstoffe
Lactose-Monohydrat 41,65 mg, Hypromellose (E464), Maisstärke, Crospovidon (E1202), Poloxamer 407, hochdisperses Siliciumdioxid, Magnesiumstearat (E572), Macrogol 6000, Titandioxid (E171), Carnaubawachs (E903).
Indikationen/AnwendungsmöglichkeitenMultaq ist angezeigt zum Erhalt des Sinusrhythmus nach einer erfolgreichen Kardioversion bei klinisch stabilen Patienten mit nicht-permanentem Vorhofflimmern (VHF, paroxysmales oder persistierendes Vorhofflimmern) und um eine Senkung der Hospitalisierungsrate aufgrund kardiovaskulärer Ereignisse bei dieser Patientengruppe herbeizuführen.
Aufgrund des Sicherheitsprofils sollte Multaq nur verschrieben werden, nachdem alternative Behandlungsoptionen in Erwägung gezogen wurden.
Multaq sollte nicht bei Patienten mit linksventrikulärer systolischer Dysfunktion oder bei Patienten mit bestehender oder in der Vergangenheit aufgetretener Herzinsuffizienz angewendet werden.
Dosierung/AnwendungÜbliche Dosierung
Die empfohlene Dosierung ist bei Erwachsenen 400 mg zweimal täglich. Hierfür sollte eine Tablette mit dem Frühstück und eine mit dem Abendessen eingenommen werden. Die Tablette darf nicht gekaut oder zerkleinert werden.
Die Behandlung mit Multaq kann ambulant begonnen werden.
Dosisanpassung aufgrund unerwünschter Wirkungen/Interaktionen
Vor der Anwendung von Multaq muss die Behandlung mit Klasse-I- oder Klasse-III-Antiarrhythmika (wie z.B. Flecainid, Propafenon, Quinidin, Disopyramid, Dofetilid, Sotalol, Amiodaron) abgesetzt werden. Die lange Plasmahalbwertszeit von Amiodaron und seine potenziell verlängerte Wirkdauer nach Absetzen der Medikation müssen bei der Umstellung auf Multaq in Betracht gezogen werden (siehe «Kontraindikationen»). Zum optimalen Zeitpunkt für eine Umstellung liegen jedoch nur begrenzte Daten vor.
Patienten mit Leberfunktionsstörungen:
Bei Patienten mit leichter oder mässiger Einschränkung der Leberfunktion ist keine Dosisanpassung erforderlich (siehe «Pharmakokinetik»). Bei schwerer Einschränkung der Leberfunktion ist Multaq allerdings wegen fehlender Daten kontraindiziert (siehe «Kontraindikationen»).
Patienten mit Nierenfunktionsstörungen:
Es ist keine Dosisanpassung erforderlich (siehe «Pharmakokinetik»).
Ältere Patienten:
Eine grosse Anzahl von Patienten mit VHF (Vorhofflimmern) oder VFL (Vorhofflattern) nahmen an der klinischen Untersuchung von Multaq teil: Mehr als 4 500 Patienten waren 65 Jahre alt oder älter, über 2 000 von ihnen waren 75 Jahre alt oder älter. Die Wirksamkeit und Sicherheit waren bei älteren Patienten ohne kardiovaskuläre Begleiterkrankungen und jüngeren Patienten vergleichbar. Bei Patienten über 75 Jahren mit Begleiterkrankungen ist jedoch Vorsicht geboten (siehe «Kontraindikationen», «Warnhinweise und Vorsichtsmassnahmen»)
Kinder und Jugendliche:
Es gibt keine Erfahrungen bei Kindern und Jugendlichen.
Kontraindikationen·Überempfindlichkeit gegen den Wirkstoff oder einen der Hilfsstoffe
·Atrio-ventrikulärer Block zweiten oder dritten Grades, kompletter Schenkelblock, distaler Block, Sinusknotendysfunktion, Sick-Sinus Syndrom, atriale Reizleitungsstörungen (ausser bei gleichzeitiger Verwendung eines Herzschrittmachers)
·Bradykardie < 50 Schläge pro Minute (SpM)
·Permanentes Vorhofflimmern
·Hämodynamischer instabiler Zustand
·In der Vorgeschichte oder aktuell bestehende Herzinsuffizienz oder linksventrikuläre systolische Dysfunktion (siehe «Warnhinweise und Vorsichtsmassnahmen», sowie «Eigenschaften/Wirkungen»).
·Interstitielle Pneumopathie (einschliesslich Lungenfibrose)
·Patienten, bei denen unter Amiodaron bereits eine Schädigung der Leber oder der Lunge aufgetreten ist.
·Gleichzeitige Anwendung mit starken CYP3A4-Inhibitoren, wie Ketoconazol, Itraconazol, Voriconazol, Posaconazol, Telithromycin, Clarithromycin, Ciclosporin und Ritonavir (siehe «Interaktionen»)
·Arzneimittel, die Torsades de Pointes verursachen können, wie Phenothiazine, Cisaprid, Bepridil, trizyklische Antidepressiva, Terfenadin und bestimmte orale Makrolid-Antibiotika wie Erythromycin sowie Klasse-I- und –III-Antiarrhythmika (siehe «Interaktionen»)
·QTc Intervall (Bazett) ≥500 ms
·Schwere Leberfunktionsstörung
·Schwangerschaft (siehe «Schwangerschaft, Stillzeit»)
·Stillzeit (siehe «Schwangerschaft, Stillzeit»).
Warnhinweise und VorsichtsmassnahmenWährend einer Behandlung mit Dronedaron (siehe weiter unten) müssen die Funktionen von Herz, Leber und Lunge engmaschig und regelmässig überwacht werden. Bei rezidivierendem VHF muss erwogen werden, die Medikation abzusetzen. Die Behandlung muss unterbrochen werden, wenn sich im Laufe der Behandlung eine der vorstehend genannten Kontraindikationen auftritt. Die Anwendung einer Begleitmedikation mit enger therapeutischer Breite wie etwa Digoxin oder Antikoagulanzien erfordert eine besonders sorgfältige Überwachung (Klinik und häufige Kontrollen des INR-Werts sowie der Digoxinämie bis zur Stabilisation).
Patienten die unter der Behandlung ein permanentes VHF entwickeln
Eine klinische Studie an Patienten mit permanentem VHF (seit ≥6 Monaten oder unbekannter Dauer) und kardiovaskulären Risikofaktoren wurde aufgrund einer signifikant erhöhten Rate von kardiovaskulär bedingtem Tod, Schlaganfall, Herzinsuffizienz und kardiovaskulär bedingter Hospitalisation in der Patientengruppe unter Dronedaron vorzeitig abgebrochen. Es wird empfohlen, in regelmässigen Abständen - mindestens alle 6 Monate - ein EKG durchzuführen. Wenn die Patienten ein permanentes VHF entwickeln, muss die Behandlung mit Multaq beendet werden.
In der Vorgeschichte oder aktuell bestehende Herzinsuffizienz oder linksventrikulärer systolischer Dysfunktion
Die Anwendung von Multaq ist kontraindiziert bei Patienten mit Hämodynamisch instabilem Zustand, Herzinsuffizienz, Herzinsuffizienz in der Vorgeschichte oder eingeschränkter linksventrikulärer Funktion (siehe «Kontraindikationen»). Beim Auftreten klinischer Symptome einer Herzinsuffizienz, sollten die Patienten engmaschig überwacht werden. Spontanberichte über ein Neuauftreten oder einer Verschlechterung einer Herzinsuffizienz während der Behandlung mit Multaq liegen vor.
Die Patienten sollten darauf hingewiesen werden dass sie bei Auftreten von Anzeichen oder Symptomen einer Herzinsuffizienz, wie Gewichtszunahme, Ödemen oder Zunahme einer Dyspnoe, den Arzt konsultieren sollten. Bei Entstehung einer Herzinsuffizienz muss die Behandlung mit Multaq unterbrochen werden.
Die linksventrikuläre systolische Funktion soll während der Behandlung regelmässig überwacht werden. Bei Entstehen einer linksventrikulären systolischen Dysfunktion sollte die Behandlung mit Multaq unterbrochen werden.
Leberschädigung
Seit Markteinführung des Präparats im Jahr 2009 sind im Zusammenhang mit Dronedaron seltene Fälle von schwerer Leberschädigung gemeldet worden, die bis hin zu akuter Leberinsuffizienz reichten und in einigen Fällen eine Lebertransplantation erforderlich machten.
Bei Patienten mit vorbestehenden Leberläsionen sollte eine Behandlung mit Dronedaron nur mit grösster Vorsicht nach sorgfältiger Abwägung des Nutzen-Risiko-Verhältnisses eingeleitet werden. Liegen erhöhte ALAT-Spiegel vor, die den oberen Normwert um mehr als das 3-Fache übersteigen, sollte von einer Behandlung mit Dronedaron Abstand genommen werden.
Patienten müssen über mögliche Anzeichen bzw. Symptome einer Leberschädigung (vor kurzem aufgetretene anhaltende Bauchschmerzen, Appetitlosigkeit, Übelkeit, Erbrechen, Fieber, Unwohlsein, Müdigkeit, Gelbsucht, dunkler Urin oder Juckreiz) aufgeklärt und aufgefordert werden, in einem solchen Fall unverzüglich ihren Arzt zu kontaktieren.
Vor Beginn der Behandlung mit Multaq, sowie eine Woche nach Behandlungsbeginn, dann während der 6 ersten Monate monatlich, dann nach 9 und 12 Monaten und anschliessend in regelmässigen Abständen sollten Leberfunktionstests durchgeführt werden.
Besteht aufgrund klinischer Anzeichen oder der Laborwerte (ALAT > 3-Fache des oberen Normwerts bzw. ansteigende Tendenz) der Verdacht auf eine Leberschädigung, sollte die Therapie unterbrochen werden. Diese Situation erfordert zusätzliche Abklärungen, die Überwachung des Patienten und eine engmaschige Kontrolle der Leberfunktion.
Kommt es im Rahmen der Behandlung mit Dronedaron zu einer Leberschädigung, für die keine andere Ursache nachzuweisen ist, sollte die Behandlung mit Dronedaron auch nach Normalisierung der Leberfunktion nicht wieder aufgenommen werden.
Überwachung des Plasmakreatininanstiegs
Es wird empfohlen, vor sowie sieben Tage nach Behandlungsbeginn mit Dronedaron den Plasmakreatininwert zu messen. Falls ein Anstieg des Plasmakreatinins beobachtet wird, muss nach weiteren 7 Tagen eine erneute Messung erfolgen. Wenn das Kreatinin stabil ist, sollte dieser Wert als neuer Referenzwert genommen werden, da dies bei Dronedaron erwartungsgemäss erfolgt. Falls der Kreatininwert weiter steigt, sollten zusätzliche Tests durchgeführt und ein Abbruch der Behandlung in Erwägung gezogen werden. Ein Anstieg des Plasmakreatinins sollte nicht notwendigerweise zu einem Absetzen der Behandlung mit ACE-Inhibitoren oder Angiotensin II-Rezeptor-Antagonisten (AIIRAs) führen.
Eine Zunahme des Plasmakreatininwertes bei Gabe von Dronedaron 400 mg zweimal täglich wurde bei gesunden Probanden und bei Patienten beobachtet. Diese Zunahme tritt bald nach Behandlungsbeginn auf und erreicht ein Plateau nach sieben Tagen. Die durchschnittliche Erhöhung liegt bei Patienten mit VHF bei 10 µmol/l. Eine Woche nach Absetzen des Medikamentes kehren die Werte wieder auf ihr Ausgangsniveau zurück. In einer speziellen Studie an gesunden Probanden zeigte sich, dass dieses Phänomen wahrscheinlich damit zusammenhängt, dass auf tubulärer Ebene die Kreatininsekretion gehemmt wird; dies ist aber ohne Auswirkung auf die glomeruläre Filtration oder den renalen Blutfluss. Auch bei anderen Medikamenten, wie Cimetidin, Trimethoprim oder Amiodaron wurde derselbe Mechanismus beschrieben. Eine Zunahme des Plasmakreatininwertes könnte falsch interpretiert werden und bei Patienten, die ACE-Inhibitoren oder AII-RAs benötigen, zu einem ungerechtfertigten Absetzen dieser Medikamente führen.
Nach der Marktzulassung wurden Fälle mit einem höheren Kreatininanstieg gemeldet, einschliesslich Fälle prärenaler Azotämie, die infolge einer kongestiven Herzinsuffizienz, einer Hypoperfusion oder einer Hypovolämie auftrat. In der Mehrzahl dieser Fälle war diese Wirkung nach Absetzen von Dronedaron reversibel. Eine regelmässige Kontrolle der Nierenfunktion ist erforderlich, und bei Bedarf sind weitere Untersuchungen zu erwägen.
Elektrolytverschiebung
Da Antiarrhythmika bei Patienten mit Hypokaliämie unwirksam sein oder proarrhythmisch wirken können, sollte jeder Kalium- oder Magnesiummangel vor Beginn und während der Behandlung mit Dronedaron behoben werden.
QT-Zeit-Verlängerung
Die pharmakologische Wirkung von Dronedaron kann eine moderate Verlängerung des QTc-Bazetts (ungefähr 10 ms) im Zusammenhang mit einer verlängerten Repolarisation bewirken. Diese Änderungen sind auf den therapeutischen Effekt von Dronedaron zurückzuführen und spiegeln keine Toxizität wider. Kontrolluntersuchungen, einschliesslich EKG, sind jedoch während der Behandlung empfohlen. Falls das QTc-Bazett-Intervall ≥500 ms beträgt, sollte die Behandlung mit Dronedaron abgesetzt werden. (siehe «Kontraindikationen»).
Die klinischen Erfahrungen mit Dronedaron zeigen einen schwachen proarrhythmischen Effekt. Es zeigte sich eine Abnahme arrhythmisch bedingter Todesfälle in der ATHENA-Studie (siehe «Pharmakodynamik»).
Jedoch können proarrhythmische Effekte in besonderen Situationen auftreten, wie bei gleichzeitiger Anwendung von Arzneimitteln, die Arrhythmien und/ oder Elektrolytstörungen begünstigen (siehe «Warnhinweise und Vorsichtsmassnahmen» sowie «Interaktionen»).
Lungenerkrankungen
Nach der Markteinführung wurden Fälle von interstitieller Lungenerkrankung einschliesslich Pneumopathie und Lungenfibrose gemeldet. Das Auftreten einer Dyspnoe oder eines trockenen Hustens kann mit einer pulmonalen Toxizität einhergehen. Diese Patienten sollten einer sorgfältigen klinischen Untersuchung unterzogen werden. Falls sich der Verdacht auf pulmonale Toxizität bestätigt, sollte die Behandlung beendet werden.
Wechselwirkungen
Digoxin: Bei Patienten unter Digoxin ist eine gleichzeitige Verabreichung von Dronedaron mit einem Anstieg von Digoxin im Plasma verbunden und verstärkt ausserdem die Anzeichen und Symptome einer Digoxin-Toxizität. Empfohlen wird eine klinische, elektrokardiographische und biologische Überwachung und die Halbierung der Digoxin-Dosis. Es ist ausserdem ein Synergieeffekt auf die Herzfrequenz und die atrio-ventrikuläre Reizleitung möglich.
Bei der gleichzeitigen Verabreichung von Betablockern oder Calcium-Antagonisten mit verzögernder Wirkung auf den Sinusknoten und den Atrioventrikularknoten (AV-Knoten) ist Vorsicht geboten. Diese Medikamente müssen mit niedriger Dosis eingeschlichen werden und die Titrierung darf ausschliesslich nach EKG-Kontrolle erfolgen. Bei Patienten, die bei Beginn der Behandlung mit Dronedaron bereits einen Calcium-Antagonisten oder einen Betablocker erhalten, muss ein EKG durchgeführt und die Dosis bei Bedarf entsprechend angepasst werden.
MAO-Inhibitoren können die Clearance des aktiven Metaboliten von Dronedaron vermindern und sollten daher mit Vorsicht angewendet werden.
Antikoagulation
Die Antikoagulation der Patienten sollte gemäss den klinischen Richtlinien für VHF angemessen eingestellt werden. Der International Normalized Ration (INR) sollte nach Beginn der Behandlung mit Dronedaron bei Patienten die Vitamin-K-Antagonisten einnehmen (gemäss den Angaben in deren Fachinformation) engmaschig überwacht werden.
Patienten mit koronarer Herzkrankheit
Bei Patienten mit koronarer Herzkrankheit ist Vorsicht geboten.
Patienten mit Galaktose- und Laktose-Intoleranz
Da Multaq Laktose als Hilfsstoff enthält, sollten Patienten mit Galactose-Intoleranz, Lapp-Lactase-Mangel oder Glucose-Galactose-Malabsorption (seltene Erbkrankheiten) dieses Arzneimittel nicht einnehmen.
Frauen im gebärfähigen Alter
Frauen vor der Menopause, bei denen keine Hysterektomie oder Ovarektomie durchgeführt wurde, müssen während der Behandlung mit Multaq effektive Verhütungsmethoden anwenden. Dronedaron hat in Tierversuchen in den für die Behandlung von Menschen empfohlenen Dosierungen foetotoxisch gewirkt. Man muss also einer Frau im gebärfähigen Alter eine Verhütungsmethode vorschlagen, die sowohl zur Grunderkrankung als auch zum Lebensstil der Patientin passt (siehe «Schwangerschaft, Stillzeit»).
InteraktionenDronedaron wird hauptsächlich durch CYP 3A4 metabolisiert (siehe «Pharmakokinetik»); es ist ein moderater Inhibitor von CYP 3A4 und ein schwacher Inhibitor von CYP 2D6. Somit haben Inhibitoren und Induktoren von CYP 3A4 das Potential mit Dronedaron zu interagieren; umgekehrt kann Dronedaron mit Arzneimitteln interagieren, die Substrate von CYP 3A4 und CYP 2D6 sind. Ausserdem kann Dronedaron den Transport durch P-Glykoprotein (P-gp) hemmen. Dronedaron und/oder seine Metaboliten haben in vitro das Potenzial, auch OAT (Organic Anion Transporter), OATP (Organic Anion Transporting Polypeptide) und OCT (Organic Cation Transporter) zu hemmen.
Dronedaron hat kein signifikantes Potential, CYP 1A2, CYP2C9, CYP 2C19, CYP 2C8 und CYP 2B6 zu hemmen.
Eine mögliche pharmakodynamische Interaktion kann auch mit Betablockern, Calcium-Antagonisten und Digitalis erwartet werden.
Im Rahmen klinischer Studien haben mit Dronedaron behandelte Patienten gleichzeitig verschiedene Medikamente, wie Betablocker, Digitalis, Calcium-Antagonisten (auch solche mit bradikardisierender Wirkung), Statine und orale Antikoagulantien erhalten.
Torsades de Pointes induzierende Arzneimittel
Arzneimittel, die Torsades de Pointes verursachen, wie Phenothiazine, Cisaprid, Bepridil, trizyklische Antidepressiva, bestimmte orale Makrolid-Antibiotika, Terfenadin sowie Klasse-I- und –III-Antiarrhythmika sind aufgrund des potentiellen Risikos, Arrhythmien hervorzurufen, kontraindiziert.
Wirkung anderer Arzneimittel auf Multaq
Starke CYP-3A4-Inhibitoren
Die wiederholte Gabe von täglich 200 mg Ketoconazol ergab eine 17-fache Zunahme der Exposition gegenüber Dronedaron. Somit ist die gleichzeitige Therapie mit Ketoconazol als auch mit anderen CYP-3A4-Inhibitoren, wie z.B. Itraconazol, Voriconazol, Ritonavir, Telithromycin, Clarithromycin oder Ciclosporin kontraindiziert (siehe «Kontraindikationen»).
Moderate/ schwache CYP-3A4-Inhibitoren: Calcium-Antagonisten
Calcium-Antagonisten sind Substrate und/ oder schwache Inhibitoren von CYP 3A4. Diejenigen, die herzfrequenzsenkende Eigenschaften haben, können ausserdem auf pharmakodynamischer Ebene mit Multaq interagieren.
Die wiederholte Gabe von Diltiazem (240 mg zweimal täglich), Verapamil (240 mg einmal täglich) und Nifedipin (20 mg zweimal täglich) resultierte in einer Zunahme der Dronedaron-Exposition um den Faktor 1,7, 1,4 und 1,2. Die Exposition gegenüber Calcium-Antagonisten wird auch durch Dronedaron (400 mg zweimal täglich) erhöht (Verapamil um das 1,4-fache und Nisoldipin um das 1,5-fache). Bezüglich der gleichzeitigen Verabreichung von Dronedaron und Calcium-Antagonisten mit herzfrequenzsenkender Eigenschaft ergab sich in klinischen Studien kein Anhalt für ein erhöhtes Sicherheitsrisiko.
Aufgrund pharmakokinetischer und möglicher pharmakodynamischer Interaktionen sollten im Allgemeinen Calcium-Antagonisten mit hemmendem Effekt auf den Sinus- und AV-Knoten, wie z.B. Verapamil und Diltiazem, nur mit Vorsicht zusammen mit Dronedaron angewendet werden.
Erythromycin
Andere moderate CYP3A4-Inhibitoren erhöhen möglicherweise auch die Dronedaron-Exposition. Erythromycin, ein orales Makrolid, kann Torsades de Pointes auslösen und ist daher kontraindiziert (siehe «Kontraindikationen»). Die wiederholte Gabe von Erythromycin (500 mg dreimal täglich während einer Dauer von 10 Tagen) hat die Dronedaron-Exposition um den Faktor 3,8 im Verhältnis zu einem ausgeglichenen Spiegel erhöht.
CYP-3A4-Induktoren
Rifampicin (600 mg einmal täglich) senkte die Dronedaron-Exposition um 80 % ohne grosse Veränderung der Exposition gegenüber dem aktiven Metaboliten. Daher wird die gleichzeitige Anwendung von Rifampicin und anderer potenter CYP-3A4-Induktoren wie Phenobarbital, Carbamazepin, Phenytoin oder Johanniskraut nicht empfohlen, da sie die Exposition gegenüber Dronedaron senken.
Auswirkungen von Multaq auf andere Arzneimittel
Interaktionen mit Arzneimitteln, die über CYP 3A4 metabolisiert werden
·Statine als Substrate für CYP 3A4 und/ oder P-Glykoprotein
Dronedaron kann die Exposition gegenüber Statinen, die Substrate von CYP 3A4 und/oder P-Gp Substrate sind, erhöhen. Dronedaron (400 mg zweimal täglich) erhöhte die Simvastatin- und Simvastatinsäure-Exposition um den Faktor 4 bzw. 2. Es ist anzunehmen, dass Dronedaron die Exposition gegenüber Lovastatin, Atorvastatin und Pravastatin im vergleichbaren Rahmen wie die Simvastatinsäure erhöht. Es hat sich eine schwache Interaktion zwischen Dronedaron und Atorvastatin (Faktor 1,7) gezeigt. Klinische Studien, in denen Dronedaron zusammen mit Statinen, die über CYP 3A4 metabolisiert werden, gegeben wurde, ergaben keinen Hinweis auf Sicherheitsbedenken.
Es hat sich eine schwache Interaktion zwischen Dronedaron und den vom OATP transportierten Statinen wie z.B. Rosuvastatin (Faktor 1,4) gezeigt.
Wegen der zahlreichen Interaktionsmöglichkeiten mit Statinen (CYP und Transporter) und da hohe Statindosen das Risiko einer Myopathie erhöhen, sollte die gleichzeitige Therapie mit Statinen mit Vorsicht durchgeführt werden.
Niedrigere Anfangsdosen und Erhaltungsdosen der Statine sollten entsprechend den Empfehlungen der Fachinformation für die Statinen erwogen und die Patienten bezüglich klinischer Zeichen muskulärer Toxizität überwacht werden.
·Calcium-Antagonisten
Die Interaktion von Dronedaron mit Calciumantagonisten wurde weiter oben beschrieben.
·Sirolimus, Tacrolimus
Dronedaron kann die Plasmakonzentrationen von Tacrolimus und Sirolimus erhöhen. Eine Überwachung ihrer Plasmakonzentrationen und eine angemessene Dosisanpassung werden für den Fall einer gleichzeitigen Anwendung von Dronedaron empfohlen.
·Orale Kontrazeptiva
Es wurde keine Abnahme von Ethinylestradiol und Levonorgestrel bei gesunden Probanden beobachtet, die gleichzeitig Dronedaron (800 mg zweimal täglich) und orale Kontrazeptiva erhalten hatten.
Interaktionen mit Arzneimitteln, die über CYP 2D6 metabolisiert werden: Betablocker, Antidepressiva
·Betablocker
Dronedaron kann die Exposition gegenüber Betablockern erhöhen, die durch CYP 2D6 metabolisiert werden. Ausserdem haben aus pharmakodynamischer Sicht Betablocker das Potential, mit Dronedaron zu interagieren. Dronedaron, 800 mg täglich, erhöhte die Metoprolol-Exposition um das 1,6-fache und gegenüber Propranolol um das 1,3-fache (d.h. deutlich geringer als der 6-fache Unterschied, der zwischen schwachen und starken CYP 2D6-Metabolisierern gefunden wurde). In klinischen Studien wurde häufiger eine Bradykardie beobachtet, wenn Dronedaron in Kombination mit Betablockern gegeben wurde.
Aufgrund der pharmakokinetischen und der möglichen pharmakodynamischen Interaktion sollten Betablocker mit Vorsicht zusammen mit Dronedaron angewendet werden.
·Antidepressiva
Da Dronedaron ein schwacher Inhibitor von CYP 2D6 beim Menschen ist, ist von einem begrenzten Einfluss auf Antidepressiva, die von CYP 2D6 metabolisiert werden, auszugehen.
Interaktionen mit P-gp-Substraten
·Digoxin
Dronedaron (400 mg zweimal täglich) erhöhte die Digoxin-Exposition um den Faktor 2,5 durch Inhibition des P-gp-Transporters. Ausserdem hat Digitalis aus pharmakodynamischer Sicht das Potential mit Dronedaron zu interagieren. In klinischen Studien wurden bei gemeinsamer Gabe von Dronedaron und Digitalis erhöhte Spiegel von Digitalis und/ oder gastrointestinale Störungen beobachtet.
Aufgrund der pharmakokinetischen und der möglichen pharmakodynamischen Interaktion sollte die gemeinsame Gabe von Digoxin und Dronedaron nur mit Vorsicht erfolgen; die Digoxin-Konzentration im Plasma sollte, vor allem in der ersten Woche der Komedikation, engmaschig überwacht werden. Des Weiteren werden klinische sowie EKG-Kontrollen empfohlen und bei Bedarf eine Anpassung der Digoxindosis.
·Dabigatran
Dronedaron kann die Dabigatran-Exposition durch Hemmung von P-gp erhöhen. Daher wird empfohlen, bei gleichzeitiger Verabreichung eine Abschätzung der Risiken für thromboembolische Ereignisse und Blutungen vorzunehmen. Die Dabigatran-Exposition 150 mg einmal täglich ist bei gleichzeitiger Gabe mit Dronedaron (400 mg zweimal täglich) um das 1,7- bis 2-fache erhöht. Eine retrospektive Kohortenstudie in den Vereinigten Staaten (USA) ergab, dass die gleichzeitige Anwendung von Dabigatran und Dronedaron bei Patienten mit nicht-valvulärem Vorhofflimmern (NVAF) im Vergleich zur Anwendung von Dabigatran allein nicht zu einem erhöhten Risiko für Blutungen mit stationärer Behandlungspflicht führte. Bei den gleichzeitig mit Dabigatran und Dronedaron behandelten Patienten wurde ein erhöhtes Risiko für gastrointestinale Blutungen beobachtet. Die gleichzeitige Anwendung von Dabigatran wird nicht empfohlen.
·Andere P-gp-Substrate
Da Dronedaron P-gp inhibiert, kann es zu Interaktionen mit Doxorubicin, Fexofenadin und Talinolol kommen.
Interaktion mit CYP3A4- und P-gp-Substraten
Dronedaron kann durch Hemmung von P-gp oder CYP3A4 die Exposition gegenüber Faktor-Xa-Inhibitoren erhöhen. Daher ist bei gleichzeitiger Verabreichung eine Abschätzung der Risiken für thromboembolische Ereignisse und Blutungen erforderlich. Eine Dosisreduktion gemäss den Empfehlungen der jeweiligen Fachinformation sollte in Betracht gezogen werden.
·Faktor-Xa-Inhibitoren:
Rivaroxaban
Dronedaron kann die Rivaroxaban-Exposition erhöhen, daher kann eine gleichzeitige Anwendung das Blutungsrisiko erhöhen.
Apixaban
Dronedaron kann die Apixaban-Exposition erhöhen. Dennoch ist bei gleichzeitiger Verabreichung mit Wirkstoffen, die keine starken Inhibitoren von CYP3A4 und P-gp sind, wie Dronedaron, gemäss der Fachinformation keine Dosisanpassung erforderlich.
Edoxaban
Die gleichzeitige Verabreichung von Dronedaron 400 mg einmal täglich über 7 Tage mit einer Einzeldosis Edoxaban 60 mg an Tag 5 führte zu einer Erhöhung der AUC um 85% und der Cmax um 46 %. Die Dosis Edoxaban muss gemäss den Empfehlungen der Fachinformation von Edoxaban reduziert werden.
Interaktion mit Warfarin und Losartan (CYP2C9-Substrate)
·Warfarin und andere Vitamin-K-Antagonisten
Es werden Kontrollen des INR-Werts empfohlen, insbesondere in den ersten 1-2 Wochen zu Beginn der Behandlung mit Dronedaron.
In der ATHENA-Studie hat sich im Vergleich zur Placebo-Gruppe bei einer höheren Anzahl der mit einem oral verabreichten Antikoagulanten behandelten Patienten eine klinisch signifikante Erhöhung (≥5) des INR-Werts gezeigt, im Allgemeinen 1 Woche nach Beginn der Einnahme von Dronedaron. Dennoch wurde kein übermässiges Blutungsrisiko in der Dronedaron-Gruppe beobachtet. In einer Interaktionsstudie hat Dronedaron (600 mg zweimal täglich) den S-Warfarin-Wert um den Faktor 1,2 erhöht, ohne das R-Warfarin zu verändern. Dabei war die International Normalized Ratio (INR) lediglich um den Faktor 1,07 erhöht.
In spontanen Meldungen im Rahmen der Pharmakovigilanz wurden Fälle von erhöhten INR-Werten mit oder ohne hämorrhagisches Ereignis bei Patienten unter oralen Vitamin-K-Antagonisten, die mit der Einnahme von Dronedaron begonnen hatten, gemeldet.
·Losartan und andere Angiotensin-II-Rezeptor-Antagonisten (AIIRA)
Es wurde keine Interaktion zwischen Dronedaron und Losartan beobachtet und ist auch bei anderen ARA II kaum zu erwarten.
Interaktionen mit Theophyllin (CYP-1A2-Substrat)
Dronedaron 400 mg zweimal täglich erhöhte nicht die Theophyllin-Exposition im Steady-State.
Interaktionen mit Metformin (OCT1- und OCT2-Substrat)
Dronedaron hat aus klinischer Sicht keinen dauerhaften Einfluss auf die Pharmakokinetik von Metformin. Der Einfluss von Metformin auf die Pharmakokinetik von Dronedaron wurde nicht untersucht, da keinerlei Interaktion zu erwarten ist.
Interaktionen mit Omeprazol (Substrat von CYP2C19)
Zwischen Dronedaron und Omeprazol, einem Substrat von CYP2C19, wurden keinerlei Interaktionen beobachtet.
Interaktionen mit Clopidogrel
Zwischen Dronedaron und Clopidogrel wurden keinerlei Interaktionen beobachtet.
Weitere Informationen
Die Gabe von Pantoprazol (40 mg einmal täglich), ein Arzneimittel, das den pH-Wert im Magen ohne Effekt auf Cytochrom P450 erhöht, hat keinen signifikanten Einfluss auf die Pharmakokinetik von Dronedaron.
Grapefruit-Saft (CYP 3A4-Inhibitor)
Wiederholte Gabe von 300 ml Grapefruit-Saft dreimal täglich ergab eine 3-fache Steigerung der Dronedaron-Exposition. Somit sollten Patienten angehalten werden, während der Einnahme von Dronedaron Grapefruitsaftgetränke zu vermeiden.
Schwangerschaft, StillzeitEs liegen keine hinreichenden Daten für die Anwendung von Dronedaron bei Schwangeren vor. Tierexperimentelle Studien haben reproduktionstoxische Effekte gezeigt (Teratogenität bei der Ratte) (siehe «Präklinische Daten»). Dronedaron ist in der Schwangerschaft kontraindiziert. (siehe «Kontraindikationen»).
Frauen im gebärfähigen Alter sollten effektive Verhütungsmethoden während der Behandlung mit Multaq anwenden.
Es ist nicht bekannt, ob Dronedaron beim Menschen in die Muttermilch übergeht.
Tierexperimentelle Studien haben einen Übergang von Dronedaron und seinen Metaboliten in die Muttermilch gezeigt. Frauen sollten nicht stillen, wenn sie mit Multaq behandelt werden (siehe «Kontraindikationen»).
In tierexperimentellen Studien zeigte Dronedaron keine Beeinflussung der Fruchtbarkeit.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs wurden keine Studien zu den Auswirkungen auf die Fahrtüchtigkeit und das Bedienen von Maschinen durchgeführt.
Unerwünschte WirkungenDas Sicherheitsprofil von Dronedaron 400 mg zweimal täglich bei Patienten mit Vorhofflimmern (VHF) oder Vorhofflattern (VFL) basiert auf fünf placebokontrollierten Studien: ATHENA, EURIDIS, ADONIS, ERATO und DAFNE. Insgesamt wurden 6 285 Patienten randomisiert und behandelt; 3 282 Patienten erhielten Dronedaron 400 mg zweimal täglich und 2 875 erhielten Placebo.
Die mittlere Exposition für alle Studien war 13 Monate. In der ATHENA-Studie war die längste Follow-up-Phase 30 Monate.
Die Bewertung des Einflusses intrinsischer Faktoren wie Geschlecht oder Alter auf behandlungsbedingte unerwünschte Wirkungen erbrachte keinen Hinweis darauf, dass eine der Untergruppen stärker betroffen sei.
In klinischen Studien brachen 11,8 % der mit Dronedaron behandelten Patienten und 7,7 % der mit Placebo behandelten Patienten vorzeitig aufgrund von unerwünschten Wirkungen ab. Der häufigste Grund für den Abbruch der Behandlung mit Multaq waren gastrointestinale Störungen (3,2 % der Patienten versus 1,8 % in der Placebo-Gruppe).
Die in den fünf Studien mit Dronedaron 400 mg zweimal täglich am häufigsten beobachteten unerwünschten Wirkungen waren Diarrhoe, Übelkeit und Erbrechen, Müdigkeit und Asthenie.
Die unerwünschten Wirkungen von Dronedaron 400 mg zweimal täglich bei VHF- oder VFL-Patienten sind geordnet nach Organsystemen und nach abnehmender Häufigkeit aufgeführt.
Unerwünschte Wirkungen, die zum Abschnitt «Untersuchungen» gehören, werden getrennt beschrieben.
Die Häufigkeiten sind definiert als: sehr häufig (≥1/10), häufig (≥1/100 bis < 1/10), gelegentlich (≥1/1'000 bis < 1/100), selten (≥1/10'000 bis < 1/1'000), sehr selten (< 1/10'000).
Innerhalb jeder Häufigkeitsgruppe werden die unerwünschten Wirkungen nach abnehmendem Schweregrad aufgeführt.
Funktionsstörungen des Herzens
Sehr häufig: Herzinsuffizienz. In den fünf placebokontrollierten Studien war die Inzidenz einer Herzinsuffizienz in der Dronedaron-Gruppe vergleichbar mit der in der Placebo-Gruppe (sehr häufig, 11,2 % vs. 10,9 %). Diese Häufigkeit sollte vor dem Hintergrund eines grundlegend erhöhten Auftretens einer Herzinsuffizienz bei Patienten mit VHF betrachtet werden.
Fälle von Herzinsuffizienz wurden ebenfalls nach der Markteinführung gemeldet (Häufigkeit nicht bekannt): siehe «Warnhinweise und Vorsichtsmassnahmen».
Häufig: Bradykardie.
Selten: Vorhofflattern mit aurikulär-ventrikulärer Assoziation im Verhältnis 1:1
Atmungsstörungen
Gelegentlich: interstitielle Lungenerkrankungen einschliesslich interstitielle Pneumopathien und Lungenfibrosen. In den 5 placebokontrollierten Studien zeigten 0,6% der Patienten in der Dronedaron-Gruppe Lungenereignisse im Vergleich zu 0,8% in der Placebo-Gruppe. Seit der Markteinführung von Multaq wurden Fälle mit interstitiellen Lungenerkrankungen einschliesslich interstitieller Pneumopathien und Lungenfibrosen berichtet (Häufigkeit unbekannt). Ein Teil der Patienten hatte vorher Amiodaron erhalten.
Störungen des Nervensystems
Häufig: Dysgeusie.
Selten: Ageusie.
Gastro-intestinale Störungen
Häufig: Diarrhoe, Erbrechen, Übelkeit, Abdominalschmerzen, Dyspepsie.
Funktionsstörungen der Leber und der Galle (siehe «Warnhinweise und Vorsichtsmassnahmen»)
Häufig: Abnorme Leberwerte.
Selten: Leberzellschädigung einschliesslich lebensbedrohlicher akuter Leberinsuffizienz.
Kardiovaskuläre Störungen
Selten: Vaskulitis, einschliesslich leukozytoklastischer Vaskulitis.
Funktionsstörungen der Haut und des Unterhautzellgewebes
Häufig: Ausschlag (einschliesslich generalisierter, makulöser, makulo-papulöser Formen), Juckreiz.
Gelegentlich: Erytheme (einschliesslich Erythem und erythematösem Hautausschlag), Ekzem, Photodermatose, Allergische Dermatitis, Dermatitis.
Allgemeine Störungen und Reaktionen an der Applikationstelle
Häufig: Müdigkeit, Asthenie.
Störungen des Immunsystems
In seltenen Fällen: anaphylaktische Reaktionen einschliesslich Angioödem.
Des Weiteren treten folgende Labor- und EKG-Befunde sehr häufig (> 1/10) auf unter Dronedaron 400 mg zweimal täglich:
·Plasmakreatininspiegel um ≥10% erhöht, fünf Tage nach Behandlungsbeginn
·QTc Bazett Intervall ist verlängert (> 450 ms bei Männern, > 470 ms bei Frauen).
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungEs ist nicht bekannt, ob Dronedaron und/ oder seine Metaboliten mit Hilfe von Dialyse entfernt werden können (Hämodialyse, peritoneale Dialyse oder Hämofiltration).
Es steht kein spezifisches Antidot zur Verfügung. Im Falle einer Überdosierung sollte eine unterstützende Behandlung erfolgen und darauf abzielen, die Symptome zu mildern.
Eigenschaften/WirkungenATC-Code
C01BD07
Wirkungsmechanismus
Der genaue Wirkungsmechanismus beim Menschen ist für Dronedaron nicht bekannt. Dronedaron hat antiarrhythmische Eigenschaften, die allen vier Vaughan-Williams Klasse zuzuordnen sind; allerdings ist der jeweilige Anteil dieser Eigenschaften auf die klinische Wirkung unbekannt. Im Tiermodell verhindert Dronedaron Vorhofflimmern oder stellt den normalen Sinusrhythmus, abhängig vom verwendeten Modell, wieder her. Es verhindert in mehreren Tiermodellen ausserdem ventrikuläre Tachykardien und Kammerflimmern. Diese Effekte beruhen höchstwahrscheinlich auf den elektrophysiologischen Eigenschaften, die allen vier Vaughan-Williams Klasse zuzuordnen sind. Dronedaron ist ein Mehrkanalblocker, der den Kaliumstrom hemmt (inklusive IK(ACh), IKur, IKr und IKs) und das Aktionspotential des Herzens und die Refraktärzeit (Klasse III) verlängert. Es hemmt auch den Natrium- (Klasse I) und den Calciumstrom (Klasse IV). Dronedaron ist ein nicht-kompetetiver Antagonist adrenerger Aktivität (Klasse II).
Pharmakodynamik
In Tiermodellen reduziert Dronedaron die Herzfrequenz. Es verlängert die Wenckebach-Periodizität und AH-, PQ- und QT-Intervalle, ist aber ohne merklichen Effekt oder verlängert die QTc-, HV- und QRS-Intervalle nur wenig. Es steigert die effektive Refraktärzeit (ERZ) des Atriums und des AV-Knotens; die ERZ des Ventrikels wurde geringfügig verlängert mit einer minimalen ‚ Reverse-use Dependency.
Dronedaron senkt den arteriellen Blutdruck und die Myokardkontraktilität (dP/dt max) ohne Einfluss auf die linksventrikuläre Auswurffraktion und reduziert den myokardialen Sauerstoffverbrauch.
Dronedaron hat vasodilatatorische Eigenschaften, in koronaren Arterien mehr (durch die Aktivierung des NO-Stoffwechselweges) als in peripheren Arterien.
Dronedaron zeigt indirekte anti-adrenerge Effekte. Es verringert die alpha-adrenerge Blutdruck-Reaktion auf Epinephrin und die beta1- und beta2-Antwort auf Isoproterenol.
Klinische Wirksamkeit
Verringerung des Risikos von Hospitalisierung aufgrund kardiovaskulärer Ursachen oder Tod
Die Wirksamkeit von Dronedaron bzgl. der Verringerung des Risikos von Hospitalisierung aufgrund kardiovaskulärer Ursachen oder Tod jeglicher Ursache wurde an Patienten mit VHF oder einer Vorgeschichte von VHF und zusätzlichen Risikofaktoren in der multizentrischen, multinationalen, doppelt verblindeten und randomisierten, placebokontrollierten ATHENA Studie gezeigt.
Die Patienten mussten zumindest einen Risikofaktor (Alter, Hypertonie, Diabetes, vorheriges zerebrovaskuläres Ereignis, Durchmesser des linken Atriums ≥50 mm oder LVEF < 0,40) sowie dokumentierte Belege von VHF/ VFL und Sinusrhythmus während der letzten 6 Monate aufweisen. Patienten konnten sich im VHF/ VFL oder nach spontaner oder medizinischer Konversion jeglicher Methode im Sinusrhythmus befinden.
Viertausend sechshundert achtundzwanzig (4 628) Patienten wurden randomisiert und wurden bis zu maximal 30 Monaten (Follow-up im Mittel: 22 Monate) entweder mit Dronedaron 400 mg zweimal täglich (2 301 Patienten) oder Placebo (2 327 Patienten) zusätzlich zur konventionellen Therapie behandelt. Letztere schloss Betablocker (71%), ACE-Inhibitoren oder Angiotensin II-Rezeptor-Antagonisten (69%), Digitalis (14%), Calcium-Antagonisten (14%), Statine (39%), orale Antikoagulanzien (60%), dauerhafte Behandlung mit Thrombozytenaggregationshemmern (5%) und/ oder Diurektia (54%) ein.
Der primäre Endpunkt der Studie war die erste Hospitalisierung aufgrund kardiovaskulärer Ursachen oder Tod jeglicher Ursache.
Die präspezifizierten sekundären Endpunkte waren Tod jeglicher Ursache, kardiovaskulär bedingte Hospitalisierung oder Tod aus kardiovaskulären Gründen.
Auch das Auftreten von plötzlichem Herztod wurde evaluiert.
Das Alter der Patienten lag zwischen 23 und 97 Jahre und 42% waren über 75 Jahre alt. 47% der Patienten waren weiblich und in der Mehrzahl Kaukasier (89%).
Ein Grossteil wies eine Hypertonie (86%) und eine strukturelle Herzerkrankung (60%) auf (dies schliesst die koronare Herzkrankheit: 30%, kongestive Herzinsuffizienz: 30%, linksventrikuläre Dysfunktion mit LVEF < 45%: 12% ein). 25% hatten Vorhofflimmern zum Zeitpunkt des Einschlusses.
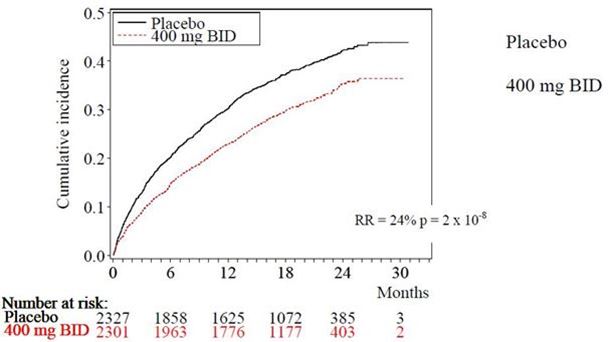
Dronedaron verringerte das Auftreten von Hospitalisierung aufgrund kardiovaskulärer Ursachen oder Tod jeglicher Ursache um 24,2% im Vergleich zu Placebo (p = 2 x 10-8).
Abbildung 1 stellt die Kurven zur kumulierten Inzidenz dar. Die Kurven trennen sich früh und verlaufen auch während der 30 monatigen Follow-up-Zeit weiter divergierend.
Abbildung 1 – Kumulative Inzidenz nach Kaplan-Meier, von der Randomisierung bis zur ersten Hospitalisierung aufgrund kardiovaskulärer Ursache oder Tod jeglicher Ursache
Die Abnahme nötiger Hospitalisierung aufgrund kardiovaskulärer Ursachen oder Tod jeglicher Ursache war in allen Untergruppen übereinstimmend, unabhängig von den Charakteristika der Patienten zu Beginn der Untersuchung oder der Medikation (ACE-Inhibitoren oder Angiotension II-Rezeptor-Antagonisten; Betablocker, Digitalis, Statine, Calcium-Antagonisten, Diuretika) (siehe Abbildung 2).
Abbildung 2 – Schätzer für das relative Risiko (Dronedaron 400 mg zweimal täglich gegenüber Placebo) für die erste Hospitalisierung aufgrund kardiovaskulärer Ursachen oder Tod jeglicher Ursache bezogen auf ausgewählte Basischarakteristika mit 95% Konfidenzintervallen (KI)
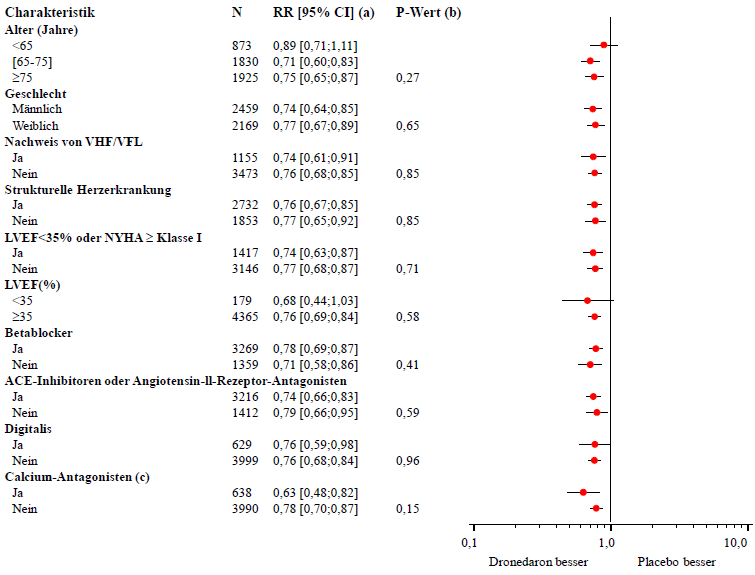
a Bestimmt mit dem Cox-Regressionsmodell
b P-Werte zum Test auf Interaktion zwischen Basischarakteristika und Behandlung basierend auf dem Cox-Regressionsmodell.
c Calcium-Antagonisten mit Herzfrequenz senkendem Effekt, beschränkt auf Diltiazem, Verapamil und Bepridil.
Ähnliche Ergebnisse wurden bei der Häufigkeit kardiovaskulärer Hospitalisierung mit einer Risikoreduzierung von 25,5% (p = 9 x 10-9) erzielt.
Zwar steht die Senkung der Hospitalisierungen wegen VHF im Vordergrund; Dronedaron senkt aber mit 14,5% auch signifikant im Vergleich zu Pacebo (p=0,0162) das Risiko erstmaliger kardiovaskulär bedingter, aber nicht VHF/ VFL- bedingter Hospitalisierung.
Die Dronedaron-Gruppe zeigte ausserdem eine niedrigere Hospitalisierungsrate wegen Verschlechterung einer kongestiven Herzinsuffizienz [3,4% gegenüber 4,0% (Placebo)], Myokardinfarkt oder instabiler Angina pectoris [2,1% gegenüber 2,6% (Placebo)] sowie einer TIA oder eines zerebrovaskulären Ereignisses [1,2% gegenüber 1,5% (Placebo)].
Die Hospitalisierungsraten wegen ausgeprägter Blutung [0,9% gegenüber 1% (Placebo)], Synkope [0,9% gegenüber 1% (Placebo)] oder ventrikulärer Arrhythmie (einschliesslich Extrasystolen, Tachykardie, Fibrillation und anderer ventrikulärer Arrhythmien) [0,4% gegenüber 0,3% (Placebo)] waren in beiden Gruppen ähnlich.
Ausserdem lag die im Hospitalisierungsdauer unter Dronedaron unter der Dauer bei Gabe von Placebo [9 995 Behandlungstage gegenüber 13 986 (Placebo)]; vor allem die intensivmedizinischen/ kardiologischen Behandlungstage wegen kardiovaskulärer Probleme wurden deutlich reduziert (47%).
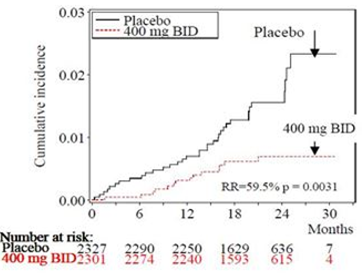
In der Dronedaron-Gruppe 400 mg zweimal täglich traten weniger Todesfälle auf [n = 116 gegenüber 139 (Placebo), was einer Risikosenkung von 15.6%, p = 0,176 entspricht]. Das Risiko, an kardiovaskulärer Ursache zu versterben war um 30.2% gesenkt [p = 0,025; 2,8% gegenüber 4,0% (Placebo)]. Hauptursache dieser Beobachtung war das um 59,5% gesenkte Risiko, am plötzlichen Herztod zu versterben [p = 0,0031; 0,6% gegenüber 1,5% (Placebo)] sowie das um 38,3% gesenkte Risiko, im Rahmen eines zerebrovaskulären Ereignisses zu versterben [p = 0,2021; 0,5% gegenüber 0,8% (Placebo)].
Die Verläufe der kumulierten Inzidenz nach Kaplan-Meier (siehe Abbildungen 3 und 4) beziehen sich auf den Zeitraum von der Randomisierung bis zum kardiovaskulär bedingten Tod und sprechen für einen frühzeitigen und anhaltenden Effekt des Dronedarons auf die Mortalität.
Abbildung 3 - Kumulative Inzidenz nach Kaplan-Meier; von der Randomisierung bis zum Tod aufgrund kardiovaskulärer Ursache während der Studie
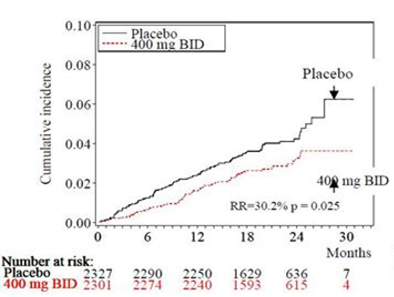
Abbildung 4 – Kumulative Inzidenz nach Kaplan-Meier der Fälle von plötzlichem Herztod während der Studie
Aufrechterhaltung des Sinusrhythmus
In EURIDIS und ADONIS wurden insgesamt 1 237 Patienten mit einer vorherigen VHF- oder VFL-Episode für eine ambulante Behandlung randomisiert und entweder mit Dronedaron 400 mg zweimal täglich (n = 828) oder Placebo (n = 409) zusätzlich zur konventionellen Therapie behandelt (einschliesslich oraler Antikoagulanzien, Betablockern, ACE-Inhibitoren oder Angiotensin II-Rezeptor-Antagonisten, Thrombozytenaggregationshemmern, Diuretika, Statinen, Digitalis und Calcium-Antagonisten). Die Patienten hatten mindestens eine durch EKG nachgewiesene VHF- oder VFL-Episode während der letzten 3 Monate, waren seit mindestens einer Stunde im Sinusrhythmus und wurden über die nächsten 12 Monate beobachtet.
Das Alter der Patienten lag zwischen 20 und 88 Jahren, mit einer Mehrzahl an Kaukasiern (97%) und männlichen Patienten (69%). Die häufigsten Begleiterkrankungen waren Hypertonie (56,8%) und strukturelle Herzerkrankungen (41,5%) einschliesslich koronarer Herzerkrankung (21,8%).
Sowohl in den gepoolten Daten aus EURIDIS und ADONIS als auch in den einzelnen Studien selbst verzögerte Dronedaron durchgängig die Zeit bis zum ersten Wiederauftreten von VHF/ VFL (primärer Endpunkt). Im Vergleich zu Placebo senkte Dronedaron das Risiko des ersten Wiederauftretens von VHF/ VFL während der 12-monatigen Studiendauer um 25,5% (p = 0.00007). Die durchschnittliche Zeit (Median) von der Randomisierung bis zum ersten Wiederauftreten von VHF oder VFL waren 116 Tage, d.h. 2,2-fach länger als in der Placebo-Gruppe (53 Tage). Die Mehrzahl (60%) der ersten Rückfälle waren klinisch symptomatisch. Unter Dronedaron verlängerte sich in beiden Studien ebenfalls der Zeitraum bis zum ersten symptomatischen Wiederauftreten von VHF oder VFL (p = 0.0003). Unter Dronedaron 400 mg zweimal täglich lag der Anteil an Patienten, bei denen nach einem Jahr noch kein symptomatisches Wiederauftreten von VHF oder VFL zu verzeichnen war bei 62,3%.
Bei DAFNE wurde vor der Kardioversion mit Dronedaron begonnen; das Wiederauftreten von VHF, welches durch transtelefonisches elektokardiographisches 12-Kanal-Monitoring (TTEM) diagnostiziert wurde, lag für Dronedaron 400 mg zweimal täglich bei 60 Tagen gegenüber 5 Tagen in der Placebo-Gruppe. Dronedaron 400 mg zweimal täglich senkte das Risiko für Wiederauftreten von VHF während der 6-monatigen Studienzeit im Vergleich zu den Ergebnissen unter Placebo um 55% (p = 0,001).
Andromeda-Studie
Patienten, die kurz zuvor wegen symptomatischer Herzinsuffizienz und schwerer, systolischer, linksventrikulärer Dysfunktion (Motilitätsindex der Wand ≤1,2) hospitalisiert worden waren, wurden randomisiert und erhielten entweder Multaq 400 mg zweimal täglich oder ein adäquates Placebo; primärer Studienendpunkt waren Tod jeglicher Ursache und Hospitalisierung wegen Herzinsuffizienz. Nach Rekrutierung von 627 der zunächst 1000 vorgesehenen Patienten (310 in der Dronedaron- bzw. 317 in der Placebo-Gruppe) und einem mittleren Follow-up (Median) von 63 Tagen wurde die Studie wegen der höheren Mortalitätsrate in der Dronedaron-Gruppe abgebrochen.
25 Patienten der Dronedaron-Gruppe (8,1 %) verstarben; in der Placebo-Gruppe waren es 12 (3,8 %), (RR 2,13; KI 95 %: 1,07 bis 4,25; p = 0,027). Hauptsächliche Todesursache war die Verschlechterung einer Herzinsuffizienz. Ausserdem wurden in der Dronedaron-Gruppe auch viele Hospitalisierungen aus kardiovaskulärer Gründen nötig (71 gegenüber 51 unter Placebo) [siehe «Kontraindikationen»].
Die Patientenpopulationen, die für die ANDROMEDA und ATHENA Studien rekrutiert wurden waren signifikant unterschiedlich. Patienten der ANDROMEDA Studie litten unter relativ schwerer Herzinsuffizienz und waren schon wegen Verschlechterung der Symptome ihrer Herzinsuffizienz, vor allem wegen Dyspnoe, hospitalisiert oder fachärztlich vorgestellt worden. Ihr klinischer Zustand hatte sich evtl. zum Zeitpunkt ihres Einschlusses in die Studie gebessert; im Weiteren waren sie aber durch den Verlauf ihrer Dekompensation charakterisiert. Patienten der ANDROMEDA-Studie waren hauptsächlich in den Stadien NYHA II (40 %) und III (57 %); nur 38 % wiesen in der Vorgeschichte ein Vorhofflimmern oder Vorhofflattern (VHF/ VFL) auf (25 % hatten VHF zum Zeitpunkt der Randomisierung). Auf der anderen Seite hatten in der ATHENA-Studie 71 % der Patienten keine Herzinsuffizienz, 25 % der Teilnehmer waren dem NYHA-Stadium I oder II zuzuordnen und nur 4 % dem Stadium NYHA III. Hier hatten alle Patienten VHF/ VFL in der Anamnese.
Patienten mit permanentem VHF
Die PALLAS-Studie war eine randomisierte placebokontrollierte Studie zur Untersuchung des klinischen Nutzens von Dronedaron (400 mg zweimal täglich) zusätzlich zur Standarttherapie bei Patienten mit permanentem VHF und Kardiovaskulären Risikofaktoren (ca. 68 % der Patienten zeigten eine Herzinsuffizienz, 41 % eine koronare Herzkrankheit, 28 % ein zurückliegendes zerebrovaskuläres Ereignis oder einen vorübergehenden ischämischen Insult, 21 % einen linksventrikulären systolischen Ausstoss von ≤40 % und 18 % der Patienten im Alter von ≥75 Jahren litten an Diabetes und Hypertonie). Die Studie musste nach der Randomisierung von 3 236 Patienten aufgrund eines signifikant erhöhten Auftretens von Herzinsuffizienz (HR 2,16: 1,57 – 2,98), Schlaganfall (HR 2,32: 1,11 – 4,88) und kardiovaskulär bedingtem Tod (HR 2,11: 1,00 – 4,49) in der Dronedaron-Gruppe vorzeitig abgebrochen werden (siehe «Kontraindikationen» sowie «Vorsichtsmassnahmen und Warnhinweise»).
PharmakokinetikAbsorption
Dronedaron wird, mit der Mahlzeit eingenommen, gut resorbiert (mindestens 70%). Aufgrund des First-pass-Effekts beträgt jedoch die absolute Bioverfügbarkeit von Dronedaron 15% (zusammen mit Mahlzeiten eingenommen). Mit der Mahlzeit eingenommen steigt die Bioverfügbarkeit um einen durchschnittlichen Faktor von 2 bis 4. Nach oraler Gabe mit der Mahlzeit wird die höchste Plasmakonzentration von Dronedaron und seinem hauptsächlichen, zirkulierenden, aktiven Metaboliten (N-Debutyl-Metabolit) innerhalb von 3 bis 6 Stunden erreicht. Nach wiederholter Gabe von 400 mg zweimal täglich, wird der Steady-State innerhalb von 4 bis 8 Tagen Behandlungsdauer erreicht und das mittlere Akkumulationsverhältnis von Dronedaron reicht von 2,6 bis 4,5. Der Mittelwert Cmax von Dronedaron beträgt im Steady-State 84-147 ng/ml und die Exposition gegenüber dem hauptsächlichen N-Debutyl-Metaboliten ist vergleichbar mit jener gegenüber der Ausgangsverbindung. Die Pharmakokinetik von Dronedaron und seines N-Debutyl-Metaboliten weicht leicht von der Dosis-Proportionalität ab: Eine Verdopplung der Dosierung ergibt ungefähr eine 2,5- bis 3,0-fache Steigerung hinsichtlich Cmax und AUC.
Distribution
Die in-vitro Plasmaproteinbindung von Dronedaron und seines N-Debutyl-Metaboliten beträgt >98% und kann nicht gesättigt werden. Beide Verbindungen binden hauptsächlich an Albumin. Nach intravenöser Gabe (i.v.) reicht das Verteilungsvolumen im Steady-State (Vss) von 1200 bis 1400 l.
Metabolismus
Dronedaron wird umfangreich metabolisiert, hauptsächlich durch CYP 3A4 (siehe «Interaktionen»). Der Hauptstoffwechselweg schliesst eine N-Debutylierung ein, um den hauptsächlichen zirkulierenden, aktiven Metaboliten zu bilden, gefolgt von Oxidation, oxidativer Desaminierung, wobei sich der inaktive Propionsäure-Metabolit bildet, gefolgt von Oxidation und direkter Oxidation. Monoaminoxydasen tragen teilweise zum Metabolismus des aktiven Dronedaron-Metaboliten bei. Der N-Debutyl-Metabolit ist pharmakodynamisch aktiv, ist aber um das 3- bis 10-fache geringer wirksam als Dronedaron.
Elimination
Nach oraler Gabe werden ungefähr 6% der markierten Dosis über den Urin hauptsächlich als Metabolite ausgeschieden (es wird keine unveränderte Verbindung über den Urin ausgeschieden) und 84% werden hauptsächlich als Metabolite über die Fäzes ausgeschieden. Nach i.v.-Gabe variiert die Plasmaclearance von Dronedaron von 130 bis 150 l/h. Die terminale Eliminierungshalbwertszeit von Dronedaron liegt bei 25–30 Stunden und die seines N-Debutyl-Metaboliten bei ungefähr 20-25 Stunden. Bei Patienten sind Dronedaron und sein Metabolit innerhalb von 2 Wochen nach der Beendigung einer Behandlung mit zweimal täglich 400 mg komplett aus dem Plasma eliminiert.
Kinetik spezieller Patientengruppen
Die Pharmakokinetik von Dronedaron bei Patienten mit VHF stimmt mit der bei gesunden Probanden überein. Alter, Geschlecht, Gewicht, gleichzeitige Behandlung mit schwachen oder mässigen CYP 3A4-Inhibitoren, sind Faktoren, die die Exposition gegenüber Dronedaron beeinflussen; dies jedoch nur in begrenztem Masse (weniger als Faktor 2).
Geschlecht
Bei weiblichen Patienten ist die Exposition gegenüber Dronedaron im Mittel 30% höher als bei männlichen Patienten.
Ältere Patienten
Von der Gesamtzahl aller Patienten in den klinischen Studien mit Dronedaron waren 73% 65 Jahre oder älter und 34% waren 75 Jahre oder älter. Patienten, die 65 Jahre oder älter waren, zeigten eine 23% höhere Dronedaron-Exposition als Patienten die jünger als 65 Jahre waren.
Eingeschränkte Leberfunktion
Bei Patienten mit mässig eingeschränkter Leberfunktion ist die Exposition gegenüber Gesamt-Dronedaron und nichtgebundenem Dronedaron um das 1,3 bzw. 2-fache erhöht. Die Exposition gegenüber dem aktiven Metaboliten ist allerdings um den Faktor 1,6 bis 1,9 erniedrigt (siehe «Dosierung/ Anwendung»).
Der Einfluss einer stark eingeschränkten Leberfunktion auf die Pharmakokinetik von Dronedaron wurde nicht untersucht (siehe «Kontraindikationen»).
Eingeschränkte Nierenfunktion
An den Untersuchungen nahmen auch Patienten mit eingeschränkter Nierenfunktion teil. Da Dronedaron nur zu sehr geringem Masse renal ausgeschieden wird, konnten bei diesen Patienten keine pharmakokinetischen Veränderungen festgestellt werden, auch nicht bei solchen mit schwer eingeschränkter Nierenfunktion (siehe «Dosierung/ Anwendung»).
Präklinische DatenIn einem in vivo Micronucleus-Test an Mäusen zeigte Dronedaron keine genotoxischen Effekte; Gleiches gilt für vier in vitro durchgeführte Tests:
Ein Ames-Test mit oder ohne metabolische Aktivierung, ein DNA-Reparaturtest an Hepatozyten von Ratten, eine genetische Mutationsuntersuchung an Hamsterfibroblasten und eine zytogenetische Untersuchung an menschlichen Lymphozyten.
In 2-jährigen oralen Karzinogenizitätsstudien war die höchste Dronedaron Dosierung über 24 Monate 70 mg/kg/Tag bei Ratten und 300 mg/kg/Tag bei Mäusen.
Es wurde eine erhöhte Anzahl von Brustdrüsentumoren bei weiblichen Mäusen beobachtet, histiozytäre Sarkome bei Mäusen und Hämangiome im mesenterialen Lymphknotenbereich bei Ratten, jeweils unter der getesteten Höchstdosierung (entspricht der 5- bis 10-fachen Exposition im Vergleich zur therapeutischen Dosierung beim Menschen). Hämangiome sind keine präkanzerösen Veränderungen und entwickeln sich nicht zu malignen Hämangiomsarkomen, weder beim Tier noch beim Menschen. Keine dieser Beobachtungen wurde als relevant für Menschen eingestuft.
Hauptsächlich bei Ratten wurden in Studien zur chronischen Toxizität leichte und reversible Phospholipidosen (Akkumulation von Schaum-Makrophagen) in mesenterialen Lymphknoten beobachtet. Dieser Effekt wird als spezifisch für diese Spezies eingeschätzt und ist nicht relevant für den Menschen.
In einer Studie zur Toxizität mit wiederholten Gaben über 6 Monate wurde bei Ratten ab einer Dosierung von 10 mg Dronedaron/kg/d eine sehr leichte Plasmakreatininerhöhung festgestellt; dieser Effekt ist kein Zeichen für eine Beeinträchtigung der Nieren, da sich histologisch gesehen keine Nierenveränderung nachweisen liess.
Bei Versuchstieren, die hochdosiert Dronedaron erhielten, wurden phototoxische Effekte beobachtet.
Unter hohen Dosierungen zeigte Dronedaron bei Ratten einen signifikanten Einfluss auf die embryofötale Entwicklung, wie z.B. erhöhte Post-Implantations-Verluste, reduziertes Gewicht von Fötus und Plazenta und externe, viscerale und skelettäre Fehlbildungen.
Sonstige HinweiseHaltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
In der Originalverpackung bei 15-30°C lagern.
Zulassungsnummer59292 (Swissmedic).
PackungenMultaq weisse längliche Filmtabletten zu 400 mg: 60 (B)
Zulassungsinhaberinsanofi-aventis (schweiz) ag, 1214 Vernier/GE
Stand der InformationSeptember 2020
|




