CompositionPrincipes actifs
Fentanyl (sous forme de citrate de fentanyl).
Excipients
Hydrolysat d'amidon hydraté (contenant du glucose monohydraté (1,77 g) et de la maltodextrine produits à partir de maïs génétiquement modifié), acide citrique, phosphate disodique, arôme de baies (contenant du propylène glycol, de l'alcool benzylique et du linalol), stéarate de magnésium, octényle succinate d'amidon sodique (E 1450), saccharose (33,90 mg), amidon de maïs (produit à partir de maïs génétiquement modifié), eau purifiée.
Encre: eau purifiée, gomme laque, bleu brillant FCF, hydroxyde d'ammonium.
Contient au maximum 9,30 mg de sodium par comprimé buccal.
Information pour les diabétiques
Actiq contient des dextrates, lesquels se composent de 93 % de glucose monohydraté et 7 % de maltodextrine. En tenant compte de la teneur totale en glucose de 1,89 g par unité, Actiq est adapté aux diabétiques.
Indications/Possibilités d’emploiActiq est indiqué pour le traitement des accès douloureux paroxystiques chez des patients recevant déjà des opioïdes en traitement de fond de leurs douleurs chroniques d'origine cancéreuse.
Un accès douloureux paroxystique est une exacerbation passagère d'une douleur chronique par ailleurs contrôlée par un traitement de fond.
Sont considérés comme patients sous traitement opioïde de fond ceux qui prennent au moins: 60 mg par jour de morphine par voie orale, 25 microgrammes par heure de fentanyl par voie transdermique, 30 mg par jour d'oxycodone, 8 mg par jour d'hydromorphone par voie orale ou une dose analgésique équivalente d'un autre opioïde sur une durée d'une semaine ou plus.
Posologie/Mode d’emploiAfin de réduire au minimum les risques d'effets indésirables liés aux opioïdes et de déterminer la dose la plus «efficace» adaptée à un patient, il est indispensable que les patients soient étroitement surveillés par des professionnels de santé durant la période de titration.
Le médecin doit prendre en compte le risque potentiel d'utilisation abusive du fentanyl.
Tous les patients traités par des opioïdes doivent être étroitement surveillés afin de détecter des signes d'abus et de dépendance (voir également rubrique «Mises en garde et précautions»).
Les patients traités pour des accès douloureux paroxystiques doivent être informés de ne pas utiliser simultanément deux formulations différentes de fentanyl. Tout médicament contenant du fentanyl prescrit antérieurement pour traiter les douleurs paroxystiques doit être éliminé lors du passage à Actiq. Le nombre de dosages différents mis de manière simultanée à disposition du patient doit être réduit au minimum pour éviter les erreurs et un surdosage potentiel.
Toute unité d'Actiq non utilisée et dont le patient n'a plus l'utilité doit être dûment éliminée.
Il faut rappeler aux patients qu'Actiq doit impérativement être conservé hors de portée des enfants.
Objectifs et interruption du traitement
Avant de commencer le traitement par Actiq, il est souhaitable de convenir avec le patient, conformément aux directives relatives au traitement de la douleur, d'une stratégie de traitement qui tient compte de la durée et des objectifs du traitement.
Pendant le traitement, un contact régulier doit être maintenu entre le médecin et le patient afin d'évaluer la nécessité de poursuivre le traitement, d'envisager l'arrêt du médicament et d'adapter la posologie, si nécessaire. Actiq doit être arrêté immédiatement si le patient ne présente plus d'accès douloureux paroxystiques (voir «Arrêt du traitement»).
Adaptation posologique et traitement d'entretien
Il convient de déterminer individuellement la posologie «efficace» d'Actiq pour chaque patient, c'est-à-dire la dose produisant un effet analgésique suffisant avec un minimum d'effets indésirables. Lors des études cliniques, il n'a pas été possible de prédire la dose efficace d'Actiq pour le traitement des accès douloureux paroxystiques en fonction de la dose quotidienne du traitement d'entretien opioïde.
Ajustement de la posologie/titration
Titration
Avant de déterminer la posologie d'Actiq chez un patient, il est nécessaire de s'assurer que ses douleurs chroniques sont contrôlées par un traitement opioïde et qu'il ne présente pas plus de 3 accès douloureux paroxystiques par jour.
La dose initiale d'Actiq doit être de 200 microgrammes, avec augmentation de la posologie, si nécessaire, au moyen de la gamme de dosages disponibles (200, 400, 600, 800, 1200 et 1600 microgrammes). Les patients doivent être surveillés avec attention jusqu'à l'obtention de la dose procurant une analgésie efficace et des effets indésirables acceptables, avec une seule unité par accès douloureux paroxystique. Cette dose est définie comme étant la dose efficace.
Durant la titration, si une analgésie satisfaisante n'est pas obtenue dans les 30 minutes suivant le début de l'application du premier comprimé buccal (c'est-à-dire 15 minutes après absorption complète d'une seule unité d'Actiq), une seconde unité d'Actiq du même dosage pourra être utilisée. Il ne faut pas utiliser plus de deux unités d'Actiq pour traiter un même accès douloureux paroxystique. Avec le dosage de 1600 microgrammes, il ne sera vraisemblablement nécessaire d'administrer une seconde dose que chez une minorité de patients.
Si le traitement de plusieurs accès douloureux paroxystiques consécutifs requiert plus d'une unité par accès, il convient d'envisager de passer au dosage immédiatement supérieur.
Lors de la titration, les patients doivent attendre au moins 4 heures avant de traiter un autre accès douloureux paroxystique par Actiq.
Ajustement de la posologie
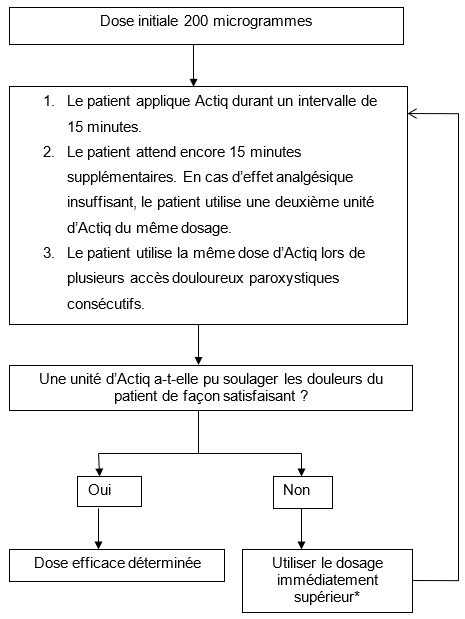
* Dosages disponibles: 200, 400, 600, 800, 1200 et 1600 microgrammes.
Réajustement de la posologie
La dose d'entretien d'Actiq doit être augmentée si plusieurs épisodes douloureux consécutifs ne peuvent être traités efficacement au moyen d'un seul comprimé buccal. Pour le réajustement de la posologie, les mêmes principes que ceux décrits sous «Titration» s'appliquent.
Si les patients présentent plus de 3 accès douloureux paroxystiques par jour, il peut être nécessaire de réévaluer la dose de l'opioïde à durée d'action prolongée utilisé pour le traitement des douleurs chroniques. Si celle-ci est augmentée, il peut être nécessaire de réajuster la dose d'Actiq utilisée pour traiter les accès douloureux paroxystiques.
Tout réajustement de la posologie du traitement analgésique doit impérativement être surveillé par un professionnel de santé.
Si un contrôle adéquat des douleurs n'a pas pu être obtenu, la possibilité de la survenue d'une hyperalgésie, d'une tolérance et de la progression de la maladie sous-jacente doit être prise en considération (voir rubrique «Mises en garde et précautions»).
Arrêt du traitement
Le traitement par Actiq doit être immédiatement arrêté si le patient ne présente plus d'accès douloureux paroxystiques. Le traitement de fond des douleurs chroniques doit être poursuivi conformément à la prescription. Si l'arrêt de tout traitement opioïde est nécessaire, le patient doit être surveillé de près par le médecin afin de gérer le risque d'effets liés à un sevrage brutal.
Dose d'entretien
Une fois la dose efficace établie (c'est-à-dire un accès douloureux paroxystique est efficacement traité par une seule unité, en moyenne), les patients doivent utiliser cette dose et limiter leur consommation à un maximum de trois unités d'Actiq par jour.
Durant le traitement d'entretien, les patients doivent attendre au moins 4 heures avant de traiter un autre accès douloureux paroxystique par Actiq.
Les patients doivent être médicalement surveillés afin de veiller à ce que la consommation maximale de trois unités d'Actiq par jour ne soit pas dépassée.
Les accès douloureux paroxystiques peuvent varier en intensité. Le cas échéant, un second comprimé buccal d'Actiq du même dosage peut être utilisé 30 minutes suivant l'administration de la première dose. Si une seconde dose d'Actiq s'est avérée nécessaire lors de plusieurs accès douloureux paroxystiques consécutifs, la dose d'entretien habituelle devra être réajustée (voir ci-dessous).
Patients présentant des troubles de la fonction hépatique
Il convient d'être particulièrement prudent durant la phase de titration chez les patients atteints de troubles de la fonction hépatique (voir «Mises en garde et précautions»).
Patients présentant des troubles de la fonction rénale
Il convient d'être particulièrement prudent durant la phase de titration chez les patients atteints de troubles de la fonction rénale (voir «Mises en garde et précautions»).
Patients âgés
Les sujets âgés se sont avérés plus sensibles aux effets du fentanyl administré par voie intraveineuse. Par conséquent, la titration impose des précautions particulières chez ces patients. Le fentanyl est éliminé plus lentement chez le sujet âgé et sa demi-vie terminale d'élimination est plus longue, ce qui peut entraîner une accumulation du principe actif et majorer les risques d'effets indésirables.
Aucune étude clinique spécifique n'a été menée avec Actiq chez le sujet âgé. Néanmoins, au cours des études cliniques, les doses d'Actiq permettant un soulagement efficace des accès douloureux paroxystiques ont été plus basses chez les patients âgés de plus de 65 ans.
Enfants et adolescents
Enfants dès 16 ans:
Voir la posologie pour adultes.
Enfants de 2 à 16 ans:
Les données cliniques relatives à l'utilisation d'Actiq chez les enfants sous traitement de fond opioïde sont limitées (voir sous «Propriétés/Effets» et «Pharmacocinétique»). L'innocuité et l'efficacité chez les enfants de moins de 16 ans n'ont pas été démontrées. Aussi, l'utilisation d'Actiq chez les patients de ce groupe d'âge n'est pas recommandée.
Mode d'administration
Actiq est destiné à l'administration par voie buccale, par conséquent, le comprimé doit être placé contre la face interne de la joue. A l'aide de l'applicateur, il faut ensuite déplacer le comprimé contre la muqueuse des joues afin d'optimiser le degré d'exposition de la muqueuse au produit actif. Il ne faudrait pas sucer ni mâcher Actiq, car l'absorption du fentanyl par la muqueuse buccale est plus rapide que l'absorption systémique par voie gastro-intestinale. Les patients souffrant de sécheresse buccale peuvent humecter leur muqueuse buccale en buvant un peu d'eau.
L'unité d'Actiq doit être appliquée en un intervalle de 15 minutes. Si des signes d'effets opioïdes excessifs apparaissent avant que l'unité d'Actiq soit entièrement dissoute, Actiq devra être immédiatement retiré de la bouche et il devra être envisagé de réduire les doses ultérieures.
Contre-indicationsHypersensibilité au fentanyl ou à l'un des excipients.
Patients ne recevant pas de traitement opioïde de fond (voir «Indications/Possibilités d'emploi»), en raison d'un risque accru de dépression respiratoire et de décès.
Traitement de douleurs aiguës autres que les accès douloureux paroxystiques (par ex. les douleurs postopératoires, les maux de tête, la migraine).
Administration concomitante ou interrompue depuis moins de 2 semaines, d'inhibiteurs de la monoamine-oxydase (IMAO).
Insuffisance respiratoire sévère ou obstruction sévère des voies aériennes.
Mises en garde et précautionsIl est important que le traitement opioïde de fond utilisé pour traiter la douleur chronique du patient soit stabilisé avant d'instaurer le traitement par Actiq et que le patient continue son traitement opioïde de fond parallèlement à l'utilisation d'Actiq.
Dépendance médicamenteuse et potentiel d'abus
L'utilisation répétée d'opioïdes peut entraîner le développement d'une tolérance ainsi qu'une dépendance physique et/ou psychique. Une dépendance iatrogène peut apparaître après l'utilisation d'opioïdes. Actiq, comme d'autres opioïdes, peut faire l'objet d'un abus et tous les patients recevant des opioïdes doivent être surveillés afin de détecter tout signe d'abus ou de dépendance. Les patients présentant un risque accru d'abus d'opioïdes peuvent néanmoins être traités de manière appropriée par des opioïdes. Ces patients doivent cependant faire l'objet d'une surveillance supplémentaire afin de détecter tout signe d'utilisation incorrecte, d'abus ou de dépendance. L'utilisation répétée d'Actiq peut entraîner un trouble de l'utilisation des opioïdes. L'abus ou l'utilisation incorrecte intentionnelle d'Actiq peut entraîner un surdosage et/ou un décès. Le risque de développer un trouble de l'utilisation des opioïdes est accru chez les patients ayant des antécédents personnels ou familiaux (parents ou frères et sœurs) de troubles de la consommation de substances (y compris troubles de la consommation d'alcool), chez les fumeurs ou chez les patients ayant des antécédents d'autres affections psychiques (p.ex. dépression majeure, troubles anxieux et troubles de la personnalité). Les patients doivent être surveillés afin de détecter tout signe de comportement addictif (drug-seeking behavior) (p.ex. demander trop tôt des ordonnances de suivi). Il s'agit également de vérifier l'absence de prise concomitante d'opioïdes et de médicaments psychoactifs (tels que les benzodiazépines). La consultation d'un addictologue doit être envisagée pour les patients présentant les signes et les symptômes d'un trouble de l'utilisation des opioïdes.
Dépression respiratoire
Comme pour tous les opioïdes, l'utilisation d'Actiq expose à un risque de dépression respiratoire cliniquement significative. Si elle n'est pas identifiée et traitée immédiatement, une dépression respiratoire peut entraîner un arrêt respiratoire et un décès. Le traitement d'une dépression respiratoire comprend, selon l'état clinique du patient, une surveillance étroite, des mesures de soutien et l'administration d'antagonistes opioïdes. Une dépression respiratoire grave, potentiellement mortelle ou mortelle, peut survenir à tout moment du traitement, le risque étant maximal au début du traitement ou après une augmentation de la dose
Bronchopneumopathie chronique obstructive
Une prudence particulière est recommandée lors de la titration d'Actiq chez des patients présentant une bronchopneumopathie chronique obstructive non sévère ou toute autre pathologie pré-existante les prédisposant à une dépression respiratoire car chez ces patients, même administré aux doses thérapeutiques normales, Actiq peut aggraver les troubles respiratoires jusqu'à provoquer une insuffisance respiratoire.
Utilisation concomitante avec des dépresseurs du système nerveux central
L'utilisation concomitante d'opioïdes et de benzodiazépines ou d'autres dépresseurs du système nerveux central, y compris les gabapentinoïdes (gabapentine ou prégabaline), peut entraîner une forte sédation, une dépression respiratoire, un coma et un décès. En raison de ces risques, les opioïdes et les benzodiazépines ou autres dépresseurs du système nerveux central doivent uniquement être administrés en concomitance chez les patients pour lesquels aucune autre option de traitement n'est envisageable. S'il est décidé de prescrire Actiq en association avec des benzodiazépines ou d'autres dépresseurs du système nerveux central, il convient de choisir la dose efficace la plus faible et une durée minimale d'utilisation concomitante. Les patients doivent être étroitement surveillés afin de détecter tout signe ou symptôme de dépression respiratoire et de sédation (voir rubrique «Interactions»).
Alcool
La prise concomitante de fentanyl et d'alcool peut entraîner une dépression respiratoire grave, qui peut s'avérer mortelle dans certains cas (voir «Interactions»).
Exposition accidentelle
Les patients et leurs soignants doivent être informés qu'Actiq contient un principe actif à une dose potentiellement mortelle, en particulier chez les enfants. Les patients et leurs soignants doivent être informés de la nécessité de conserver toutes les unités hors de la portée des enfants et d'éliminer de façon conforme les unités ouvertes ou non utilisées. Chez tout patient ambulatoire, il est recommandé d'évaluer les éventuels risques d'exposition accidentelle d'enfants au médicament. Des cas de décès ont été rapportés chez des enfants ayant pris Actiq par accident.
Troubles respiratoires liés au sommeil
Les opioïdes peuvent provoquer des troubles respiratoires liés au sommeil, notamment l'apnée centrale du sommeil (ACS) et l'hypoxémie liée au sommeil. L'utilisation d'opioïdes est accompagnée d'une augmentation dose-dépendante du risque d'apnée centrale du sommeil. Chez les patients présentant une apnée centrale du sommeil, une diminution de la dose totale d'opioïdes doit être envisagée.
Pression intracrânienne accrue, altérations de l'état de conscience
Actiq doit être administré avec une extrême prudence chez les patients particulièrement sensibles aux effets intracrâniens d'une rétention de gaz carbonique, par exemple chez les patients présentant des signes d'hypertension intracrânienne ou des troubles de la conscience.
Les opioïdes pouvant masquer l'évolution clinique en cas de traumatisme crânien, ils ne doivent être utilisés dans ce cadre qu'en cas de nécessité clinique absolue.
Délire
Le risque de délire est important avec les médicaments contenant du fentanyl, y compris les médicaments utilisés par voie transmuqueuse et les préparations combinées.
Affection cardiaque
Administré par voie intraveineuse, le fentanyl peut provoquer une bradycardie. Par conséquent, Actiq doit être utilisé avec prudence en cas de bradyarythmie.
Insuffisance hépatique ou rénale
En outre, Actiq doit être administré avec prudence chez les patients atteints de troubles de la fonction hépatique ou rénale, car on ne connaît pas l'influence d'un dysfonctionnement hépatique ou rénal sur la pharmacocinétique du médicament. Toutefois, en cas d'administration intraveineuse, la clairance du fentanyl est altérée par l'insuffisance hépatique ou rénale, en raison de modifications affectant la clairance métabolique et les protéines plasmatiques. Après administration d'Actiq, l'insuffisance hépatique ou rénale peut augmenter la biodisponibilité du fentanyl absorbé par voie buccale et diminuer sa clairance systémique, entraînant ainsi des effets opioïdes accrus et prolongés. Une prudence particulière est donc de rigueur lors de la phase de titration chez des patients présentant une insuffisance hépatique ou rénale modérée à sévère.
Hypovolémie, hypotension
Une prudence particulière s'impose chez les patients atteints d'hypovolémie et d'hypotension.
Syndrome sérotoninergique
La prudence est de rigueur lorsqu'Actiq est administré concomitamment avec des médicaments qui influencent les systèmes sérotoninergiques des neurotransmetteurs.
Un syndrome sérotoninergique potentiellement mortel peut se développer lors de l'utilisation concomitante de médicaments sérotoninergiques, comme les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) et les inhibiteurs de la recapture de la sérotonine-noradrénaline (IRSN), les myorelaxants (p.ex. cyclobenzaprine, métaxalone) et de médicaments qui perturbent le métabolisme de la sérotonine (y compris les inhibiteurs de la monoamine oxydase [inhibiteurs de la MAO]), même lors de l'utilisation de la dose recommandée.
Un syndrome sérotoninergique peut s'exprimer sous forme d'altérations de l'état mental (p.ex. excitation, hallucinations, coma), d'instabilité autonome (p.ex. tachycardie, variations de la tension artérielle, hyperthermie), d'anomalies neuromusculaires (p.ex. hyperréflexie, faiblesse de la coordination, rigidité) et/ou de symptômes gastro-intestinaux (p.ex. nausées, vomissements, constipation). En cas de suspicion d'un syndrome sérotoninergique, le traitement par Actiq doit être immédiatement arrêté.
Anaphylaxie et hypersensibilité
Des réactions anaphylactiques et des réactions d'hypersensibilité ont été observées en relation avec l'utilisation d'autres préparations de fentanyl transmucosales orales (voir «Effets indésirables»).
Intolérances
Les patients souffrant de rares anomalies héréditaires telles que l'intolérance au fructose/galactose, la malabsorption du glucose/galactose ou le déficit en saccharase-isomaltase ne doivent pas utiliser ce médicament.
Lésions dentaires
Une hygiène buccale normale est recommandée pour diminuer les effets nocifs potentiels sur les dents. Actiq contenant environ 2 grammes de sucre, une utilisation fréquente peut augmenter le risque de dégâts dentaires. De plus, la sécheresse buccale induite par l'utilisation d'un médicament opioïde peut contribuer à accroître ce risque. Des visites régulières chez le dentiste sont recommandées lors du traitement par Actiq.
Patients âgés
Il est conseillé de réduire la posologie des patients âgés ou affaiblis. Doser prudemment les opioïdes chez les patients porteurs des maladies suivantes: hypothyroïdie non traitée, pneumopathie, réserve respiratoire réduite, alcoolisme, insuffisance hépatique ou rénale. Ces patients nécessitent aussi une plus longue surveillance postopératoire.
Insuffisance surrénale
Les opioïdes peuvent provoquer une insuffisance surrénale réversible, qui nécessite une surveillance et un traitement de substitution par glucocorticoïdes. Les symptômes d'une insuffisance surrénale peuvent inclure, entre autres, les symptômes suivants: nausées, vomissements, perte d'appétit, fatigue, faiblesse, vertiges ou hypotension.
Syndrome de sevrage des opioïdes néonatal
L'utilisation prolongée d'Actiq durant la grossesse peut entraîner un syndrome de sevrage aux opioïdes néonatal qui est potentiellement mortel lorsqu'il n'est pas identifié et traité à temps. Le traitement doit avoir lieu conformément aux protocoles développés par des experts en néonatologie. Si l'utilisation d'opioïdes est nécessaire chez une femme enceinte durant une période prolongée, informez la patiente du risque de syndrome de sevrage aux opioïdes néonatal et assurez-vous que le traitement adéquat soit disponible, le cas échéant.
Hyperalgésie
Une hyperalgésie induite par les opioïdes (HIO) se produit lorsqu'un analgésique opioïde provoque paradoxalement une augmentation de la douleur ou de la sensibilité à la douleur. Elle diffère de la tolérance, pour laquelle des doses plus élevées d'opioïdes sont nécessaires pour maintenir un effet donné. Les symptômes de l'HIO comprennent notamment une augmentation de la douleur en cas d'augmentation de la dose d'opioïdes, une diminution de la douleur en cas de réduction de la dose d'opioïdes ou une douleur provoquée par des stimuli habituellement indolores (allodynie). Si une HIO est suspectée, il convient d'envisager une réduction de la dose d'opioïdes ou une rotation des opioïdes.
Diminution des taux d'hormones sexuelles et augmentation du taux de prolactine
L'utilisation prolongée d'opioïdes peut être associée à une baisse des taux d'hormones sexuelles et à une augmentation du taux de prolactine. Les symptômes incluent une perte de la libido, une dysérection ou une aménorrhée.
Spasme du sphincter d'Oddi/pancréatite
Les opioïdes peuvent provoquer un dysfonctionnement et un spasme du sphincter d'Oddi, ce qui augmente la pression intrabiliaire ainsi que le risque de symptômes des voies biliaires et de pancréatite.
Excipients
Ce médicament contient moins de 1 mmol de sodium (23 mg) par comprimé buccal, c.-à-d. qu'il est essentiellement «sans sodium».
Ce médicament contient du glucose et du saccharose. Actiq contient 1,89 g d'hydrates de carbone digestibles par comprimé buccal. Ceci doit être pris en compte chez les patients diabétiques. Les patients souffrant de rares anomalies héréditaires telles que l'intolérance au fructose/galactose, la malabsorption du glucose/galactose ou le déficit en saccharase-isomaltase ne doivent pas utiliser ce médicament. Peut être nocif pour les dents.
Ce médicament contient un arôme à base d'alcool benzylique et de linalol. L'alcool benzylique et le linalol peuvent provoquer des réactions allergiques. En plus des réactions allergiques chez les patients sensibilisés, les patients non sensibilisés peuvent être sensibilisés.
InteractionsAutres interactions
L'administration concomitante d'autres dépresseurs du SNC comme d'autres opioïdes, sédatifs tels que benzodiazépines ou hypnotiques, anesthésiques généraux, phénothiazines, tranquillisants, myorelaxants, antihistaminiques sédatifs, gabentinoïdes (gabentine et prégabaline) ou alcool peut entraîner des effets dépresseurs additifs susceptibles d'entraîner une détresse respiratoire, une hypotension, une forte sédation voire un coma et qui peuvent être mortels dans certains cas (voir «Mises en garde et précautions»). Le cas échéant, un ajustement de la dose doit être envisagé.
L'utilisation d'Actiq est contre-indiquée chez les patients qui ont reçu des inhibiteurs de la monoamine oxydase (inhibiteurs de la MAO) dans les 14 derniers jours, étant donné qu'une forte potentialisation imprévisible de l'effet due aux inhibiteurs de la MAO a été rapportée pour les analgésiques opioïdes.
Un syndrome sérotoninergique peut survenir en cas d'administration concomitante d'opioïdes avec des inhibiteurs de la monoamine oxydase (IMAO) et des agents sérotoninergiques, tels que les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS), les inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN), et les antidépresseurs tricycliques (ATC). Les symptômes du syndrome sérotoninergique peuvent inclure une altération de l'état de conscience, une instabilité autonome, des anomalies neuromusculaires et/ou des symptômes gastro-intestinaux.
Interactions pharmacocinétiques
Le fentanyl est métabolisé par l'isoenzyme CYP3A4 dans le foie et la muqueuse intestinale. Les inhibiteurs puissants de cette isoenzyme, comme les antibiotiques dérivés des macrolides (comme par ex. l'érythromycine), les antimycotiques azolés (comme par ex. le kétoconazole, l'itraconazole et le fluconazole) et certains inhibiteurs des protéases (comme par ex. le ritonavir), sont susceptibles d'augmenter la biodisponibilité du fentanyl absorbé par voie buccale et de diminuer également sa clairance systémique, provoquant ainsi des effets opioïdes accrus et prolongés. Des effets similaires pourraient être observés après ingestion concomitante de jus de pamplemousse, connu pour inhiber le CYP3A4. La prudence est donc de rigueur lors de l'administration concomitante de fentanyl avec des inhibiteurs du CYP3A4.
L'administration concomitante d'inducteurs du CYP3A4 peut potentiellement diminuer l'efficacité d'Actiq.
Interactions pharmacodynamiques
L'utilisation concomitante d'antagonistes des opioïdes (comme la naloxone) ou d'agonistes/antagonistes opioïdes partiels (par exemple: buprénorphine, nalbuphine) n'est pas recommandée. En effet, ils possèdent une forte affinité pour les récepteurs opioïdes avec une activité intrinsèque relativement faible et donc antagonisent l'effet analgésique du fentanyl, pouvant ainsi induire un syndrome de sevrage chez les patients dépendants aux opioïdes.
Grossesse, allaitementGrossesse
Il n'existe pas de données pertinentes sur l'utilisation du fentanyl durant la grossesse. Les expérimentations animales ont montré une toxicité sur la reproduction (voir «Données précliniques»). Les analgésiques opioïdes peuvent entraîner une dépression respiratoire chez le nouveau-né. Actiq ne doit être utilisé pendant la grossesse, sauf en cas de nécessité absolue.
La prise prolongée d'Actiq pendant la grossesse peut entraîner un syndrome de sevrage aux opioïdes néonatal potentiellement mortel lorsqu'il n'est pas identifié et traité à temps. Le traitement doit avoir lieu selon les protocoles qui ont été développés par des experts en néonatologie. Lorsque l'utilisation d'opioïdes durant une période prolongée est nécessaire chez la femme enceinte, informez la patiente du risque de syndrome de sevrage aux opioïdes néonatal et assurez-vous que le traitement adéquat soit disponible, le cas échéant (voir également la rubrique «Mises en garde et précautions»).
Il est déconseillé d'utiliser du fentanyl pendant l'accouchement, car le fentanyl franchit la barrière placentaire et peut entraîner une insuffisance respiratoire chez le fœtus. Le taux de passage transplacentaire est de 0,44 (rapport fœto-maternel: 1,00: 2,27).
Allaitement
Le fentanyl est excrété dans le lait maternel, par conséquent, les femmes ne doivent pas allaiter en période de traitement avec Actiq, en raison de la possibilité de sédation et/ou de dépression respiratoire chez le nourrisson. L'allaitement ne doit pas être repris avant au moins 5 jours après la dernière administration de fentanyl.
Effet sur l’aptitude à la conduite et l’utilisation de machinesActiq a une influence importante sur l'aptitude à la conduite ou l'utilisation de machines. Actiq, comme les autres opioïdes puissants, altère les facultés psychiques et/ou physiques nécessaires à l'exécution de tâches qui peuvent se révéler dangereuses (conduite de véhicules ou utilisation de machines).
Il faut déconseiller aux patients de conduire un véhicule ou d'utiliser des machines si Actiq provoque chez eux de la somnolence, des vertiges, une vision floue ou double.
Effets indésirablesLes effets indésirables observés avec Actiq sont les effets secondaires typiques des opioïdes. Le plus souvent, ils disparaissent ou diminuent d'intensité avec la poursuite du traitement par Actiq et l'obtention de la posologie adéquate. Ces effets opioïdes doivent être anticipés et pris en charge de façon appropriée.
Les études cliniques menées avec Actiq ayant eu pour but d'évaluer l'innocuité et l'efficacité du produit dans le traitement des accès douloureux paroxystiques, les patients inclus ont reçu en même temps d'autres opioïdes (morphine à libération prolongée ou fentanyl par voie transdermique) pour traiter leurs douleurs chroniques. Par conséquent, il n'est pas possible d'isoler avec certitude les effets indésirables dus au seul traitement par Actiq.
Lors des études cliniques incluant 659 patients ayant utilisé Actiq, les effets indésirables dont l'imputabilité au produit a été jugée au moins possible ont été les suivants.
Les fréquences sont définies de la manière suivante:
très fréquents (≥1/10), fréquents (≥1/100 et <1/10), occasionnels (≥1/1'000 et <1/100), rares (≥1/10'000 et <1/1'000), très rares (<1/10'000), fréquence non connue (fréquence non appréciable sur la base des données disponibles):
Troubles du métabolisme et de la nutrition
Occasionnels: soif.
Affections du système nerveux
Fréquents: anxiété, confusion, vertiges, sécheresse buccale, insomnie, somnolence.
Occasionnels: dysgueusie, anomalies de la coordination, cauchemars, troubles de la pensée, agitation, amnésie, ataxie, paresthésies péribuccales, diminution des réflexes, délire, dépersonnalisation, dépression, labilité émotionnelle, euphorie, hallucinations, hyperesthésie, hypokinésie, myoclonie, stupeur.
Affections oculaires
Fréquents: troubles de la vision.
Affections cardiaques
Occasionnels: hypotension*, tachycardie.
Affections vasculaires
Occasionnels: vasodilatation.
Affections respiratoires, thoraciques et médiastinales
Fréquents: dyspnée.
Occasionnels: asthme, hypoventilation*, pharyngite, insuffisance respiratoire*.
Affections gastro-intestinales
Très fréquents: nausées/vomissements.
Fréquents: constipation, dyspepsie.
Occasionnels: perte de poids, chéilite, dysphagie, éructations, flatulence, gingivite, saignement gingival, hypersalivation, occlusion intestinale, ictère, ulcération buccale, stomatite, troubles linguaux, caries.
Fréquence non connue: pancréatite.
Affections hépatobiliaires
Fréquence non connue: spasme du sphincter d'Oddi.
Affections de la peau et du tissu sous-cutané
Fréquents: prurit, sueurs.
Occasionnels: érythème, urticaire.
Affections du rein et des voies urinaires
Occasionnels: rétention urinaire.
Troubles généraux
Fréquents: asthénie, céphalées.
Occasionnels: augmentation du volume de l'abdomen, douleurs abdominales, blessures accidentelles, effets résiduels excessifs, malaise.
Fréquence non connue: fièvre.
* Les effets indésirables les plus graves pour tous les opioïdes sont l'insuffisance respiratoire (pouvant aboutir à l'apnée ou arrêt respiratoire), l'insuffisance circulatoire, l'hypotension et le choc. Tous les patients doivent être attentivement suivis afin de détecter d'éventuels symptômes d'insuffisance respiratoire.
Après la mise sur le marché, les effets indésirables supplémentaires suivants ont été observés dans le cadre des études cliniques et durant la phase de surveillance post-marketing:
Affections du système immunitaire
Fréquence non connue: réactions anaphylactiques et réactions d'hypersensibilité (y compris exanthème, érythème, œdème lingual, œdème des lèvres).
Affections endocriniennes
Fréquence non connue: insuffisance corticosurrénale, carence en androgènes, hypogonadisme.
Affections psychiatriques
Fréquence non connue: délire, dépendance.
Affections du système nerveux
Fréquents: perte de conscience, sensation de vertige, convulsions, sédation.
Occasionnels: coma, troubles de l'élocution.
Affections respiratoires, thoraciques et médiastinales
Fréquence non connue: œdème pharyngé, dépression respiratoire, apnée centrale du sommeil.
Affections gastro-intestinales
Occasionnels: iléus, caries.
Fréquence non connue: perte dentaire, retrait gingival.
Troubles généraux et anomalies au site d'administration
Occasionnels: réactions au site d'administration telles que saignements, irritation, douleurs et ulcération.
Fréquence non connue: syndrome de sevrage néonatal aux opioïdes (voir également les rubriques «Mises en garde et précautions» et «Grossesse/Allaitement»), abus de médicaments (voir également la rubrique «Mises en garde et précautions»).
L'administration répétée des opioïdes tels que le fentanyl peut entraîner une tolérance, une dépendance physique et/ou psychique.
Des symptômes de sevrage des opioïdes tels que nausées, vomissements, diarrhée, anxiété, frissons, tremblements et sudation ont été observés lors de l'utilisation de fentanyl par voie transmuqueuse.
En cas de surdosage, il a été observé une perte de conscience et un arrêt respiratoire.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageSignes et symptômes
Les symptômes à attendre en cas de surdosage par le fentanyl sont de même nature que ceux observés après l'administration intraveineuse de fentanyl ou d'autres opioïdes, et résultent d'un renforcement de son action pharmacologique. Les effets indésirables les plus graves sont l'altération de l'état de conscience, la perte de conscience, le coma, la défaillance cardiovasculaire, la dépression respiratoire, la détresse respiratoire et l'arrêt respiratoire pouvant entraîner la mort.
Des cas de respiration de Cheyne-Stokes ont été observés en cas de surdosage de fentanyl, en particulier chez les patients ayant des antécédents d'insuffisance cardiaque.
Une leucoencéphalopathie toxique a été observée en cas de surdosage d'opioïdes.
Traitement
Les mesures à prendre immédiatement en présence d'un surdosage opioïde consistent à retirer immédiatement l'unité d'Actiq de la bouche du patient si elle s'y trouve encore, à l'aide de l'applicateur, assurer la perméabilité des voies respiratoires, effectuer des stimulations physiques et verbales du patient et déterminer son niveau de conscience ainsi que son état ventilatoire et circulatoire. Instaurer si nécessaire une ventilation assistée.
Le traitement du surdosage chez une personne qui n'a jamais reçu de traitement opioïde (ingestion accidentelle) nécessite de mettre en place une voie d'abord veineuse et administrer de la naloxone ou un autre antagoniste des opioïdes, selon l'état clinique. La durée de la dépression respiratoire due au surdosage peut être plus longue que les effets de l'antagoniste opioïde (par exemple, la demi-vie de la naloxone est comprise entre 30 et 81 minutes) et il peut donc être nécessaire de répéter l'administration de l'antidote. Pour plus de détails sur le mode d'emploi de l'antagoniste opioïde utilisé, se référer à l'information professionnelle en question.
En cas de surdosage chez les patients recevant un traitement de fond opioïde, mettre en place une voie d'abord veineuse. Dans certains cas, l'utilisation judicieuse de naloxone ou d'autres antagonistes des opioïdes peut être justifiée, mais elle expose au risque de déclenchement d'un syndrome de sevrage aigu.
Bien qu'il n'ait jamais été décrit de rigidité musculaire associée à la dépression respiratoire après administration d'Actiq, un tel phénomène est possible avec le fentanyl ou d'autres opioïdes. Si une telle rigidité musculaire apparaît, il faudra instaurer une ventilation assistée, administrer un antagoniste des opioïdes et, en dernier recours, un myorelaxant.
Propriétés/EffetsCode ATC N02AB03
Mécanisme d'action
Le fentanyl, agoniste opioïde pur, agit essentiellement sur les récepteurs opioïdes µ du cerveau, de la moelle épinière et des muscles lisses. L'effet thérapeutique s'exerce essentiellement au niveau du système nerveux central (SNC). L'analgésie représente l'effet pharmacologique clinique le plus utile résultant de l'interaction du fentanyl sur les récepteurs opioïdes µ.
Pharmacodynamique
Cet effet est corrélé aux taux sanguins circulants du fentanyl, à condition de tenir compte du délai de pénétration dans le SNC et du délai de disparition du SNC (phénomène dont la demi-vie est de 3 à 5 minutes). Chez les sujets n'ayant jamais reçu de traitement opioïde, l'effet analgésique apparaît à des concentrations sanguines de 1 à 2 ng/ml, alors que l'effet anesthésique chirurgical associé à une profonde dépression respiratoire se produit à des concentrations de 10 à 20 ng/ml.
Les effets pharmacologiques secondaires sont la dépression respiratoire, la bradycardie, l'hypothermie, la constipation, le myosis, la dépendance physique et l'euphorie.
Les opioïdes peuvent influer sur l'axe hypothalamo-hypophyso-surrénalien ou l'axe hypothalamo-hypophyso-gonadique. Les modifications qui peuvent survenir comprennent une augmentation de la prolactine sérique et une diminution du taux plasmatique de cortisol et de testostérone. Ces modifications hormonales peuvent se traduire par des signes et symptômes cliniques.
Efficacité clinique
Chez des patients cancéreux dont les douleurs chroniques étaient contrôlées par des administrations régulières de doses stables d'opioïdes, le soulagement des accès douloureux paroxystiques induit par Actiq a été significativement supérieur à celui d'un placebo, 15, 30, 45 et 60 minutes après le début de l'administration.
Les effets secondaires des opioïdes sont notamment une augmentation du tonus et une diminution des contractions des muscles lisses du tractus gastro-intestinal. Ces deux phénomènes allongent la durée du transit intestinal et peuvent être responsables de la constipation liée aux opioïdes.
Bien que les opioïdes augmentent généralement le tonus des muscles lisses des voies urinaires, l'effet global est variable: dans certains cas, ils provoquent un besoin impérieux d'uriner et dans d'autres cas une dysurie.
Tous les agonistes des récepteurs opioïdes µ, y compris le fentanyl, induisent une dépression respiratoire dose-dépendante. Le risque de dépression respiratoire est moindre chez les patients présentant des douleurs et chez ceux qui reçoivent un traitement opioïde de fond, car il apparaît une tolérance à la dépression respiratoire et aux autres effets opioïdes. Chez les patients n'ayant pas développé de tolérance, les effets maximaux sur le tractus respiratoire apparaissent généralement 15 à 30 minutes après le début de l'administration d'Actiq et peuvent se prolonger plusieurs heures.
Sécurité et efficacité en pédiatrie
On ne dispose que d'une expérience limitée relative à l'utilisation d'Actiq chez les enfants de moins de 16 ans. Dans le cadre d'une étude clinique, 15 enfants (sur 38) âgés de 5 à 15 ans, souffrant de douleurs paroxystiques et recevant un traitement de fond opioïde, ont été traités par Actiq. Cette étude était néanmoins de trop faible envergure pour permettre de caractériser l'innocuité et l'efficacité du principe actif chez les patients de ce groupe.
PharmacocinétiqueGénéralités
Le fentanyl est une substance très lipophile. Il est absorbé très rapidement par la muqueuse buccale et plus lentement par le tractus gastro-intestinal. Il subit un métabolisme par effet de premier passage hépatique et intestinal, mais les métabolites du fentanyl ne contribuent pas à ses effets thérapeutiques.
Absorption
La pharmacocinétique de l'absorption du fentanyl libéré par Actiq comprend une absorption initiale rapide à partir de la muqueuse buccale et une absorption plus lente du fentanyl dégluti, à partir du tractus gastro-intestinal. Environ 25% de la dose totale sont rapidement absorbés par la muqueuse buccale. Le reste de la dose totale (soit 75%) est dégluti avec la salive et ensuite lentement absorbé au niveau du tractus gastro-intestinal. Environ un tiers de cette fraction (soit 25% de la dose totale) échappe à l'élimination lors du premier passage hépatique et intestinal et devient disponible sur le plan systémique. La biodisponibilité absolue par rapport à du fentanyl administré par voie intraveineuse est d'environ 50%, se répartissant en parts égales entre l'absorption transmuqueuse rapide et l'absorption gastro-intestinale plus lente. Après l'administration d'Actiq (de 200 à 1600 microgrammes), la valeur de Cmax se situe entre 0,39 et 2,51 ng/ml. Le Tmax est compris entre 20 et 40 minutes suivant l'utilisation d'une unité d'Actiq (valeurs extrêmes: 20 et 480 minutes).
Distribution
Les expérimentations animales montrent que le fentanyl se répartit rapidement dans le cerveau, le cœur, les poumons, les reins et la rate, puis est redistribué de façon plus lente vers les muscles et le tissu adipeux. Le taux de liaison du fentanyl aux protéines plasmatiques est de 80–85%, cette liaison impliquant essentiellement l'alpha-1 glycoprotéine acide mais également, dans une certaine mesure, l'albumine et les lipoprotéines. L'acidose augmente la fraction libre de fentanyl. Le volume moyen de distribution à l'état d'équilibre (Vss) est de 4 l/kg.
Métabolisme
Le fentanyl est métabolisé en norfentanyl dans le foie et la muqueuse intestinale sous l'effet du CYP3A4. Lors des expérimentations animales, le norfentanyl n'a pas montré d'effet pharmacologique. Plus de 90% de la dose de fentanyl administrée sont éliminés par biotransformation en métabolites N-désalkylés et hydroxylés inactifs.
Élimination
Moins de 7% de la dose sont excrétés sous forme inchangée dans les urines et seul environ 1% est excrété sous forme inchangée dans les selles. Les métabolites sont essentiellement excrétés par voie urinaire, l'excrétion fécale étant moins importante. La clairance plasmatique totale du fentanyl est de 0,5 l/h/kg (extrêmes: 0,3–0,7 l/h/kg). Après administration d'Actiq, la demi-vie d'élimination terminale est d'environ 7 heures.
Linéarité/non-linéarité
Pour la gamme de dosages d'Actiq disponibles (200 à 1600 microgrammes), les paramètres pharmacocinétiques sont dose-dépendants.
Enfants et adolescents
Dans le cadre d'une étude clinique, 15 enfants âgés de 5 à 15 ans, souffrant de douleurs paroxystiques et recevant un traitement de fond opioïde, ont été traités par Actiq à des doses comprises entre 200 et 600 microgrammes. Les valeurs d'AUC calculées à partir des concentrations mesurées étaient chez les jeunes enfants deux fois plus élevées que chez les adolescents (5,25 versus 2,65 ng.h/ml) et quatre fois plus élevées que chez les adultes (5,25 versus 1,20 ng.h/ml). En tenant compte du poids corporel, la clairance et le volume de distribution étaient comparables pour tous ces groupes d'âge.
Données précliniquesLes données précliniques issues des études conventionnelles de pharmacologie de sécurité, de toxicologie en administration répétée et de génotoxicité n'ont pas mis en évidence de risque particulier pour l'homme.
Carcinogénicité
Les études de carcinogénicité (test alternatif chez la souris transgénique Tg.AC durant 26 semaines; étude par voie sous-cutanée chez le rat durant deux ans) ne montrent pas de résultats suggérant un potentiel oncogène.
Toxicité sur la reproduction
Les études sur le développement embryo-fœtal conduites chez le rat et le lapin à des doses sous-cutanées de 100 ou 250 μg/kg n'ont révélé aucune malformation ou modification du développement en cas d'administration pendant la période d'organogenèse.
Dans une étude de fertilité et de développement embryonnaire précoce chez le rat, un effet médié par les mâles a été observé à forte dose (300 μg/kg/jour) qui concordait avec les effets sédatifs du fentanyl dans le cadre de l'expérimentation.
Lors d'études portant sur le développement pré- et postnatal chez le rat, une diminution significative de la survie des ratons a été observée à des doses clairement maternotoxiques du principe actif. De plus, l'administration de doses maternotoxiques a entraîné chez les animaux de la génération F1 un retard du développement physique, des troubles des fonctions sensorielles, des réflexes et du comportement. Ces effets peuvent être la conséquence indirecte d'une modification des soins maternels et/ou d'une diminution de la production de lait ou ils peuvent être imputés à un effet direct du fentanyl sur les ratons.
Remarques particulièresStabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Conserver dans l'emballage d'origine. Ne pas conserver au-dessus de 30°C. Conserver hors de la portée des enfants.
Remarques concernant la manipulation
Les comprimés buccaux comportant encore des restes de principe actif ne doivent jamais être jetés ou égarés. Les médicaments utilisés ou les déchets doivent être éliminés conformément à la réglementation nationale en vigueur.
Numéro d’autorisation57002 (Swissmedic).
PrésentationActiq, 200 µg: Emballages à 3 et 30 unités [A+]
Actiq, 400 µg: Emballages à 3 et 30 unités [A+]
Actiq, 600 µg: Emballages à 3 et 30 unités [A+]
Actiq, 800 µg: Emballages à 3 et 30 unités [A+]
Actiq, 1200 µg: Emballages à 3 et 30 unités [A+]
Actiq, 1600 µg: Emballages à 3 et 30 unités [A+]
Titulaire de l’autorisationCuratis AG, 4410 Liestal
Mise à jour de l’informationMars 2024.
|

