Propriétés/EffetsCode ATC
L01EH02
Mécanisme d'action
Le nératinib se lie au récepteur HER2, réduit les voies de signalisation Akt, la PKAM en aval et l'autophosphorylation de l'EGFR et de HER2, et inhibe potentiellement la prolifération des cellules tumorales in vitro. Le nératinib a inhibé les lignées cellulaires de carcinomes avec expression de HER2 et/ou d'EGFR présentant une CI50<100 nM.
Pharmacodynamique
Le nératinib est un inhibiteur de tyrosine kinase (ITK) pan-HER (ErbB) irréversible homologue de l'oncogène viral de la leucémie qui bloque la transduction des signaux des facteurs de croissance mitogènes par une liaison covalente à forte affinité au site de liaison de l'ATP de trois récepteurs du facteur de croissance épidermique (EGFR), à savoir l'EGFR (codé par ErbB1), HER2 (codé par ErbB2) et HER4 (codé par ErbB4) ou leurs hétérodimères actifs avec HER3 (codé par ErbB3). Cela donne lieu à une inhibition durable de ces voies favorisant la croissance dans le cadre des cancers du sein caractérisés par une surexpression ou une amplification de HER2 ou par une mutation de HER2.
Efficacité clinique
Dans le cadre de l'étude pivot de phase III, multicentrique, randomisée, en double aveugle et contrôlée contre placebo ExteNET (3004), 2 840 femmes présentant un cancer du sein HER2 positif précoce (tel que confirmé localement par un test) qui avaient suivi un traitement adjuvant par trastuzumab et une chimiothérapiejusqu'à son terme ont été randomisées selon un rapport de 1:1 afin de recevoir soit Nerlynx soit le placebo une fois par jour pendant un an. L'âge médian au sein de la population en intention de traiter (ITT) était de 52 ans (59,9% des patients étaient âgés de 50 ans ou plus, 12,3% de 65 ans ou plus); 81,0% des patients étaient caucasiens, 2,6% étaient noirs ou afro-américains, 13,6% étaient asiatiques et 2,9% n'appartenaient à aucune de ces catégories. Lors de l'entrée dans l'étude, 57,4% des patients avaient des récepteurs hormonaux positifs (définis comme des récepteurs à l'œstrogène [ER] positifs et/ou des récepteurs à la progestérone [PgR] positifs), 23,6% ne présentaient pas d'envahissement ganglionnaire, 46,8% présentaient un à trois ganglions envahis et 29,6% présentaient au moins quatre ganglions envahis. Environ 10% des patients présentaient des tumeurs de stade I, environ 40% des tumeurs de stade II et environ 30% des tumeurs de stade III. Le délai médian entre le dernier traitement adjuvant par trastuzumab et la randomisation était de 4,5 mois.
Le critère principal d'évaluation de l'efficacité de l'étude était la survie sans maladie invasive (invasive disease-free survival, iDFS). Les critères secondaires d'évaluation de l'efficacité de l'étude comprenaient la survie sans maladie (disease-free survival, DFS), y compris la survie sans carcinome canalaire in situ (DFS-DCIS), le délai de survenue d'une récidive distante (time to distant recurrence, TTDR), la survie sans maladie à distance (SSMD), l'incidence cumulée d'une rechute du système nerveux central et la survie globale (overall survival, OS).
L'analyse primaire de l'étude réalisée deux ans après la randomisation a démontré que Nerlynx avait permis de réduire le risque de récurrence de maladie invasive ou de décès de 34% (RR = 0,66 avec IC à 95% [0,49; 0,90], valeur du p bilatéral = 0,008) au sein de la population ITT.
Tableau 6: Analyses primaires d'efficacité - population ITT et population à récepteurs hormonaux positifs HER2 ayant terminé un traitement adjuvant préalable à base de trastuzumab et de chimiothérapie depuis moins d'un an
|
Variable
|
Taux estimés de survie sans événement à 2 ans1 (en %)
|
Risque relatif
(IC à 95%)2
|
Valeur du p3
| |
|
Population ITT
| |
|
Nerlynx
(N = 1 420)
|
Placebo
(N = 1 420)
|
|
| |
Survie sans maladie invasive
|
94,2
|
91,9
|
0,66
(0,49; 0,90)
|
0,008
| |
Survie sans maladie, y compris la survie sans carcinome canalaire in situ
|
94,2
|
91,3
|
0,61
(0,45; 0,83)
|
0,001
| |
Survie sans maladie à distance
|
95,3
|
94,0
|
0,74
(0,52; 1,05)
|
0,094
| |
Délai de survenue d'une récidive distante
|
95,5
|
94,2
|
0,73
(0,51; 1,04)
|
0,087
| |
Rechute du SNC
|
0,92
|
1,16
|
–
|
0,548
| |
|
Population à récepteurs hormonaux positifs ayant terminé un traitement à base de trastuzumab depuis moins d'un an
| |
|
Nerlynx
(N = 670)
|
Placebo
(N = 664)
|
Risque relatif
(IC à 95%)4
|
Valeur du p5
| |
Survie sans maladie invasive
|
95,3
|
90,8
|
0,49
(0,30; 0,78)
|
0,002
| |
Survie sans maladie, y compris la survie sans carcinome canalaire in situ
|
95,3
|
90,0
|
0,45
(0,28; 0,71)
|
<0,001
| |
Survie sans maladie à distance
|
96,1
|
92,9
|
0,53
(0,31; 0,88)
|
0,015
| |
Délai de survenue d'une récidive distante
|
96,3
|
93,3
|
0,53
(0,30; 0,89)
|
0,017
| |
Rechute du SNC
|
0,34
|
1,01
|
–
|
0,187
|
SNC = système nerveux central.
1 Taux de survie sans événement pour tous les critères d'évaluation, sauf pour la rechute du SNC pour laquelle une incidence cumulée est rapportée.
2 Modèle de risques proportionnels de Cox stratifié
3 Test de log-rank bilatéral stratifié pour tous les critères d'évaluation, sauf pour la rechute du SNC pour laquelle la méthode de Gray a été utilisée.
4 Modèle de risques proportionnels de Cox non stratifié
5 Test de log-rank bilatéral non stratifié pour tous les critères d'évaluation, sauf pour la rechute du SNC pour laquelle la méthode de Gray a été utilisée.
Figure 1: Courbe de Kaplan-Meier de la survie sans maladie - population à récepteurs hormonaux positifs et ayant terminé un traitement adjuvant préalable à base de trastuzumab et de chimiothérapie depuis moins d'un an
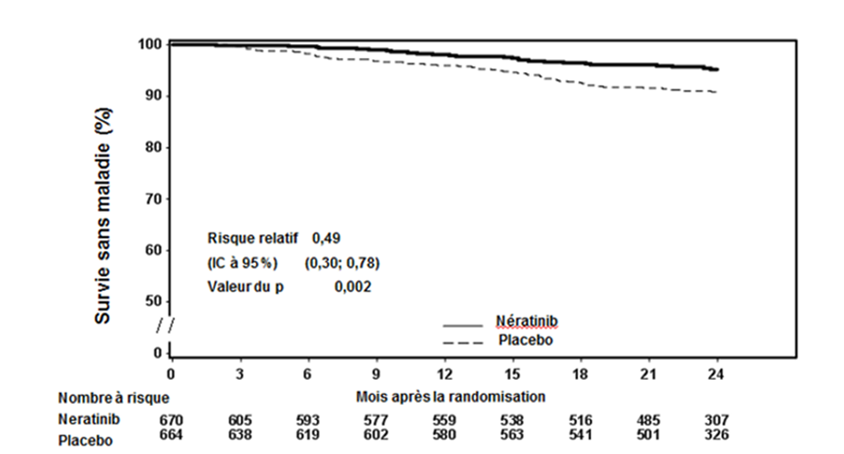
Environ 75% des patients ont fourni un nouveau consentement pour participer à un suivi s'étendant au-delà de 24 mois. Les observations comportant des données manquantes ont été censurées à la date de la dernière évaluation. Si le bénéfice du traitement par Nerlynx par rapport au placebo s'est poursuivi sur cinq ans, il n'est pas possible d'estimer de manière fiable l'ampleur de l'effet.
Chez les patients à récepteurs hormonaux négatifs, indépendamment du temps écoulé depuis le traitement par trastuzumab, le risque relatif d'IDFS à 2 ans était de 0,93, avec un IC à 95% (0,60; 1,43). L'efficacité n'a pas été démontrée pour cette population.
Seuls les patients avec un traitement préalable par trastuzumab et chimiothérapie ont été inclus dans l'étude pivot 3004.
En ce qui concerne les patients à récepteurs hormonaux positifs, le bénéfice relatif de Nerlynx au sein des sous-groupes de patients prédéfinis est présenté à la figure 2.
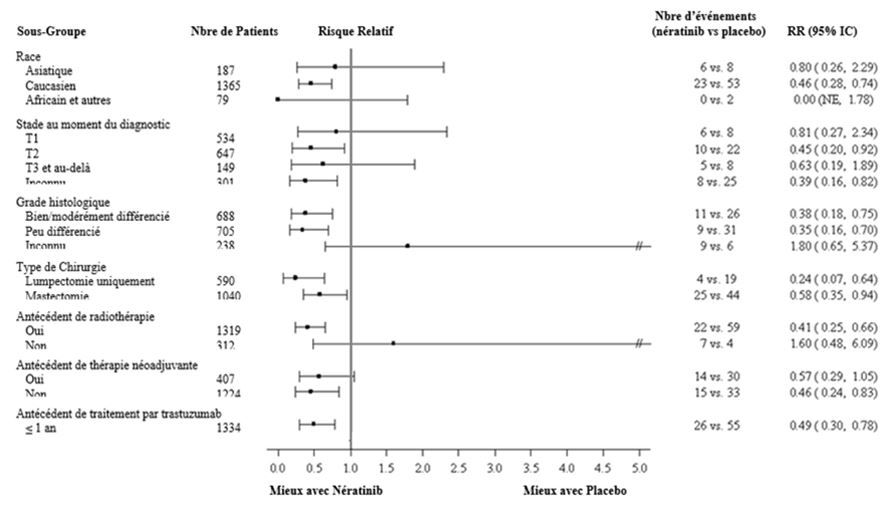
Sur les graphiques ci-dessous le risque absolu de récidive doit être pris en compte pour décider le rapport risque/bénéfice et donc l'utilité d'un traitement par Nerlynx dans chaque sous-groupe de patients. Dans ces analyses par sous-groupes de patients, il convient de retenir le nombre d'évènements de récidive dans chaque sous-groupe de patients et non seulement la réduction relative du risque de récidive pour estimer le bénéfice que peuvent obtenir les patients par un traitement par Nerlynx.
Figure 2: Patients à récepteurs hormonaux positifs, survie sans maladie par sous-groupe de patients
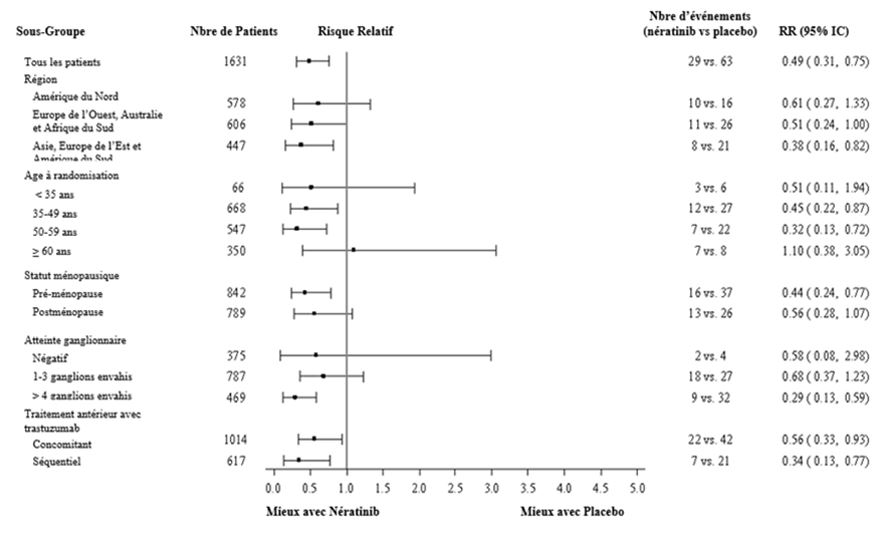
Figure 3: Patients à récepteurs hormonaux positifs, survie sans maladie par sous-groupe de patients (sous-groupes additionnels)
Aucune différence statistiquement significative de la survie globale n'a été observée entre les bras Nerlynx et placebo (RR 0,96 [IC à 95%: 0,75; 1,22]) dans la population ITT, à un suivi médian de 8,06 années.
Une tendance favorable au bras Nerlynx a été observée dans la population à récepteurs hormonaux positifs ayant terminé leur traitement à base de trastuzumab depuis moins d'un an (RR 0,79 [IC à 95%, 0,55; 1,13]).
|



