PharmakokinetikAbsorption
Aufgrund ihrer äusserst geringen Wasserlöslichkeit löst sich die Paliperidonpalmitat-Rezeptur als Depotinjektion für 3 Monate nach der intramuskulären Injektion langsam, bevor sie zu Paliperidon hydrolysiert und im Körperkreislauf resorbiert wird. Die Freisetzung des Arzneimittels beginnt bereits an Tag 1 und hält bis zu 18 Monate an.
Die in diesem Abschnitt beschriebenen Daten beruhen auf einer populationspharmakokinetischen Analyse. Nach einer intramuskulären Einzeldosis von Trevicta steigen die Plasmaspiegel von Paliperidon mit einer medianen Tmax von 30-33 Tagen allmählich auf die maximale Konzentration an. Nach intramuskulärer Injektion von Trevicta-Dosen von 175 bis 525 mg in den M. deltoideus wurde im Durchschnitt eine 11 bis 12% höhere Cmax als bei Injektion in den M. gluteus beobachtet. Das Freisetzungsprofil und Dosierungsschema von Trevicta führt zur Aufrechterhaltung der therapeutischen Konzentrationen. Die Gesamtexposition gegenüber Paliperidon nach der Verabreichung von Trevicta war über einen Dosisbereich von 175 bis 525 mg proportional zur Dosis und ungefähr proportional zur Dosis für Cmax. Das mittlere Verhältnis der maximalen und minimalen Steady-State-Werte bei einer Trevicta-Dosis lag nach glutealer Verabreichung bei 1,6 und nach deltoidaler Verabreichung bei 1,7.
Distribution
Das scheinbare Distributionsvolumen von Paliperidon nach Verabreichung von Trevicta beträgt 1960 Liter.
Die Plasmaproteinbindung von racemischen Paliperidon beträgt 74%.
Nach der Verabreichung von Trevicta kommt es zu einer Interkonversion der (+)- und (-)- Enantiomere von Paliperidon, wobei ein AUC(+)/(-)-Verhältnis von ca. 1,7 bis 1,8 erreicht wird.
Metabolismus
In einer Studie mit 14C-Paliperidon mit unverzüglicher Freisetzung wurden eine Woche nach der Verabreichung einer oralen Einzeldosis von 1 mg 14C-Paliperidon mit unverzüglicher Freisetzung 59% der Dosis unverändert über den Urin ausgeschieden, was bedeutet, dass Paliperidon in der Leber nicht extensiv metabolisiert zu werden scheint. Ungefähr 80% der verabreichten Radioaktivität wurden im Urin und 11% in den Fäzes wiedergefunden. In vivo wurden vier Stoffwechselwege identifiziert, wobei auf keinen mehr als 10% der Dosis entfallen: Dealkylierung, Hydroxylierung, Dehydrogenierung und Benzisoxazol-Abspaltung. Obwohl In vitro-Studien auf eine mögliche Beteiligung von CYP2D6 und CYP3A4 an der Umsetzung von Paliperidon hindeuten, gibt es in vivo keine Hinweise auf eine signifikante Rolle dieser Isoenzyme bei der Metabolisierung von Paliperidon. Populationspharmakokinetische Analysen zeigten keinen erkennbaren Unterschied zwischen extensiven Metabolisierern und langsamen Metabolisierern von CYP2D6-Substraten in Bezug auf die apparente Clearance von Paliperidon nach Anwendung von oralem Paliperidon. In-vitro-Studien mit humanen Lebermikrosomen zeigen, dass Paliperidon die Verstoffwechselung von Arzneimitteln, die von Cytochrom-P-450-Isozymen wie CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 und CYP3A5 umgesetzt werden, nicht in wesentlichem Umfang hemmt.
In vitro-Studien haben gezeigt, dass Paliperidon ein P-gp-Substrat und ein schwacher P-gp-Inhibitor bei hohen Konzentrationen ist. Es liegen keine In vivo-Daten vor, und die klinische Relevanz ist nicht bekannt.
Ausgehend von der populationspharmakokinetischen Analyse lag die mediane apparente Halbwertszeit von Paliperidon nach Verabreichung von Trevicta über den Dosisbereich von 175 bis 525 mg nach Injektion in den Deltoideus zwischen 84 und 95 Tagen und nach Injektion in den Gluteus zwischen 118 und 139 Tagen.
Paliperidonpalmitat-Depotinjektion für 3 Monate im Vergleich zu anderen Paliperidon-Rezepturen
Trevicta ist zur Gabe von Paliperidon alle 3 Monate bestimmt, während Paliperidonpalmitat als Depotinjektion für 1 Monat jeden Monat verabreicht wird. Wenn Trevicta in Dosen verabreicht wird, die 3,5 Mal höher sind als die entsprechende Dosis von Paliperidonpalmitat als Depotinjektion für 1 Monat, führt dies zu einer ähnlichen Paliperidonexposition wie nach Gabe entsprechender monatlicher Dosen der Paliperidonpalmitat-Depotinjektion für 1 Monat und wie nach Einnahme entsprechender Dosen von Paliperidon-Retardtabletten einmal täglich. Der Expositionsbereich bei Anwendung von Trevicta liegt innerhalb des Expositionsbereichs bei Anwendung der zugelassenen Dosisstärken der Paliperidon-Retardtabletten.
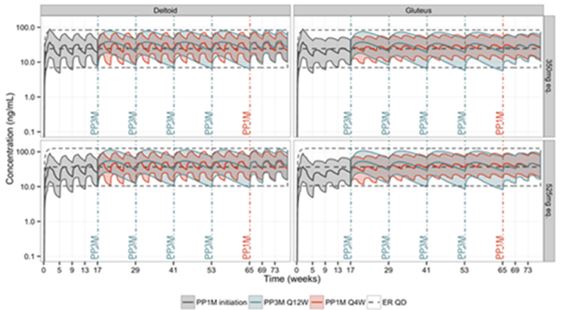
Abbildung 3 zeigt die populationsbezogen prognostizierten medianen pharmakokinetischen Profile von Paliperidon nach Verabreichung von Trevicta in der Dosis 350 mg und 525 mg im Vergleich zur Verabreichung monatlicher Injektionen von 100 mg und 150 mg Paliperidonpalmitat für 1 Monat und zur Einnahme oraler Retardtabletten (8 mg oder 12 mg). Eine mindestens 4-monatige Behandlung mit Paliperidonpalmitat als Depotinjektion für 1 Monat vor Beginn der Verabreichung von Trevicta führte zur Aufrechterhaltung der Paliperidon-Plasmaexposition im Steady-State.
Abbildung 3: Prognostizierte Paliperidonplasmakonzentrationen im Zeitverlauf bei Anwendung von Trevicta (PP3M) in den Dosisgruppen 350 mg und 525 mg im Vergleich zur monatlichen Gabe von Paliperidonpalmitat als Depotinjektion für 1 Monat (PP1M) in der Dosis 100 mg oder 150 mg. Die gestrichelten Linien zeigen die prognostizierten Paliperidonkonzentrationen nach Einnahme von oralen Paliperidon-Retardtabletten mit 8 mg und 12 mg
Elimination
Siehe Metabolismus.
Kinetik spezieller Patientengruppen
Leberfunktionsstörungen
Paliperidon wird nicht extensiv in der Leber metabolisiert. Zwar wurde Trevicta nicht bei Patienten mit eingeschränkter Leberfunktion untersucht, bei Patienten mit leichter oder mittelschwerer Einschränkung der Leberfunktion ist jedoch keine Anpassung der Dosis erforderlich. In einer Studie mit oralem Paliperidon bei Probanden mit mittelschwerer Einschränkung der Leberfunktion (Child- Pugh-Klasse B) waren die Plasmakonzentrationen von freiem Paliperidon ähnlich wie bei gesunden Probanden. Bei Patienten mit schwerer Einschränkung der Leberfunktion wurde Paliperidon nicht untersucht.
Nierenfunktionsstörungen
Trevicta wurde bei Patienten mit eingeschränkter Leberfunktion nicht systematisch untersucht. Die Disposition einer oralen Einzeldosis von 3 mg Paliperidon als Retard-Tablette wurde an Probanden mit unterschiedlich stark eingeschränkter Nierenfunktion untersucht. Die Elimination von Paliperidon nahm mit reduzierter geschätzter Creatininclearance ab. Die Gesamt-Clearance von Paliperidon war bei Probanden mit leichter Einschränkung der Nierenfunktion (CrCl = 50 bis <80 ml/min) um 32%, solchen mit mässiger Einschränkung (CrCl = 30 bis <50 ml/min) um 64% und solchen mit schwerer Einschränkung (CrCl = 10 bis <30 ml/min) um 71% verringert. Dies entspricht einer durchschnittlichen 1,5-, 2,6- bzw. 4,8-fachen Erhöhung der Exposition (AUCinf) im Vergleich zu gesunden Probanden. Auf Grundlage von wenigen Beobachtungen von Trevicta bei Probanden mit leichter Einschränkung der Nierenfunktion und pharmakokinetischen Simulationen wird bei Patienten mit leichter Einschränkung der Nierenfunktion eine reduzierte Einleitungs- und Erhaltungsdosis der Paliperidonpalmitat-Depotinjektion für 1 Monat empfohlen. Solche Patienten können auf Trevicta in der entsprechenden, mit dem Multiplikationsfaktor 3,5 berechneten Dosis umgestellt werden. Nach Beginn der Anwendung von Trevicta ist keine weitere Dosisreduzierung erforderlich (siehe «Dosierung/Anwendung»).
Ältere Patienten
Eine Dosisanpassung allein auf Grundlage des Alters wird nicht empfohlen. Es kann jedoch eine Dosisanpassung auf Grundlage einer altersbedingten Verminderung der Creatininclearance erforderlich sein (siehe «Nierenfunktionsstörungen» und «Dosierung/Anwendung»).
Ethnizität
In der populationspharmakokinetischen Analyse von Daten aus Studien mit oralem Paliperidon ergaben sich keine Anzeichen für ethnische Unterschiede in der Pharmakokinetik von Paliperidon nach Verabreichung von Trevicta.
Geschlecht
Es wurden keine klinisch signifikanten Unterschiede zwischen Männern und Frauen beobachtet.
Rauchen
Aus In vitro-Studien mit Enzymen der menschlichen Leber geht hervor, dass Paliperidon kein Substrat von CYP1A2 ist; Rauchen sollte daher keinen Einfluss auf die Pharmakokinetik von Paliperidon haben. In Korrelation mit diesen In vitro-Ergebnissen zeigte eine populationspharmakokinetische Auswertung keine Unterschiede zwischen Rauchern und Nichtrauchern.
Body Mass Index (BMI)/Körpergewicht
Es ist keine Anpassung der Dosis nach BMI erforderlich. Bei übergewichtigen und adipösen Patienten wurde eine niedrigere Cmax festgestellt. Im apparenten Steady-State bei Anwendung von Trevicta waren die Talspiegel bei normalgewichtigen, übergewichtigen und adipösen Patienten ähnlich.
| 